高考化学专题练习(二)物质结构、元素周期表和元素周期律附答案解析
- 格式:doc
- 大小:315.50 KB
- 文档页数:9

高中化学《元素周期表和元素周期律》练习题(附答案解析)学校:___________姓名:___________班级:________________一、单选题1.X 的最高价含氧酸的化学式为n 2n-2H XO ,则其气态氢化物的化学式为 ( )A .3n-12H XB .12-3n H XC .3n-4H XD .4-3n H X2.某化合物(结构如图所示)可用作酿造酵母的培养剂、强化剂、膨松剂、发酵助剂。
已知X 、Y 、Z 、W 为元素周期表中前20号元素且位于不同周期,原子序数依次增大,Y 为地壳中含量最高的元素。
下列有关说法正确的是( )A .Y 分别与X 、Z 、W 三种元素均可形成至少两种化合物B .单质的氧化性:Z Y X >>C .Z 最高价氧化物对应水化物的酸性强于硫酸D .X 与Z 形成的最简单化合物的沸点比X 与Y 形成的最简单化合物的沸点高3.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为X ,则乙的原子序数不可能为( )A .X+2B .X+4C .X+8D .X+104.判断下列元素既不属于主族元素又不属于短周期元素的是( )A .钾B .氧C .镧D .氯5.已知:A 、B 两元素的阴离子具有相同的电子层结构;A 元素的阴离子半径大于B 元素的阴离子半径;C 和B 两元素的原子核外电子层数相同;C 元素的原子半径大于A 元素的原子半径。
A 、B 、C 三种元素的原子序数的关系是( )A .A >B >C B .B >A >C C .C >A >BD .A >C >B6.根据元素性质的递变规律,下列四个演示金属钾与水反应的实验装置中最好的是( )A .B .C .D .7.下列说法正确的是( )A .有单质生成的化学反应一定是氧化还原反应B .NaCl 溶于水,在通电条件下电离成Na +和Cl -C .2Na O 和22Na O 由相同种类的元素组成,互为同素异形体D .随着原子序数递增,碱金属单质的熔点、沸点依次降低8.现有三种元素的基态原子的电子排布式如下:①1s 22s 22p 63s 23p 4;②1s 22s 22p 63s 23p 3;③1s 22s 22p 5。

专题06物质结构、元素周期律类题1 根据原子结构进行推断1.X、Y、Z、W为短周期主族元素,它们的最高正化合价和原子半径如下表所示:元素X Y Z W最高正化合价+3 +1 +5 +7原子半径0.082 0.186 0.110 0.099下列说法正确的是( )。
A.Z的最高价氧化物对应的水化物是强酸B.ZW5分子中所有原子最外层均满足8e-结构C.Y只能形成一种氧化物D.简单气态氢化物的热稳定性:W>Z>X2.短周期主族元素X、Y、Z、W 的原子序数依次增大。
X 原子的最外层电子数是K 层电子数的3倍;Z 的原子半径在短周期元素中最大;常温下,Z和W形成的化合物的水溶液pH>7, 呈弱碱性。
下列说法正确的是( )。
A.X 与W的最高正价相同B.Y、W的氢化物均为弱酸C.简单氢化物的沸点:X<WD.常温下,Z 和W的单质都能和水反应3.W、X、Y、Z是原子序数依次增大的短周期主族元素,W与X同周期,与Y同主族,X是非金属性最强的元素,Y的周期序数是其族序数的3倍,W原子的核外电子总数与Z原子的最外层电子数之和等于8。
下列说法错误的是( )。
A.最高价氧化物对应水化物的碱性:Y>WB.简单气态氢化物的稳定性:X>ZC.Y单质在空气中的燃烧产物只含离子键D.简单离子半径大小关系:Y<X<Z类题2 根据元素及其化合物的性质进行推断4.短周期主族元素X、Y、Z、W、Q的原子序数依次增大,其中X原子的质子总数与电子层数相等,X、Z同主族,Y、W同主族,且Y、W形成的一种化合物是常见的大气污染物。
下列说法错误的是( )。
A.简单离子半径: Z<Y<Q<WB.Y与Q能形成具有杀菌消毒作用的化合物C.W、Q的气态氢化物的水溶液的酸性:W<QD.电解Z与Q形成的化合物的水溶液,可制得Z单质5.X、Y、Z为短周期非金属元素,其相关性质如下,下列叙述错误的是( )。

高一化学(必修二)《原子结构 元素周期律》练习题及答案解析一、单选题1.元素周期表和元素周期律可以指导人们进行规律性的推测和判断。
下列说法不合理的是 A .由水溶液的酸性:HCl >HF ,不能推断出元素的非金属性:Cl >FB .人们可以在周期表的过渡元素中寻找催化剂和耐腐蚀、耐高温的合金材料C .原子半径随着周期序数的增加而增加D .短周期元素形成的微粒X 2-和Y 2+核外电子排布相同,离子半径:X 2->Y 2+ 2.下列说法正确的是A .SO 2能使酸性KMnO 4溶液褪色,故SO 2有漂白性B .NO 2与水反应生成HNO 3,故NO 2是酸性氧化物C .H 2SiO 3的酸性弱于H 2CO 3,故非金属性C 强于SiD .CaCO 3难溶于水,故CO 2能与CaCl 2溶液反应 3.下列关于物质应用错误的是 A .3NaHCO 用作烘焙糕点膨松剂 B .2SO 用作食品添加剂 C .34Fe O 用作磁性材料D .Si 做光导纤维4.下列关于硅酸的叙述,错误的是 A .硅酸是一种很弱的酸 B .硅酸的酸性比碳酸强C .硅酸不稳定,加热脱水会生成二氧化硅D .硅酸可以由可溶性硅酸盐与盐酸反应制得 5.下列有关物质的用途不正确...的是 A .用铁罐车贮存浓硫酸、浓硝酸、浓盐酸B .高纯度的硅可用于制作计算机的芯片和太阳能电池C .碳酸氢钠可用作焙制糕点的发酵粉,也可用作治疗胃酸过多的药剂D .金属镁常用来制造信号弹和焰火,氧化镁是优质的耐高温材料6.四种主族元素的离子a X m+、b Y n+、c Z n-和d R m-( a 、b 、c 、d 为元素的原子序数),它们具有相同的电子层结构,若m>n ,对下列叙述的判断正确的是①元素的原子序数:a>b>c>d ②a-b=m+n ③元素非金属性:Z R >④最高价氧化物对应水化物碱性:X Y > A .只有③B .①③C .①②③D .①②③④7.下列有关说法正确的是()A.元素周期表是元素按相对原子质量大小排列而成的B.元素周期表共有9个周期和18个族C.在金属元素与非金属元素的分界线附近寻找半导体材料D.第IA族元素,原子序数越大,金属性越弱8.下列关于元素周期律的叙述中不正确的是A.Na、Mg、Al最外层电子数依次增多,其单核离子的氧化性依次增强B.P、S、Cl最高正化合价依次升高,对应简单气态氢化物的稳定性依次增强C.原子半径大小关系为Na<Al<Si<ClD.Na、Mg、Al的氢氧化物的碱性依次减弱9.短周期元素 A、B、C、D 的原子序数依次增大,B 与C的简单离子具有相同的电子层结构,D 的最高正价与最低负价代数和为6。
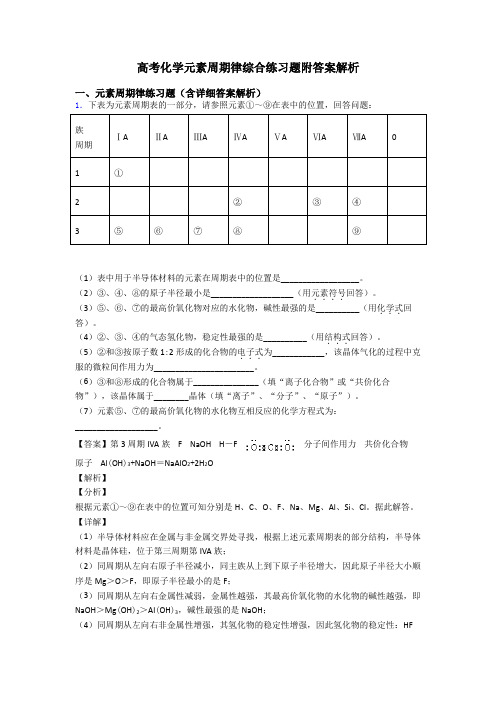
高考化学元素周期律综合练习题附答案解析一、元素周期律练习题(含详细答案解析)1.下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答问题:族ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0周期1①2②③④3⑤⑥⑦⑧⑨(1)表中用于半导体材料的元素在周期表中的位置是__________________。
(2)③、④、⑧的原子半径最小是___________________(用元素符号....回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是__________(用化学式...回答)。
(4)②、③、④的气态氢化物,稳定性最强的是__________(用结构式...回答)。
(5)②和③按原子数1:2形成的化合物的电子式...为____________,该晶体气化的过程中克服的微粒间作用力为_______________________。
(6)③和⑧形成的化合物属于_______________(填“离子化合物”或“共价化合物”),该晶体属于________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的化学方程式为:___________________。
【答案】第3周期IVA族 F NaOH H-F 分子间作用力共价化合物原子 Al(OH)3+NaOH=NaAlO2+2H2O【解析】【分析】根据元素①~⑨在表中的位置可知分别是H、C、O、F、Na、Mg、Al、Si、Cl。
据此解答。
【详解】(1)半导体材料应在金属与非金属交界处寻找,根据上述元素周期表的部分结构,半导体材料是晶体硅,位于第三周期第IVA族;(2)同周期从左向右原子半径减小,同主族从上到下原子半径增大,因此原子半径大小顺序是Mg>O>F,即原子半径最小的是F;(3)同周期从左向右金属性减弱,金属性越强,其最高价氧化物的水化物的碱性越强,即NaOH>Mg(OH)2>Al(OH)3,碱性最强的是NaOH;(4)同周期从左向右非金属性增强,其氢化物的稳定性增强,因此氢化物的稳定性:HF>H2O>CH4,最稳定的氢化物是HF,其结构式为H-F;(5)②和③按原子数1:2形成的化合物是CO2,其电子式为:,CO2属于分子晶体,熔化时克服分子间作用力;(6)③和⑧构成的化合物是SiO2,属于共价化合物,其晶体为原子晶体;(7)⑤是钠元素,其最高价氧化物的水化物是NaOH,⑦是Al,其最高价氧化物的水化物是Al(OH)3,Al(OH)3表现两性,与碱反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O。


高中化学必修2专题复习:物质结构元素周期律一、选择题(本题包括16小题,每小题3分,共48分。
每小题只有一个选项符合题意)1. 下列说法正确的是()A.某物质在熔融态下能导电,则该物质中一定含有离子键B.CaCl2中既有离子键又有共价键,所以CaCl2属于离子化合物C.N2和CS2两种分子中,每个原子的最外层都具有8电子稳定结构D.二氧化硅和干冰都是共价化合物,其溶于水的过程中均只需克服分子间作用力2. 核泄漏地区可检测到的放射性元素有55137Cs、55134Cs、53131I等。
下列叙述正确的是()A.55134Cs和55137Cs形成的单质物理性质相同B.55134Cs比53131I多3个中子C.55134Cs和55137Cs形成的单质化学性质基本相同D.55134Cs和55137Cs都是铯的同素异形体3. 目前,元素周期表的第七周期已被填满。
2017年,科学家发现的第113号、115号、117号和118号元素有了中文名称:已知第113号元素与Al元素同主族,根据元素周期律知识,下列预测或说法合理的是()A.Nℎ的最高价氧化物对应的水化物可能具有两性B.Mc在元素周期表中的位置是第七周期第ⅤB族C.根据金属元素和非金属元素的分界线,Ts的中文名称为“钿”可能更合理D.Og在元素周期表的所有元素中非金属性最强4. 下列说法不正确的是()A.H2O、H2S、H2Se的稳定性逐渐减弱B.Cl−、Br−、I−的失电子能力逐渐增强C.H+、Be2+、Li+的半径逐渐增大D.因为酸性:HCl>H2CO3,所以非金属性:Cl>C5. 下列各组比较中正确的是()A.熔点:Li<Na<KB.稳定性:CH4<NH3<H2O<HFC.酸性:HClO 4<H 2SO 4<H 3PO 4D.还原性:Br −<Cl −<S 2−6.短周期主族元素X 、Y 、Z 在周期表中的位置如图所示。
高考化学 原子结构与元素周期表 综合题及答案解析一、原子结构与元素周期表练习题(含详细答案解析)1.磷化铝(AlP )和磷化氢(PH 3)都是粮食储备常用的高效熏蒸杀虫剂。
(1)磷元素在元素周期表中的位置:________________。
AlP 遇水蒸气会发生反应放出PH 3气体,该反应的另一种产物的化学式为________。
(2)PH 3具有强还原性,能与CuSO 4溶液反应,配平该反应的化学方程式:________CuSO 4+_____PH 3+_____H 2O =_____Cu 3P ↓+_____H 3PO 4+_____H 2SO 4(3)工业制备PH 3的流程如图所示。
①次磷酸属于________元酸。
②白磷和烧碱溶液反应的化学方程式为:____________________________________。
③若起始时有1 mol P 4参加反应,则整个工业流程中共生成________mol PH 3。
(不考虑产物的损失)【答案】第3周期第VA 族 Al (OH )3 24 11 12 8 3 24 1 P 4 + 3NaOH + 3H 2O =PH 3↑+ 3NaH 2PO 2 2.5【解析】【分析】(1)原子结构中电子层数等于周期数,最外层电子数等于族序数,AlP 遇水蒸气会发生反应放出PH 3气体,根据元素守恒确定该反应的另一种产物的化学式;(2)配平化学方程式,就是通过在各物质的化学式前面添加系数,使反应中每种原子个数在反应前后相等的过程,但对于复杂的化学反应通常通过观察,找出变化的特点或规律,常使用化合价来配平,保证化合价升高与降低的数相等即可;(3)①根据物质电离出的氢离子数目确定酸的元数;②根据图示信息:白磷和烧碱溶液反应生成PH 3、NaH 2PO 2,据此书写方程式; ③根据发生反应的过程寻找关系式,进行计算即可。
【详解】(1)P 处于第3周期ⅤA 族,AlP 遇水蒸气会发生反应放出PH 3气体,根据元素守恒,确定该反应的另一种产物是Al (OH )3,故答案为:第3周期第VA 族;Al (OH )3;(2)该方程式中Cu 价态由+2下降为+1,P 价态由-3升高为+5,为保证化合价升降数相等,Cu 3P 与H 3PO 4计量数分别为8、3,CuSO 4的系数是24,H 2SO 4系数是24,根据元素守恒,得到:4323342424CuSO +11PH +12H O=8Cu P +3H PO +24H SO ↓,故答案为:24,11,12,8,3,24;(3)①根据氢氧化钠过量时只能生成NaH 2PO 2可知次磷酸只能电离出1个氢离子,因此次磷酸属于一元酸,故答案为:1;②根据图示信息:白磷和烧碱溶液反应生成PH 3、NaH 2PO 2,方程式为:42322P + 3NaOH + 3H O = PH + 3NaH PO ↑;故答案为:42322P + 3NaOH + 3H O = PH + 3NaH PO ;③P 4+3NaOH +3H 2O =PH 3↑+3NaH 2PO 2;2H 3PO 2=PH 3↑+H 3PO 4,即P 4~2.5PH 3,若起始时有1molP 4参加反应,则整个工业流程中共生成2.5molPH 3;故答案为:2.5。
题型一:原子结高考化学十年真题专题汇编-物质结构 元素周期表、周期律构化学键1.(2019·北京)2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。
中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。
铟与铷(37Rb)同周期。
下列说法不正确的是A.In 是第五周期第ⅢA 族元素B.的中子数与电子数的差值为17C.原子半径:In>AlD.碱性:In(OH)3>RbOH 【答案】D【解析】本题考查原子结构、元素周期表和元素周期律,考查的核心素养是证据推理与模型认知。
Rb 为碱金属,属于第五周期元素,故In 亦为第五周期元素,In 与Al 同主族,即为第ⅢA 族元素,A项正确;的中子数为115-49=66,质子数为49,质子数等于核外电子数,故中子数与电子数之差为17,B 项正确;同主族元素,从上到下,原子半径逐渐增大,故原子半径:In >Al ,C 项正确;同周期主族元素从左到右,金属性逐渐减弱,故其最高价氧化物对应水化物的碱性逐渐减弱,即碱性In(OH)3<RbOH ,D 项错误。
2.(2019·浙江)下列说法正确的是A.18O 2和16O 3互为同位素B.正己烷和2,2-二甲基丙烷互为同系物C.C 60和C 70是具有相同质子数的不同核素D.H 2NCH 2COOCH 3和CH 3CH 2NO 2是同分异构体【答案】B【解析】本题考查核素、同位素、同系物以及同分异构体的概念。
同位素的研究对象为原子,而18O 2和16O 3为单质,A 项错误;正己烷和2,2-二甲基丙烷结构相似,在分子组成上相差1个“CH 2”原子团,两者互为同系物,B 项正确;C 60和C 70均为单质,不是核素,C 项错误;H2NCH2COOCH3的分子式为C3H7NO2,而CH3CH2NO2的分子式为C2H5NO2,两者不是同分异构体,D项错误,故选B。
高考化学原子结构与元素周期表的综合复习附详细答案一、原子结构与元素周期表练习题(含详细答案解析)1.下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。
请根据要求回答问题:(1)②的元素符号是______。
(2)⑤和⑥两种元素的非金属性强弱关系是:⑤______⑥。
(3)①和③两种元素组成的化合物中含有的化学键为________(填“离子键”或“共价键”)。
(4)④和⑥两种元素组成的化合物与AgNO3溶液反应的离子方程式为__________。
【答案】C <共价键 Ag++Cl-=AgCl↓【解析】【分析】根据元素在周期表中的位置分析元素的种类;根据元素周期律及元素性质分析解答。
【详解】根据元素周期表的结构及元素在周期表中的位置分析知,①为氢,②为碳,③为氧,④为钠,⑤为硫,⑥为氯;(1)碳的元素符号是C,故答案为:C;(2)⑤和⑥处于相同周期,同周期元素随核电荷数增大,非金属性增强,则两种元素的非金属性强弱关系是:⑤<⑥,故答案为:<;(3)H和O两种元素组成的化合物中有H2O和H2O2,都属于共价化合物,含有的化学键为共价键,故答案为:共价键;(4)Na和Cl两种元素组成的化合物为NaCl,与AgNO3溶液反应生成氯化银沉淀和硝酸钠,离子方程式为:Ag++Cl-=AgCl↓,故答案为:Ag++Cl-=AgCl↓。
2.A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A原子核内无中子;B元素的最高价氧化物对应水化物与其氢化物能反应生成盐F;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的34,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物.请回答下列问题:(1)C元素在元素周期表中的位置是___;C、D、E三种元素简单离子半径由大到小的顺序为:___(用离子符号表示)。
(2)写出分别由A、D与C形成的原子个数比为1:1的化合物的电子式___、___。
煌敦市安放阳光实验学校第1章物质结构元素周期律练习解析(1)说明:本试卷分为第Ⅰ、Ⅱ卷两,请将第Ⅰ卷选择题的答案填入题后括号内,第Ⅱ卷可在各题后直接作答。
共100分,考试时间90分钟。
第Ⅰ卷(选择题共55分)一、选择题(每小题只有一个选项符合题意,每小题2分,共10分)1.决元素种类的因素是A.核外电子数B.最外层电子数C.核电荷数D.中子数【解析】元素由原子的质子数决,核电荷数与质子数相。
【答案】 C2.两种互为同位素的原子,不相同的是A.核电荷数B.电子层结构C.化学性质D.物理性质【解析】同位素指的是质子数相,中子数不同的原子,因此核电荷数相同。
【答案】 D3.家最近制造出第112号元素,其原子的质量数为277,这是迄今知道的最重的原子,关于该元素的下列叙述中正确的是A.其原子核内中子数和质子数都是112B.其原子核内中子数为165,核外电子数为112C.其原子质量是12C原子质量的277倍D.112号元素的相对原子质量是277【解析】质量数为质子数与中子数之和,中子数于277-112=165,所以112号元素核内有165个中子,核外有112个电子,B项正确,A不正确,某种原子的相对原子质量是该原子质量与一个12C同位素原子质量的1/12之比,而不是与12C原子质量之比,所以C不正确,因112号元素还可能有其他同位素,故D不正确。
【答案】 B4.下列粒子的半径关系正确的是A.r(Na)>r(Mg)>r(Al)>r(K)B.r(K+)>r(Ca2+)>r(S2-)>r(Cl-)C.r(Na)>r(K)>r(Ca)>r(Mg)D.r(F-)>r(Na+)>r(Mg2+)>r(Al3+)【解析】比较粒子半径可以从以下角度分析:(1)元素周期表中同主族元素随原子序数的增加,电子层数增加,原子半径增大,同周期元素随原子序数的增加,原子半径依次减小;(2)带电粒子与原子之间半径比较,当原子核外电子排布相同时,原子核内质子数越多,对核外电子的吸引越强,粒子半径越小。
高考化学专题练习(二)物质结构、元素周期表和元素周期律
【考点突破】
【例1】同位素2H 、15N 、18O 、34S 等常被用做陆地生态分析研究。
下列说法中正确的是( ) A .16O 和18O 是同一种核素
B .
1
182H O 的摩尔质量为20 C .34S 和15N 核内的中子数相差9
D .2H +核外电子数为0
【例2】下列粒子中,与+
4NH 具有相同质子数和电子数的是( ) A .OH -
B .F -
C .+Na
D .3NH
【例3】下列有关性质的比较,不能..用元素周期律解释的是( ) A .酸性:2434H SO H PO >
B .非金属性:Cl Br >
C .碱性:()2NaOH Mg OH >
D .热稳定性:233Na CO NaHCO >
【例4】下列离子中半径最大的是( ) A .Na +
B .2Mg +
C .2O -
D .F -
【例5】短周期元素T 、Q 、R 、W 在元素周期表中的位置如右图所示,其中T 所处的周期序数与主族族序数相等。
它们的最高价氧化物水化物依次为甲、乙、丙、丁。
下列叙述不正确的是( )
A .甲、乙、丙、丁受热均易分解
B .常温下丁的浓溶液可用T 单质所制的容器来盛装
C .丁的浓溶液与Q 的单质加热发生反应,可生成体积比为1:2的两种气体
D .R 的氧化物在空气中与其它物质作用可形成光化学烟雾 【例6】下列说法中正确的是( ) A .含有共价键的化合物一定是共价化合物 B .组成单质的分子内一定含有共价键
C .由非金属元素组成的化合物不一定是共价化合物
D .不同元素组成的多原子分子里的化学键一定为极性键 【例7】下列化学用语正确的是( ) A .22H O 的电子式()
2H :O:O :
H -
++
B 、2CO 的比例模型
C .2S -的结构示意图
D .次氯酸的结构式:H O Cl ——
【基础特训】
1.硼的最高价含氧酸的化学式不可能是( ) A .2HBO
B .23H BO
C .33H BO
D .247H B O
2.下列关于元素周期表的说法不正确...的是( ) A .元素周期表中一共有16个纵行
B .除零族元素外,非金属元素全都是主族元素
C .同周期ⅡA 族与ⅢA 族元素的原子序数之差可能为25
D .同族上下相邻两种元素的原子序数之差可能为32
3.已知W 、X 、Y 、Z 为短周期元素,原子序数依次增大。
W 、Z 同主族,X 、Y 、Z 同周期,其中只有X 为金属元素。
下列说法一定正确的是( ) A .原子半径:X Y Z W >>>
B .W 的含氧酸的酸性比Z 的含氧酸的酸性强
C .W 的气态氢化物的稳定性小于Y 的气态氢化物的稳定性
D .若W 与X 原子序数差为5,则形成化合物的化学式为32X W
4.四种短周期主族元素W 、X 、Y 、Z 的原子序数依次增大,W 、X 的简单离子具有相同电子层结构,X 的原子半径是短周期主族元素原子中最大的,W 与Y 同族,Z 与X 形成的离子化合物的水溶液呈中性。
下列说法正确的是( ) A .简单离子半径:W X Z <<
B .W 与X 形成的化合物溶于水后溶液呈碱性
C .气态氢化物的热稳定性:W Y <
D .最高价氧化物的水化物的酸性:Y Z >
5.短周期主族元素X 、Y 、Z 、W 原子序数依次增大,X 原子的最外层有6个电子,Y 是迄今发现的非金属性最强的元素,在周期表中Z 位于IA 族,W 与X 属于同一主族。
下列说法正确的是( ) A .元素X 、W 的简单阴离子具有相同的电子层结构 B .由Y 、Z 两种元素组成的化合物是离子化合物 C .W 的简单气态氢化物的热稳定性比Y 的强 D .原子半径:r(X)r(Y)r(Z)r(W)<<<
6.下列不能说明氯的非金属性比硫强的事实是( ) ①HCl 比2H S 稳定
②HCl 和2H S 的水溶液前者的的酸性强 ③4HClO 酸性比24H SO 强 ④2Cl 能与2H S 反应生成S
⑤Cl 原子能得1个电子变成稳定离子而S 原子能得两个电子
32H O ,从而验证2H O 继而可以验,你认为此设计是否合理?并说明理由:______________________________。
)利用下图装置可以验证非金属性的变化规律。
干燥管___________________________。