无菌医疗器械现场检查指导原则重点项
- 格式:docx
- 大小:23.55 KB
- 文档页数:6

医疗器械生产质量管理规范现场检查指导原则【1】为加强医疗器械生产监督管理,指导监管部门对医疗器械生产企业实施《医疗器械生产质量管理规范》及其相关附录的现场检查和对检查结果的评估,根据《医疗器械生产质量管理规范》及其相关附录,国家食品药品监督管理总局组织制定了《医疗器械生产质量管理规范现场检查指导原则》《医疗器械生产质量管理规范无菌医疗器械现场检查指导原则》《医疗器械生产质量管理规范植入性医疗器械现场检查指导原则》《医疗器械生产质量管理规范体外诊断试剂现场检查指导原则》。
现印发给你们,请遵照执行。
[1]指导原则用于指导监管部门对医疗器械生产企业实施《医疗器械生产质量管理规范》及相关附录的现场检查和对检查结果的评估,适用于医疗器械注册现场核查、医疗器械生产许可(含延续或变更)现场检查,以及根据工作需要对医疗器械生产企业开展的各类监督检查。
[1]中文名医疗器械生产质量管理规范现场检查指导原则发文机构国家食品药品监督管理总局发文号食药监械监〔2015〕218号发文时间2015年9月25日目录1. 1机构和人员2. 2厂房与设施3. 3设备4. 4文件管理机构和人员编辑1.1.1 应当建立与医疗器械生产相适应的管理机构,具备组织机构图。
查看提供的质量手册,是否包括企业的组织机构图,是否明确各部门的相互关系。
[1]*1.1.2 应当明确各部门的职责和权限,明确质量管理职能。
查看企业的质量手册,程序文件或相关文件,是否对各部门的职责权限作出规定;质量管理部门应当能独立行使职能,查看质量管理部门的文件,是否明确规定对产品质量的相关事宜负有决策的权利。
1.1.3 生产管理部门和质量管理部门负责人不得互相兼任。
查看公司的任职文件或授权文件并对照相关生产、检验等履行职责的记录,核实是否与授权一致。
1.2.1 企业负责人应当是医疗器械产品质量的主要责任人。
1.2.2 企业负责人应当组织制定质量方针和质量目标。
查看质量方针和质量目标的制定程序、批准人员。

医疗器械生产质量管理规范现场检查指导原则 Jenny was compiled in January 2021医疗器械生产质量管理规范现场检查指导原则为加强生产监督管理,指导监管部门对医疗器械生产企业实施《医疗器械生产质量管理规范》及其相关附录的现场检查和对检查结果的评估,根据《医疗器械生产质量管理规范》及其相关附录,国家食品药品监督管理总局组织制定了《医疗器械生产质量管理规范现场检查指导原则》《医疗器械生产质量管理规范无菌医疗器械现场检查指导原则》《医疗器械生产质量管理规范植入性医疗器械现场检查指导原则》《医疗器械生产质量管理规范体外诊断试剂现场检查指导原则》。
现印发给你们,请遵照执行。
[1]指导原则用于指导监管部门对医疗器械生产企业实施《医疗器械生产质量管理规范》及相关附录的现场检查和对检查结果的评估,适用于医疗器械注册现场核查、医疗器械生产许可(含延续或变更)现场检查,以及根据工作需要对医疗器械生产企业开展的各类监督检查。
[1]中文名医疗器械生产质量管理规范现场检查指导原则发文机构国家食品药品监督管理总局发文号食药监械监〔2015〕218号?发文时间2015年9月25日目录1.12.3.24.5.36.7.48.2.3.64.5.76.7.88.1.92.机构和人员应当建立与医疗器械生产相适应的管理机构,具备组织机构图。
查看提供的质量手册,是否包括企业的组织机构图,是否明确各部门的相互关系。
[1]* 应当明确各部门的职责和权限,明确质量管理职能。
查看企业的质量手册,程序文件或相关文件,是否对各部门的职责权限作出规定;质量管理部门应当能独立行使职能,查看质量管理部门的文件,是否明确规定对产品质量的相关事宜负有决策的权利。
生产管理部门和质量管理部门负责人不得互相兼任。
查看公司的任职文件或授权文件并对照相关生产、检验等履行职责的记录,核实是否与授权一致。
企业负责人应当是医疗器械产品质量的主要责任人。
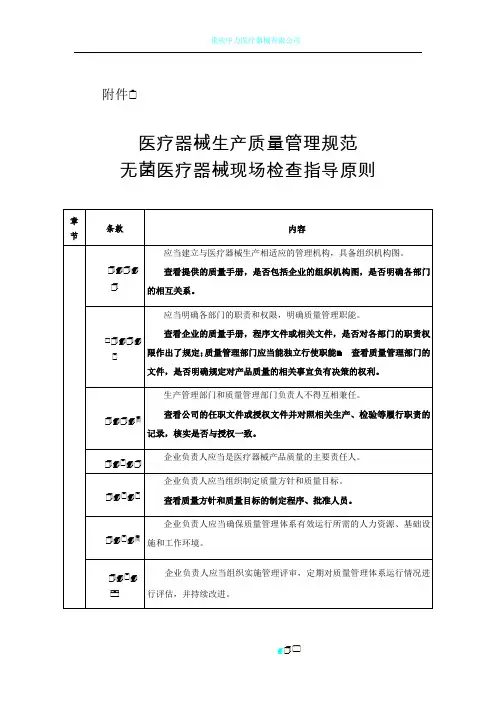
附件
医疗器械生产质量管理规范无菌医疗器械现场检查指导原则
注解:
本指导原则条款编号的编排方式为:✠ ✠ ✠ ,其中✠ 为章节的顺序号,如 的第一位✠ 表示❽机构与人员❾章节, 的第一位✠ 表示❽厂房与设施❾章节;✠ 为同一章节内条款的顺序号,如 的第二位✠ 表示❽机构与人员❾章节第一条要求, 的第二位✠ 表示❽机构与人员❾章节第二条要求;✠ 为同一条款内细化的检查指导的顺序号,如 的第三位✠ 表示❽机构与人员❾章节对第一条要求细化的第一个检查要点, 的第三位✠ 表示❽机构与人员❾章节对第一条要求细
化的第二个检查要点。
其他章节编号规则相同。
每一章节的检查指导原则由前后两部分组成,每章的前半部分是按照《医疗器械生产质量规范》所规定条款制定的检查指导,每章的后半部是按照《医疗器械生产质量规范附录无菌医疗器械》所规定条款制定的检查指导。
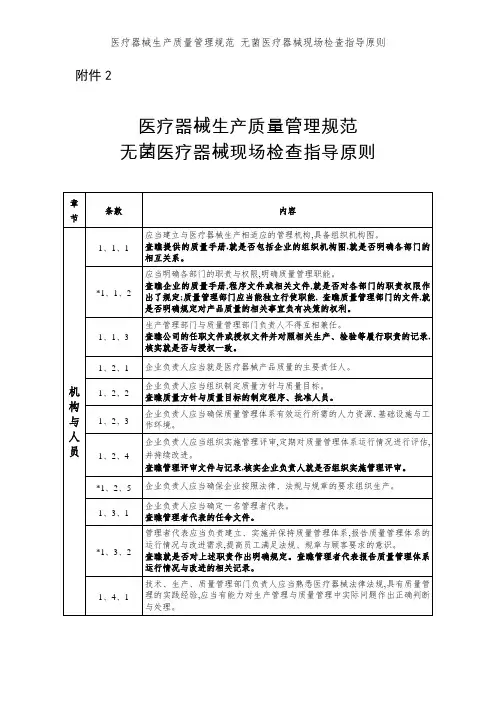
附件2
医疗器械生产质量管理规范
无菌医疗器械现场检查指导原则
注解:
1、本指导原则条款编号的编排方式为:X1、X
2、X3,其中X1为章节的顺序号,如1、1、1的第一位X1表示“机构与人员”章节,2、1、1
的第一位X1表示“厂房与设施”章节;X2为同一章节内条款的顺序号,如1、1、1的第二位X2表示“机构与人员”章节第一条要求,1、2、1的第二位X2表示“机构与人员”章节第二条要求;X3为同一条款内细化的检查指导的顺序号,如1、1、1的第三位X3表示“机构与人员”章节对第一条要求细化的第一个检查要点,1、1、2的第三位X3表示“机构与人员”章节对第一条要求细化的第二个检查要点。
其她章节编号规则相同。
2、每一章节的检查指导原则由前后两部分组成,每章的前半部分就是按照《医疗器械生产质量规范》所规定条款制定的检查指导,每章的后半部就是按照《医疗器械生产质量规范附录无菌医疗器械》所规定条款制定的检查指导。

医疗器械生产质量管理规范无菌医疗器械现场检查指导原则一、背景和目的医疗器械生产质量管理是确保医疗器械安全有效的重要环节,无菌医疗器械是临床操作中必不可少的重要工具。
无菌医疗器械的生产过程及其现场检查,对于确保其质量安全具有重要意义。
本文旨在介绍医疗器械生产质量管理规范无菌医疗器械现场检查的指导原则,以提高医疗器械生产质量管理的水平,保障患者的安全使用。
二、无菌医疗器械生产质量管理规范1.公司管理要求(1)建立并执行质量管理体系,明确质量目标和责任;(2)制定并执行质量管理规范,确保各个环节符合相关标准;(3)建立并执行员工培训计划,提升员工的专业素质和操作技能;(4)建立并执行设备维护计划,确保生产设备的有效运行;(5)建立并执行校准和验证计划,确保测量设备和测试方法的准确性。
2.生产管理要求(1)制定并执行生产计划,保证生产进度;(2)实施无菌生产工艺,确保产品符合质量要求;(3)制定并执行原料采购和存储管理规范,保证原料质量;(4)建立并执行生产设备清洁和消毒程序,防止交叉污染;(5)建立并执行产品包装和标识规范,确保产品完整;(6)建立并执行产品追溯体系,能够追溯产品质量问题的起源。
3.实施过程监控要求(1)建立并执行定期检查计划,遵循规定的检查程序;(2)监控生产过程的关键参数,确保生产的一致性;(3)建立并执行制品样品检验程序,保证产品质量;(4)制定并执行物料供应商审核和评价程序,保证原料质量;(5)建立并执行不合格品管理程序,及时处理不合格品。
1.检查对象和检查要点(1)检查对象:医疗器械生产企业无菌医疗器械生产过程;(2)检查要点:①生产车间的布局和环境卫生;②无菌室(区)的硬件设施和运行状态;③无菌室(区)的洁净度和压力差;④无菌器械生产工艺的执行情况,包括无菌过程、灭菌过程等;⑤原材料的采购和存储管理;⑥检查记录和报告的保存情况。
2.检查方法和注意事项(2)注意事项:①检查前应提前通知检查对象,确保能够提供相关记录和材料;②检查过程中与被检查对象进行沟通,了解相关问题的现状和改进措施;③检查后及时编制检查报告和整改要求,督促被检查对象进行整改;④检查结果应及时反馈给相关部门,确保整改措施的落实。
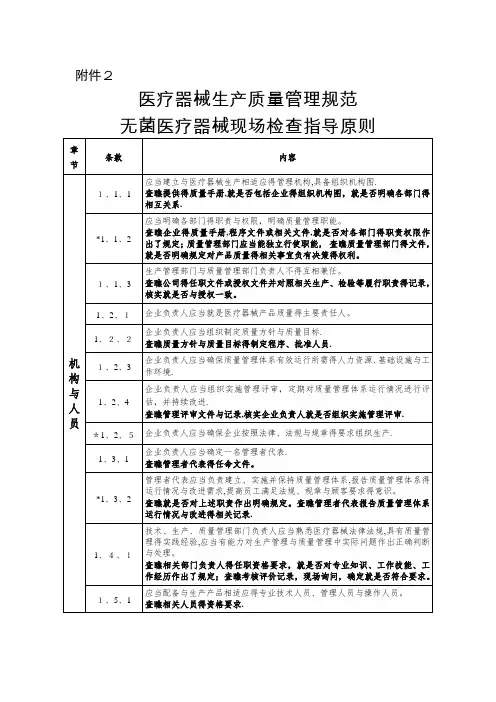
附件2
医疗器械生产质量管理规范
注解:
1、本指导原则条款编号得编排方式为:X1、X
2、X3,其中X1为章节得顺序号,如1、1、1得第一位X1表示“机构与人员”章节,2、1、1得第一位X1表示“厂房与设施"章节;X2为同一章节内条款得顺序号,如1、1、1得第二位X2表示“机构与人员”章节第一条要求,1、2、1得第二位X2表示“机构与人员”章节第二条要求;X3为同一条款内细化得检查指导得顺序号,如1、1、1得第三位X3表示“机构与人员”
章节对第一条要求细化得第一个检查要点,1、1、2得第三位X3表示“机构与人员”章节对第一条要求细化得第二个检查要点.
其她章节编号规则相同。
2、每一章节得检查指导原则由前后两部分组成,每章得前半部分就是按照《医疗器械生产质量规范》所规定条款制定得检查指导,每章得后半部就是按照《医疗器械生产质量规范附录无菌医疗器械》所规定条款制定得检查指导.。

无菌医疗器械现场检查指导原则培训1. 引言无菌医疗器械在医疗领域起着重要的作用,对于手术和其他医疗操作具有至关重要的意义。
为了确保无菌医疗器械的质量和安全性,现场检查是必不可少的环节。
本次培训将介绍无菌医疗器械现场检查的指导原则,以帮助相关人员正确进行现场检查工作。
2. 现场检查前的准备工作在进行无菌医疗器械现场检查之前,需要做好以下准备工作:•确定检查范围:明确要检查的无菌医疗器械种类和数量,确保覆盖所有关键环节。
•准备必要设备:如手套、口罩、护目镜等个人防护装备,以及放大镜、探头灯等辅助工具。
•检查计划编制:根据实际情况制定详细的检查计划,包括时间安排、责任分工等内容。
3. 现场检查过程无菌医疗器械现场检查的过程主要包括以下几个步骤:3.1 环境检查•检查手术室或其他使用无菌医疗器械的场所的环境卫生情况,包括地面、墙壁、天花板等。
•检查空气净化设备和通风系统的运行情况,确保符合相关要求。
•检查无菌区域的隔离措施是否到位,如门窗密封性、负压控制等。
3.2 器械检查•对每个使用过的无菌医疗器械进行检查,包括外观、标识、包装完整性等。
•检查器械包装是否符合要求,如密封性、防水性等。
•检查无菌指示剂是否正确变色,并核实指示剂与器械包装上标注的信息是否一致。
3.3 操作流程检查•观察操作人员在使用无菌医疗器械时是否按照规定的操作流程进行。
•检查操作人员是否佩戴个人防护装备,并注意手部卫生情况。
•核实操作人员是否按照无菌操作的要求进行,如避免直接接触无菌器械、避免污染等。
3.4 记录和问题整改•在现场检查过程中及时记录发现的问题和不合格项。
•对于发现的问题,及时与相关人员沟通,制定整改措施,并跟踪整改情况。
•对于严重的问题或重复出现的问题,及时上报并采取相应的纠正措施。
4. 现场检查后的工作无菌医疗器械现场检查结束后,还需要做好以下工作:•汇总检查结果和问题整改情况,形成检查报告。
•将检查报告交由相关部门进行审核和归档。

4医疗器械生产质量管理规范无菌医疗器械现场检查指导原则无菌医疗器械的生产质量管理是保障患者安全的重要环节。
为了确保无菌医疗器械的生产质量,有必要制定规范的检查指导原则。
下面将就4医疗器械生产质量管理规范无菌医疗器械现场检查指导原则进行详细阐述。
首先,无菌医疗器械的生产质量管理规范应包括产前、产中和产后三个环节。
产前环节包括原材料的选择和采购,生产设备的选型和调试,无菌领域的技术培训等。
产中环节包括生产工艺的控制,设备运行状况的监测,生产人员的操作规范等。
产后环节包括产品质量检验的合格率、灭菌效果的验证、产品追溯等。
因此,在检查指导原则中应体现这三个环节的要求和要点。
其次,检查指导原则应注重无菌医疗器械生产过程中关键节点的监控。
例如,在原材料选择和采购环节,应检查供应商的合规证书和质量合格证明,确保原材料的质量。
在生产工艺控制环节,应检查设备的正常运行和参数设定是否符合要求,生产操作是否规范。
在产品质量检验环节,应检查检测设备的正常使用,检验人员的操作规范,检验结果的准确性等关键要素。
检查指导原则需做到具体明确,指导性强,以实际生产过程为基础。
此外,检查指导原则还应包括无菌医疗器械生产质量管理规范中的文档和记录管理。
无菌医疗器械生产过程中的各个环节和关键控制点需要有相应的文件和记录进行管理。
检查指导原则应明确要求生产单位做到“三同时”,即记录同生产,票据同实物,质量记录同生产活动,确保相关记录的真实可信和易于追溯。
最后,检查指导原则应强调现场管理和随时整改的要求。
现场管理是无菌医疗器械生产质量管理的核心,也是确保无菌医疗器械生产质量的关键。
因此,在检查指导原则中应对现场管理的要求进行详细说明,如生产现场的布局、清洁环境、无菌操作技术等。
同时,检查指导原则还要求生产单位在发现问题和隐患时能够及时整改,如在检查中发现了无菌区域存在交叉污染的情况,生产单位要立即采取措施进行整改。
综上所述,4医疗器械生产质量管理规范无菌医疗器械现场检查指导原则需要包括产前、产中和产后三个环节的要求,注重关键节点的监控,以实际生产为基础,强调文档和记录管理,要求现场管理和随时整改。

附件2
医疗器械生产质量管理规范
注解:
1.本指导原则条款编号的编排方式为:X1.X2。
X3,其中X1为章节的顺序号,如1.1.1的第一位X1表示“机构与人员”章节,
2.1。
1的第一位X1表示“厂房与设施”章节;X2为同一章节内条款的顺序号,如1。
1。
1的第二位X2表示“机构与人员"章节第一条要求,1。
2。
1的第二位X2表示“机构与人员”章节第二条要求;X3为同一条款内细化的检查指导的顺序号,如1.1.1的第三位X3表示“机构与人员”章节对第一条要求细化的第一个检查要点,1。
1.2的第三位X3表示“机构与人员”章
节对第一条要求细化的第二个检查要点.
其他章节编号规则相同。
2.每一章节的检查指导原则由前后两部分组成,每章的前半部分是按照《医疗器械生产质量规范》所规定条款制定的检查指导,每章的后半部是按照《医疗器械生产质量规范附录无菌医疗器械》所规定条款制定的检查指导。
附件2
医疗器械生产质量管理规范
无菌医疗器械现场检查指导原则
注解:
1.本指导原则条款编号的编排方式为:,其中X1为章节的顺序号,如的第一位X1表示“机构与人员”章节,的第一位X1表示“厂房与设施”
章节;X2为同一章节内条款的顺序号,如的第二位X2表示“机构与人员”章节第一条要求,的第二位X2表示“机构与人员”章节第二条要求;X3为同一条款内细化的检查指导的顺序号,如的第三位X3表示“机构与人员”章节对第一条要求细化的第一个检查要点,的第三位X3表示“机构与人员”章节对第一条要求细化的第二个检查要点。
其他章节编号规则相同。
2.每一章节的检查指导原则由前后两部分组成,每章的前半部分是按照《医疗器械生产质量规范》所规定条款制定的检查指导,每章的后半部是按照《医疗器械生产质量规范附录无菌医疗器械》所规定条款制定的检查指导。
附件2
医疗器械生产质量管理规范
注解:
1.本指导原则条款编号的编排方式为:X1.X
2.X3,其中X1为章节的顺序号,如1。
1.1的第一位X1表示“机构与人员”章节,2.1。
1的第一位X1表示“厂房与设施”章节;X2为同一章节内条款的顺序号,如1。
1.1的第二位X2表示“机构与人员"章节第一条要求,1.2。
1的第二位X2表示“机构与人员"章节第二条要求;X3为同一条款内细化的检查指导的顺序号,如1.1。
1的第三位X3表示“机构与人员"章节对第一条要求细化的第一个检查要点,1.1.2的第三位X3表示“机构与人员”章节对第一条要求细化的第二个检查要点。
其他章节编号规则相同。
2。
每一章节的检查指导原则由前后两部分组成,每章的前半部
分是按照《医疗器械生产质量规范》所规定条款制定的检查指导,每章的后半部是按照《医疗器械生产质量规范附录无菌医疗器械》所规定条款制定的检查指导.。
附件2
医疗器械生产质量管理规范无菌医疗器械现场检查指导原则
注解:
1.本指导原则条款编号的编排方式为:X1.X
2.X3,其中X1为章节的顺序号,如1.1.1的第一位X1表示“机构与人员”章节,2.1.1的第一位X1表示“厂房与设施”章节;X2为同一章节内条款的顺序号,如1.1.1的第二位X2表示“机构与人员”章节第一条要求,1.2.1的第二位X2表示“机构与人员”章节第二条要求;X3为同一条款内细化的检查指导的顺序号,如1.1.1的第三位X3表示“机构与人员”章节对第一条要求细化的第一个检查要点,1.1.2的第三位X3表示“机构与人员”章节对第一条要求细化的第二个检查要点。
其他章节编号规则相同。
2.每一章节的检查指导原则由前后两部分组成,每章的前半部分是按照《医疗器械生产质量规范》所规定条款制定的检查指导,每章的后半部是按照《医疗器械生产质量规范附录无菌医疗器械》所规定
条款制定的检查指导。
附件2
医疗器械临盆质量治理规范
无菌医疗器械现场检讨指点原则
注解:
1.本指点原则条目编号的编排方法为:X1.X
2.X3,个中X111暗示“厂房与举措措施”章节;X222暗示“机构与人员”章节第二条请求;X333暗示“机构与人员”章节对第一条请求细化的第二个检讨要点.
其他章节编号规矩雷同.
2.每一章节的检讨指点原则由前后两部分构成,每章的前半部分是按照《医疗器械临盆质量规范》所划定条目制订的检讨指点,每章的后半部是按照《医疗器械临盆质量规范附录无菌医疗器械》所划定条目制订的检讨指点.。
关于蝴蝶的散文坐在庭院里看书,偶然抬头,看见一只蝴蝶从风中穿行而来,不偏不斜的落在了一朵紫色的小花上。
这是一朵非常普通的花。
虽然它的颜色很美,但在野外和路边随处可见。
此刻,它正试图张开花瓣迎接蝴蝶的好运。
我在想,旁边有几株玫瑰花开得正盛,难道这只蝴蝶没有看见吗?野花花蜜哪有玫瑰花蜜来得更芳香醇厚惹人喜爱呢,它应该去吸取玫瑰花蜜才是呀!所以我忍不住站起来向它吹气,试图把它开到附近的玫瑰花丛里,但它一动不动。
我伸出手去抓它,它被迫升到了空中。
几秒钟后,它飞回了紫色的小花。
它的行为似乎向我表明了它的决心。
外界的干扰和封锁也未能引起人们的共鸣,也未能将它从紫色的花朵中分离出来。
深情的专注和忘记吸取花蜜的方式就像在爱中对待你的爱人。
我想,“儿子不是鱼。
我知道鱼的快乐。
”我不是蝴蝶。
我怎么知道它的偏好?放开它!也许,艳丽繁华高贵固然是美,朴素单纯平凡也未尝没有吸引人处,照样也可以美得极致。
我抬头一看,看见了大片的云朵。
我想知道人们在追求爱情的时候和这只蝴蝶有多相似!蝴蝶体贴而深情的外表很像我们年轻时的爱情。
如果你在脑海中遇见了那朵花,即使它充满了繁华和锦绣,不管你有多迷人,我眼中只有一朵,我眼中和心中都没有其他花朵的容身之地。
即使这朵花在别人眼里很普通,也不会阻止我们追随它的身影,更不用说无视外界的压力和阻碍。
它全心全意地投入其中,想要奉献一切,在彼此面前展示我们的心。
可是,人的感觉是会不断的变化的,世间的万事万物都不是永恒的事物,它终有结束之曰,再深的依恋有一天也会成为过去式。
看看你对什么的爱。
早上的感觉和晚上完全不同。
今天和明天是不同的。
因为人们的情感不是凝固的,而是不断流动的。
你如何确保它们是永恒的?你看这只蝴蝶,尽管它刚刚是那么的深情专注于那朵紫色的小花,可是它并没有执着于在一朵花上,而是吸完花蜜,又去寻找另外一朵能让自己专情的花了。
这一点上,人追求情欲的心理与这只蝴蝶是何其的相似。
“与生俱来的爱”。
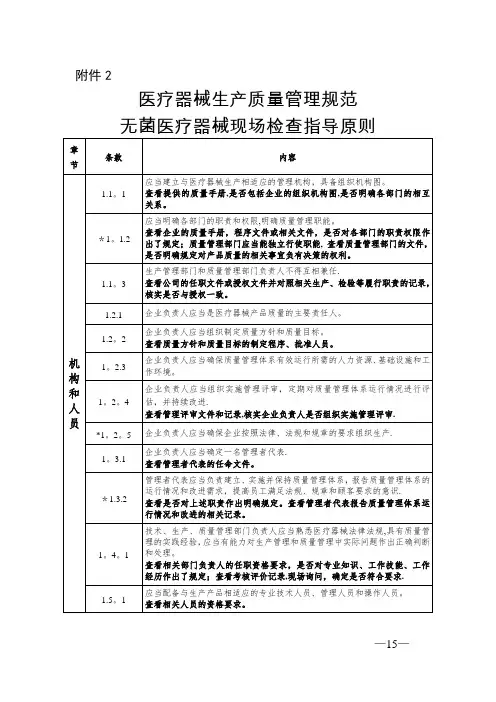
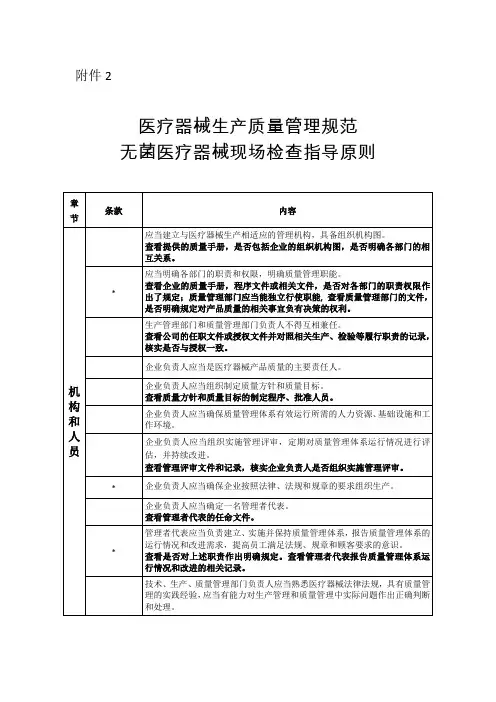
附件2医疗器械生产质量管理规范无菌医疗器械现场检查指导原则章节条款内容机构和人员1.1.1应当建立与医疗器械生产相适应的管理机构,具备组织机构图。
查看提供的质量手册,是否包括企业的组织机构图,是否明确各部门的相互关系。
*1.1.2应当明确各部门的职责和权限,明确质量管理职能。
查看企业的质量手册,程序文件或相关文件,是否对各部门的职责权限作出了规定;质量管理部门应当能独立行使职能,查看质量管理部门的文件,是否明确规定对产品质量的相关事宜负有决策的权利。
1.1.3生产管理部门和质量管理部门负责人不得互相兼任。
查看公司的任职文件或授权文件并对照相关生产、检验等履行职责的记录,核实是否与授权一致。
1.2.1企业负责人应当是医疗器械产品质量的主要责任人。
1.2.2企业负责人应当组织制定质量方针和质量目标。
查看质量方针和质量目标的制定程序、批准人员。
1.2.3企业负责人应当确保质量管理体系有效运行所需的人力资源、基础设施和工作环境。
1.2.4企业负责人应当组织实施管理评审,定期对质量管理体系运行情况进行评估,并持续改进。
查看管理评审文件和记录,核实企业负责人是否组织实施管理评审。
*1.2.5企业负责人应当确保企业按照法律、法规和规章的要求组织生产。
1.3.1企业负责人应当确定一名管理者代表。
查看管理者代表的任命文件。
*1.3.2管理者代表应当负责建立、实施并保持质量管理体系,报告质量管理体系的运行情况和改进需求,提高员工满足法规、规章和顾客要求的意识。
查看是否对上述职责作出明确规定。
查看管理者代表报告质量管理体系运行情况和改进的相关记录。
1.4.1技术、生产、质量管理部门负责人应当熟悉医疗器械法律法规,具有质量管理的实践经验,应当有能力对生产管理和质量管理中实际问题作出正确判断和处理。
节条款内容查看相关部门负责人的任职资格要求,是否对专业知识、工作技能、工作经历作出了规定;查看考核评价记录,现场询问,确定是否符合要求。
附件2医疗器械生产质量管理规范无菌医疗器械现场检查指导原则章节条款内容机构和人员1.1.1应当建立与医疗器械生产相适应的管理机构,具备组织机构图。
查看提供的质量手册,是否包括企业的组织机构图,是否明确各部门的相互关系。
*1.1.2应当明确各部门的职责和权限,明确质量管理职能。
查看企业的质量手册,程序文件或相关文件,是否对各部门的职责权限作出了规定;质量管理部门应当能独立行使职能,查看质量管理部门的文件,是否明确规定对产品质量的相关事宜负有决策的权利。
1.1.3生产管理部门和质量管理部门负责人不得互相兼任。
查看公司的任职文件或授权文件并对照相关生产、检验等履行职责的记录,核实是否与授权一致。
1.2.1企业负责人应当是医疗器械产品质量的主要责任人。
1.2.2企业负责人应当组织制定质量方针和质量目标。
查看质量方针和质量目标的制定程序、批准人员。
1.2.3企业负责人应当确保质量管理体系有效运行所需的人力资源、基础设施和工作环境。
1.2.4企业负责人应当组织实施管理评审,定期对质量管理体系运行情况进行评估,并持续改进。
查看管理评审文件和记录,核实企业负责人是否组织实施管理评审。
*1.2.5企业负责人应当确保企业按照法律、法规和规章的要求组织生产。
1.3.1企业负责人应当确定一名管理者代表。
查看管理者代表的任命文件。
*1.3.2管理者代表应当负责建立、实施并保持质量管理体系,报告质量管理体系的运行情况和改进需求,提高员工满足法规、规章和顾客要求的意识。
查看是否对上述职责作出明确规定。
查看管理者代表报告质量管理体系运行情况和改进的相关记录。
1.4.1技术、生产、质量管理部门负责人应当熟悉医疗器械法律法规,具有质量管理的实践经验,应当有能力对生产管理和质量管理中实际问题作出正确判断和处理。
节条款内容查看相关部门负责人的任职资格要求,是否对专业知识、工作技能、工作经历作出了规定;查看考核评价记录,现场询问,确定是否符合要求。