01水的组成与净化
- 格式:doc
- 大小:412.00 KB
- 文档页数:3
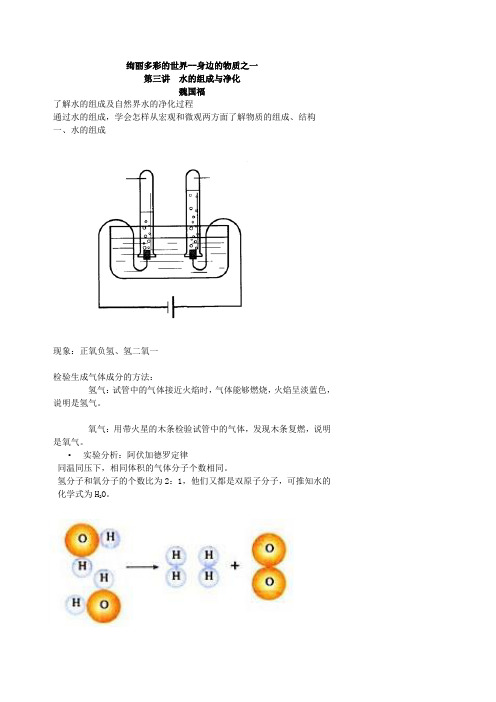
绚丽多彩的世界--身边的物质之一第三讲水的组成与净化魏国福了解水的组成及自然界水的净化过程通过水的组成,学会怎样从宏观和微观两方面了解物质的组成、结构一、水的组成现象:正氧负氢、氢二氧一检验生成气体成分的方法:氢气:试管中的气体接近火焰时,气体能够燃烧,火焰呈淡蓝色,说明是氢气。
氧气:用带火星的木条检验试管中的气体,发现木条复燃,说明是氧气。
•实验分析:阿伏加德罗定律同温同压下,相同体积的气体分子个数相同。
氢分子和氧分子的个数比为2:1,他们又都是双原子分子,可推知水的化学式为H2O。
通电•2H2O → 2H2↑+ O2↑实验结论:(1)水是由氢元素、氧元素组成的。
(2)每一个水分子由两个氢原子和一个氧原子构成。
(3)分子可分解成原子,原子又可构成新的分子。
实验注意的问题:(1)加入稀硫酸和氢氧化钠溶液,增强水的导电性。
(2)电源为直流电。
(3)实验中氧气与氢气的体积比略小于1:2。
氧气在水中的溶解性比氢气稍大,有时还会与电极发生氧化反应。
(4)氢气的检验方法。
(5)电解水是把电能转化为化学能,氢气与氧气反应是将化学能转化为热能和光能。
二、水的净化沉淀→过滤→吸附→蒸馏•吸附:常用明矾、活性炭,明矾溶于水形成胶状物吸附水中悬浮物沉淀到水底,活性炭不但可以吸附水中的悬浮物,还可以吸附溶于水的有异味物质和色素。
•沉淀:水中悬浮物被吸附后形成密度较大的颗粒,从而使杂质沉降。
•过滤:除去水中不溶性的杂质。
•蒸馏:除去可溶性杂质的方法。
如水中可溶性的钙、镁离子,其原理是利用蒸发的方法使水和杂质分离。
三、习题1、下图所示的是电解水实验装置。
通电一段时间后,在两个试管中分别收集到气体a和气体b。
请回答:(1)电解水时,将能转化为化学能;(2)气体a为;(3)实验室检验气体b的方法是。
2、某同学制作了如下图所示的简易电解水装置,进行家庭小实验(注:该装置气密性良好,且反应一段时间后停止通电,A、B管内液面均高于图中D线)。

专题三水的组成及净化重点突破水的组成及净化1.水的组成(1)物理性质:无色、无味、液态,1标准大气压下沸点是100℃,凝固点是0℃。
4℃时密度为1 g/cm3,结冰后密度变小,体积变大。
(2)化学性质:①能电解2H2O2H2↑+O2↑(化学方程式,下同)②与光合作用③与金属氧化物反应CaO+H2O=Ca(OH)2。
④与非金属氧化物反应CO2+H2O=H2CO3。
(3)水的电解(如图):在直流电的作用下,电极上有气泡产生,正极上产生能使带火星的木条复燃的氧气,负极上产生能燃烧的氢气,体积比为1:2 ,质量比为8:1 。
(4)水的电解实验应注意:①水分解成氢气和氧气是分解反应,该反应发生的条件为“通电”,实验中所用电源为直流电。
②为了增强水的导电性,可在水中加适量的稀硫酸或氢氧化钠,产物不变。
③若收集气体较少,当检验试管2中的气体时,可能只发出爆鸣声,而看不到蓝色火焰。
(5)点燃氢气前一定要检验氢气的纯度。
因为当氢气中混有空气时,点燃混合气体就可能发生爆炸,氢气的爆炸极限为4%~74.2%(即空气中混有氢气的体积分数为4%~74.2%)。
(6)验氢气纯度的方法为:用排水法收集一试管氢气,用拇指堵住试管口,移近火焰,移开拇指点火。
如果听到尖锐的爆鸣声,就表明氢气不纯,需要再收集,再检验,直到响声很小,才表明氢气已纯净。
如果用向下排空气法收集氢气,经检验不纯而需要再检验时,应用拇指堵住试管口一会儿,再收集氢气检验纯度,因为试管内氢气火焰可能没有熄灭,使发生器内不纯的氢气燃烧发生爆炸。
( 1 )做该实验时往往向水中加入少量氢氧化钠或硫酸钠,目的是增强水的导电性。
( 2 )两电极上产生的气体可巧记为正氧负氢( 谐音“父亲” ),氢二氧一。
( 3 )实验中正、负极收集到的气体体积比往往小于1∶2,原因可能是氧气在水中的溶解度比氢气大;氧气的化学性质活泼,与电极发生了氧化反应。
(7)水的合成:纯净的H2在空气中燃烧,产生淡蓝色火焰。


课题2.水的净化知识要点除去可溶性杂质,细菌沉降杂质一、净化水的常用方法(一)沉淀1.静置沉淀:把河水引入沉淀池,静置一段时间后,底部有沉淀,上面的水变得相对澄清。
但有一些悬浮物存在。
2.吸附沉淀法:向水中加入某些净水剂如明矾,利用明矾溶于水后生成的胶状物对杂质进行吸附,使杂质沉降来达到净水的目的。
(二)过滤(活动与探究)1、取水(取3杯天然水:湖水、河水、井水)2、加明矾吸附(搅拌溶解后,静置,观察现象)3、过滤(过滤器的制作,过滤的操作方法)注意:1. 滤纸一定要和漏斗贴紧,不能留有气泡(为什么?)若有气泡,过滤的速度会比较慢2. 滤纸的边缘低于漏斗的边缘(为什么?)防止液体从漏斗边流出3. 过滤后的水是纯水吗?4. 过滤操作主要去除水中的什么杂质?去除不溶性的杂质【小结】去除不溶性杂质的方法:沉淀、过滤。
【问题】过滤后,滤液仍然浑浊可能的原因有那些?(1)滤纸破损;(2)滤液边缘高于滤纸边缘;(3)仪器不干净等。
此时,滤液浑浊应再过滤一次,直到澄清为止。
问:过滤后的水比较澄清但发红。
如何去掉颜色呢?杂质,除去臭味。
充分地吸收气味进水的目的是什么?二、硬水的软化以及检验的方法1. 硬水:含有较多可溶性钙、镁化合物的水。
软水:不含或含较少可溶性钙、镁化合物的水2..硬水和软水的检验方法:肥皂水硬水——易起浮渣(泡沫少、浮渣多)软水——有较多泡沫(泡沫多、浮渣少)3.硬水的危害⑴浪费燃料,易出事故。
⑵长期饮用硬水,易患结石。
⑶浪费洗涤剂,洗不净且衣物变硬。
⑷长期灌溉使用,溶解性盐类会在土壤中沉积,导致土壤盐碱化程度加重。
4.硬水的软化:生活中:煮沸。
实验室:蒸馏蒸馏作用:可使硬水中的钙、镁留在容器内,降低水的硬度,去除不可溶物质和微生物。
问:蒸馏瓶中为什么要加几粒沸石或碎瓷片?(防止加热时,出现液体暴沸1、 自然界的水都不是纯水,通过多种途径可以使水得到不同程度的净化。
2、硬水易生水垢、与肥皂作用不易起泡沫;硬水可以软化为软水。

沪教版(全国)(2024)化学九年级上册《水的组成和净化》教案及反思一、教材分析:《水的组成和净化》是沪教版九年级上册化学教材中的重要内容。
本节课将从水的组成探究入手,引导学生认识水的微观构成,进而探讨水的净化方法。
这部分内容不仅是对前面所学化学知识的综合应用,也为后续学习溶液、酸碱盐等知识奠定基础。
通过本节课的学习,学生将进一步理解化学学科研究物质的方法和思路,提高实验探究能力和科学思维能力。
二、教学目标:【知识与技能】:1.了解水的组成,通过电解水实验认识水的微观构成。
2.知道水的净化方法,如沉淀、过滤、吸附、蒸馏等。
3.初步学会过滤操作。
【过程与方法】:1.通过电解水实验,培养学生的观察能力和分析问题的能力。
2.通过对水净化方法的讨论和实验操作,培养学生的实验设计和动手能力。
【情感态度与价值观】:1.感受化学与生活的密切联系,增强节约用水和保护水资源的意识。
2.培养学生实事求是的科学态度和勇于探索的精神。
三、教学重难点:【教学重点】:1.电解水实验及水的组成。
2.水的净化方法及过滤操作。
【教学难点】:1.从微观角度理解水的组成和电解水的化学变化。
2.过滤操作的要点和注意事项。
四、学情分析:九年级学生在之前的学习中已经对物质的性质有了一定的了解,并且具备了基本的实验操作技能。
但对于从微观角度认识物质的组成和变化,以及较为复杂的实验操作,还需要进一步的引导和训练。
此外,学生在生活中对水的净化有一定的感性认识,但对于净化的原理和方法缺乏系统的理解。
五、教法和学法:【教法】:1.讲授法:讲解水的组成和净化的相关知识。
2.实验法:通过电解水实验和过滤实验,让学生直观感受化学变化和实验操作。
3.讨论法:组织学生讨论水的净化方法和水资源保护,培养学生的思维能力和合作精神。
【学法】:1.自主学习:通过阅读教材和查阅资料,了解水的组成和净化的基本知识。
2.实验探究:积极参与实验操作,观察实验现象,分析实验结果,提高实践能力。

水的组成与净化(提高)【学习目标】1.掌握水的电解实验和水的组成;掌握过滤、吸附、蒸馏等净化操作和原理。
2.掌握单质和化合物的概念和区别;学会检验氢气纯度的方法。
3.知道硬水与软水的区别,了解硬水的危害及硬水的软化方法;了解防止水污染的方法。
【要点梳理】要点一、水的电解实验1.实验装置:(高清课堂《水的组成与净化》一)2.实验现象:(1)电极上均有气泡产生;(2) a、b两试管中气体体积比约为2:1。
3.气体验证:(1)a中气体点燃火焰呈蓝色(若气体量少,可能有爆鸣声),证明是氢气;(2)b中气体能使带火星的木条复燃,证明是氧气。
4.实验结论:水在直流电的作用下,发生了分解反应,生成了氢气和氧气。
水氢气+氧气H2O H2 O2从上面的实验和发生的化学反应可以说明,水是由氢元素和氧元素组成的。
【要点诠释】1.电解水时电极上出现的气体可巧记为“正氧负氢、氢二氧一”。
2.理论上水分解产生氢气和氧气的体积比为2:1,但由于氧气比氢气在水中溶解的量多,所以实验中氢气与氧气的体积比往往大于2:1。
要点二、氢气1.物理性质:氢气是一种无色、无味的气体,难溶于水,密度比空气的小(最轻的气体)。
2.化学性质:纯净的氢气在空气中安静地燃烧,产生淡蓝色火焰,放出大量热,生成水。
氢气+氧气水H2O2 H2O3.检验氢气的纯度:(1)验纯的原因:如果氢气不纯,当空气里混入氢气的体积达到总体积的4.0%-74.2%时,点燃就会发生爆炸,这个范围叫做氢气的爆炸极限。
所以点燃氢气前一定要检验氢气的纯度。
(2)验纯的方法:如图所示,收集一小试管氢气,用拇指堵住试管口,使试管口稍向下倾斜,接近酒精灯火焰,再移开拇指点火。
若听到尖锐的爆鸣声,则表明氢气不纯,需要再收集检验。
若声音很小或听到轻微的“噗”声,说明氢气已纯净。
【要点诠释】1.经检验不纯需要用排空气法再重新收集时,要用拇指按住试管口一会,否则试管内的氢气火焰可能还未熄灭,有可能使气体发生器内不纯的氢气燃烧发生爆炸。
水的净化和水的组成主备魏宝瑛审核范治军教学目标1、了解吸附、沉淀、过滤和蒸馏等净水的方法。
2、了解自来水的净化过程,初步学会过滤操作。
3、了解硬水与软水,学会常用的检验硬水与软水的方法及生活中把硬水软化的方法。
4、通过电解水实验,认识水是由氢、氧两种元素组成;进一步了解化学反应的基本特征。
教学过程一、基础知识梳理(一)水的净化(1)水的净化效果由低到高的是静置沉淀、吸附沉淀(加絮凝剂—明矾)、过滤、吸附(加活性碳吸附异味和色素)蒸馏(均为物理方法),其中净化效果最好的操作是蒸馏;既有过滤作用又有吸附作用的净水剂是活性炭。
(2)硬水与软水A.定义硬水是含有较多可溶性钙、镁化合物的水;软水是不含或含少量可溶性钙、镁化合物的水。
B.鉴别方法:用肥皂水,有浮渣产生或泡沫较少的是硬水,泡沫较多的是软水C.硬水软化的方法:蒸馏、煮沸(二)水的组成:(1)电解水的实验A.装置―――水电解器B.电源种类---直流电C.----------增强水的导电性D.↑+ O2↑产生位置负极正极(可记忆为“负氢正氧”)体积比 2 :1质量比 1 :8F.检验:O2---出气口置一根带火星的木条----木条复燃H2---出气口置一根燃着的木条------气体燃烧,产生淡蓝色的火焰(2)结论:①水是由氢、氧元素组成的。
②一个水分子是由2个氢原子和1个氧原子构成的。
③化学变化中,分子可分而原子不可分。
二、课堂训练1、(中考备考方案)第13页第1、2、3、4题三、过关检测1、教师个别抽查2、小组内互相检测、小组长检查过关。
鲁教版初三化学上《水的组成与净化》知识梳理+例题演练【学习目的】1.了解水污染的种类及防治水污染的方法。
2.掌握过滤、吸附、蒸馏等污染操作和原理。
3.知道硬水与软水的区别,了解硬水的危害及硬水的硬化方法。
4.掌握水的电解实验和水的组成。
【要点梳理】要点一、保护水资源1.水污染的来源:〔1〕工业消费中〝三废〞〔废水、废渣、废气〕的恣意排放;〔2〕生活污水的恣意排放;〔3〕石油、重金属离子对水体的污染;〔4〕农业消费中农药、化肥的不合理施用。
2.水体污染的危害:〔1〕工业废水及农药等含有毒物质影响人类和水生植物生长,危害人类安康。
〔2〕含磷洗濯剂、化肥及生活污水含有少量植物营养物质,少量排放,惹起水的富营养化。
3.防止水污染的主要措施:〔1〕提高环保看法,增强水质的监测。
〔2〕工业〝三废〞要停止综合应用和经处置后再排放。
〔3〕农业上倡议运用农家肥,合理运用化肥和农药。
【要点诠释】地球下水的储量是丰厚的,但海水资源充足且散布不平均。
再加上近年来水污染现象的减轻,所以我们必需保护水资源,一方面要浪费用水,另一方面要防止水体污染。
要点二、过滤和蒸馏1.过滤:把不溶性的固体与液体分开的一种方法叫过滤。
〔1〕过滤器的预备〔如图甲〕:取一张圆形滤纸,对折两次,然后翻开,使滤纸成为圆锥形〔一边是一层滤纸,另一边是三层滤纸〕,放入漏斗内,使之紧帖漏斗壁,用大批水润湿滤纸使滤纸和漏斗壁之间不要留有气泡。
甲乙〔2〕装置过滤器〔如图乙〕:使漏斗的下端管口紧靠烧杯内壁。
〔3〕过滤操作:将混浊的液体混合平均后,沿玻璃棒渐渐倒入漏斗内停止过滤。
2.蒸馏:给液体加热,使它变为蒸气,再使蒸气冷却,冷凝成液体,这种方法叫蒸馏。
蒸馏可以把沸点不同的物质从混合物中分别出来,也可以把挥发性液体与溶解在液体中的不挥发性杂质分分开来,到达分别和提纯的目的。
蒸馏水就是用蒸馏的方法失掉的。
蒸馏装置如下图:【要点诠释】过滤的操作要点是〝一贴,二低,三靠〞:一贴:制造过滤器时,滤纸要紧贴漏斗内壁〔中间不要留有气泡,否那么会影响过滤速度〕。
绚丽多彩的世界--身边的物质之一
第三讲水的组成与净化
魏国福
了解水的组成及自然界水的净化过程
通过水的组成,学会怎样从宏观和微观两方面了解物质的组成、结构
一、水的组成
现象:正氧负氢、氢二氧一
检验生成气体成分的方法:
氢气:试管中的气体接近火焰时,气体能够燃烧,火焰呈淡蓝色,说明是氢气。
氧气:用带火星的木条检验试管中的气体,发现木条复燃,说明是氧气。
•实验分析:阿伏加德罗定律
同温同压下,相同体积的气体分子个数相同。
氢分子和氧分子的个数比为2:1,他们又都是双原子分子,可推知水的化学式为H2O。
通电
•2H2O → 2H2↑+ O2↑
实验结论:
(1)水是由氢元素、氧元素组成的。
(2)每一个水分子由两个氢原子和一个氧原子构成。
(3)分子可分解成原子,原子又可构成新的分子。
实验注意的问题:
(1)加入稀硫酸和氢氧化钠溶液,增强水的导电性。
(2)电源为直流电。
(3)实验中氧气与氢气的体积比略小于1:2。
氧气在水中的溶解性比氢气稍大,有时还会与电极发生氧化反应。
(4)氢气的检验方法。
(5)电解水是把电能转化为化学能,氢气与氧气反应是将化学能
转化为热能和光能。
二、水的净化
沉淀→过滤→吸附→蒸馏
•吸附:常用明矾、活性炭,明矾溶于水形成胶状物吸附水中悬浮物沉淀到水底,活性炭不但可以吸附水中的悬浮物,还可以吸附
溶于水的有异味物质和色素。
•沉淀:水中悬浮物被吸附后形成密度较大的颗粒,从而使杂质沉降。
•过滤:除去水中不溶性的杂质。
•蒸馏:除去可溶性杂质的方法。
如水中可溶性的钙、镁离子,其原理是利用蒸发的方法使水和杂质分离。
三、习题
1、下图所示的是电解水实验装置。
通电一段时间后,在两个试管中分别收集到气体a和气体b。
请回答:
(1)电解水时,将能转化为化学能;
(2)气体a为;
(3)实验室检验气体b的方法是。
2、某同学制作了如下图所示的简易电解水装置,进行家庭小实验(注:该装置气密性良好,且反应一段时间后停止通电,A、B管内液面均高于图中D线)。
请根据要求回答问题:
(1)闭合开关后观察到:
①A、B管内的现象是______。
②C管中的现象是_______,产生此现象的原因是______。
(2)A、B管内生成的气体聚集在上部的原因是______。
(3)若检验A管内生成的气体应该用______。