烃的燃烧规律
- 格式:doc
- 大小:74.50 KB
- 文档页数:9

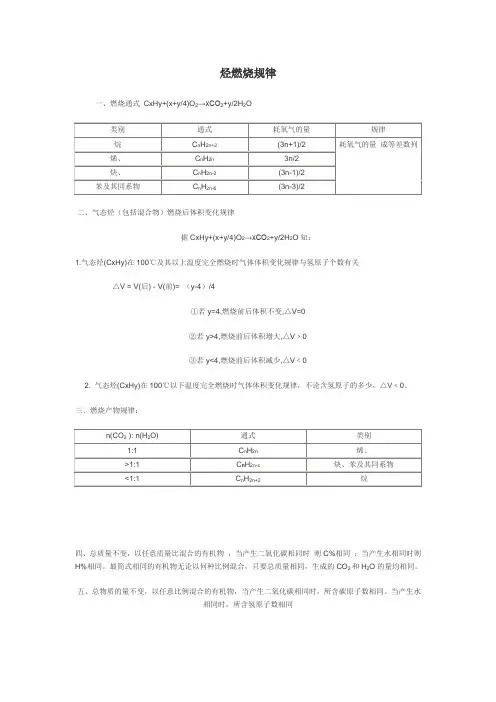
烃燃烧规律一、燃烧通式CxHy+(x+y/4)O2→xCO2+y/2H2O二、气态烃(包括混合物)燃烧后体积变化规律据CxHy+(x+y/4)O2→xCO2+y/2H2O知:1.气态烃(CxHy)在100℃及其以上温度完全燃烧时气体体积变化规律与氢原子个数有关△V = V(后) - V(前)= (y-4)/4①若y=4,燃烧前后体积不变,△V=0②若y>4,燃烧前后体积增大,△V﹥0③若y<4,燃烧前后体积减少,△V﹤02. 气态烃(CxHy)在100℃以下温度完全燃烧时气体体积变化规律,不论含氢原子的多少,△V﹤0。
三、燃烧产物规律:四、总质量不变,以任意质量比混合的有机物,当产生二氧化碳相同时则C%相同;当产生水相同时则H%相同。
最简式相同的有机物无论以何种比例混合,只要总质量相同,生成的CO2和H2O的量均相同。
五、总物质的量不变,以任意比例混合的有机物,当产生二氧化碳相同时,所含碳原子数相同。
当产生水相同时,所含氢原子数相同六、消耗氧气的量的规律1.等物质的量的烃完全燃烧时,其耗氧量的大小取决于(x+y/4)。
2.等质量的烃完全燃烧,其耗氧量的大小取决该烃分子中氢的质量分数,其值越大,耗氧量越大。
设烃的质量为m ,含氢的质量分数为ω,有关系式C~O2~CO2及4H~O2~2H2O可知该厅的耗氧量为:n(O2) = m(1-ω)/12 + mω/4= m/12 +mω/6当m 为定值时,ω值越大,耗氧量就越大。
①对于等质量的烷烃,碳原子数越多,氢的质量分数越小,耗氧量越小,由此可知CH4的耗氧量最多。
②对于等质量的单烯烃,因炭、氧的个数比为定值,股氢的质量分数也为定值,即耗氧量相等。
③对于等质量的炔烃,碳原子数越多,氢的质量分数越大,耗氧量越多,由此可知C2H2的耗氧量最少。
④等质量烷烃、单烯烃、炔烃,因为氢的质量分数关系导致耗氧量的关系如下:“烷烃﹥烯烃﹥炔烃”。

烃的燃烧规律总结烃的燃烧就是很简单的,但它的计算现象丰富多彩,从而成为考查学生综合应用能力的一个不可多得的知识点。
一、烃的燃烧化学方程式不论就是烷烃、烯烃、炔烃还就是苯及苯的同系物,它们组成均可用C x H y 来表示,这样当它在氧气或空气中完全燃烧时,其方程式可表示如下:二、烃燃烧时物质的量的变化烃完全燃烧前后,各物质的总物质的量变化值与上述燃烧方程式中的化学计量数变化值一致,即。
也就就是说,燃烧前后物质的量变化值仅与烃分子中的氢原子数有关,而与碳原子数无关。
且:当y>4时,,即物质的量增加;当y= 4时,,即物质的量不变;当y<4时,,即物质的量减少。
三、气态烃燃烧的体积变化要考虑燃烧时的体积变化,必须确定烃以及所生成的水的聚集状态。
因此,当气态烃在通常压强下燃烧时,就有了两种不同温度状况下的体积变化:1、在时,。
说明,任何烃在以下燃烧时,其体积都就是减小的;2、在时,。
当y>4时,,即体积增大;当y=4时,,即体积不变;当y<4时,,即体积减小。
四、烃燃烧时耗氧量(nO2)、生成二氧化碳量(nCO2)、生成水量(nH2O)的比较在比较各类烃燃烧时消耗或生成的量时,常采用两种量的单位来分别进行比较:1、物质的量相同的烃C x H y,燃烧时也就就是说:(1)相同条件下等物质的量的烃完全燃烧时,(x+y/4)值越大,消耗O2越多;x值越大,生成的CO2越多;y值越大,生成的水越多。
(2)1mol有机物每增加一个CH2,消耗O2量增加为:(1+2/4)=1、5mol2、质量相同的烃C x H y转换成yCHx,燃烧时也就就是说:(1)质量相同的含氢质量分数(y/x)大的烃,燃烧时耗氧量大,生成水量大,生成二氧化碳量小。
(2)最简式相同的烃,不论以何种比例混合,只要混合物的总质量一定,完全燃烧后的耗氧量、生成二氧化碳量、生成水的量也一定。
五、混合烃燃烧时的加与性尽管烃的混合物燃烧时,具有单一烃各自的燃烧特征,但它们具有加与性。

有关烃燃烧的规律一、烷烯炔各类烃含碳(或氢)质量分数的变化规律:1.烷烃:C n H2n+2(n≥1)W(C)=12n/(14n+2)×100% 随n的增大,烷烃W(C)逐渐增大,但永远小于85.7%。
甲烷是烷烃中W(H)最高的。
2.烯烃(或环烷烃):C n H2n(n≥2)W(C)=12n/14n×100%=85.7%即烯烃的W(C)是固定不变的。
3.炔烃(或二烯烃):C n H2n-2(n≥2)W(C)=12n/(14n-2)×100% 随n的增大,炔烃W(C)逐渐减小,但总比烯烃的W(C)高,即总大于85.7%。
乙炔是炔烃中含碳量最高的。
二、烃的燃烧规律:烃的可燃性是烃的一个基本性质,有关烃的燃烧计算和比较是中学化学中常见的习题,掌握烃的燃烧规律,对解决这类习题会起到事半功倍的效果。
烃类燃烧可用通式表示:CxHy + (x+y/4)O2 →xCO2 + y/2H2O1..等物质的量的不同烃燃烧时的耗氧规律:(1)耗O2量取决于(x+y/4),(x+y/4)越大,消耗氧气越多。
(2)产生CO2的量取决于x,x越大,产生CO2的量越多。
(3)产生H2O的量取决于y,y越大,产生H2O的量越多。
例1:等物质的量的CH4、C2H4、C2H2,分别在足量氧气中完全燃烧,以下说法正确的是()A.C2H2含碳量最高,燃烧生成的CO2最多B.C2H2燃烧时火焰最明亮C.CH4含氢量最高,燃烧生成的水最多D.CH4、C2H4燃烧生成的水质量不同,消耗的氧气不同。
例2:1molCxHy(烃)完全燃烧需要5molO2,则X与Y之和可能是( )A.X+Y=5 B.X+Y=7 C.X+Y=11 D.X+Y=92.等质量的不同烃完全燃烧时的耗氧规律:1molC(12g)消耗1mol O2,而4molH(4g)也消耗1molO2,故质量相等的不同烃完全燃烧时,氢元素的质量分数H%越大,消耗O2越多,产生的H2O越多;反之碳元素的质量分数C%越大,消耗O2越少,产生的CO2则越多。






烃的燃烧规律
烃是一类碳氢化合物,常见的有甲烷、乙烷、丙烷等。
燃烧是烃常见的化学反应之一,也是我们日常生活中经常遇到的现象。
烃的燃烧规律是非常重要的,对我们了解燃烧过程有着重要的指导意义。
首先,烃的燃烧需要氧气的参与,也就是说,烃在空气中才能进行燃烧。
一般情况下,烃与氧气在一定温度下发生反应,产生二氧化碳和水。
例如,甲烷(CH4)与氧气(O2)反应生成二氧化碳(CO2)和水(H2O)。
其次,烃的燃烧是一个放热反应,也就是说,在燃烧过程中会释放出大量的热能。
这是因为烃分子中碳和氢的键能被氧气的氧原子断裂,形成新的碳氧键和氢氧键,释放出能量。
这也是为什么火焰能够发出明亮的光和强烈的热量。
此外,烃的燃烧还可以根据所需的条件进行控制。
例如,燃烧需要一定的温度和点火源。
在点火源引燃下,烃分子开始裂解,碳和氢逐渐与氧结合,产生大量的热量。
而烃的燃烧速度也与温度、压力、燃料浓度和氧气浓度等因素有关。
总结起来,烃的燃烧规律是需要氧气参与的放热反应。
燃烧过程中,氧气与烃分子中的碳和氢发生反应,形成二氧化碳和水,同时释放出大量的热能。
燃烧的速度受到多种因素的影响,需要适当的温度和点火源。
对于我们来说,了解烃的燃烧规律可以帮助我们安全使用和储存燃料,同时也有助于环境保护,减少有害气体的排放。
因此,在日常生活中要注意合理使用烃类燃料,确保燃烧的环境和条件安全合理。
同时,研究燃烧规律也有助于改善燃烧过程,提高燃烧效率,减少能源浪费和污染物的排放。
对于环境保护和节能减排而言,烃的燃烧规律掌握得越全面,我们就能更好地应对能源挑战。

烃的燃烧规律总结一、烃的燃烧化学方程式不管是烷烃、烯烃、炔烃还是苯及苯的同系物,它们组成均可用来表示,这样当它在氧气或空气中完全燃烧时,其方程式可表示如下:二、烃燃烧时物质的量的变化烃完全燃烧前后,各物质的总物质的量变化值与上述燃烧方程式中的化学计量数变化值一致,即。
也就是说,燃烧前后物质的量变化值仅与烃分子中的氢原子数有关,而与碳原子数无关。
且:当y>4时,,即物质的量增加;当y=4时,,即物质的量不变;当y<4时,,即物质的量减少。
三、气态烃燃烧的体积变化要考虑燃烧时的体积变化,必须确定烃以及所生成的水的聚集状态。
因此,当气态烃在通常压强下燃烧时,就有了两种不同温度状况下的体积变化:1. 在时,。
说明,任何烃在以下燃烧时,其体积都是减小的;2. 在时,。
当y>4时,,即体积增大;当y=4时,,即体积不变;当y<4时,,即体积减小。
四、烃燃烧时耗氧量〔〕、生成二氧化碳量〔〕、生成水量〔〕的比拟在比拟各类烃燃烧时消耗或生成的量时,常采用两种量的单位来分别进行比拟:1. 物质的量相同的烃,燃烧时2. 质量相同的烃,燃烧时也就是说:〔1〕质量相同的含氢质量分数大的烃,燃烧时耗氧量大、生成二氧化碳量小、生成水量大。
〔2〕最简式相同的烃,不管以何种比例混合,只要混合物的总质量一定,完全燃烧后的耗氧量、生成二氧化碳量、生成水的量也一定。
五、混合烃燃烧时的加和性尽管烃的混合物燃烧时,具有单一烃各自的燃烧特征,但它们具有加和性。
因此,可以将看作为混合烃的“平均分子式〞。
这样就找到了将“混合烃〞转换成“单一烃〞的支点,从而根据“一大一小法〞或“十字交叉法〞就很容易求解出混合物中具有哪些组份以及这些组份的物质的量分数。
六、典型例题1. 常温常压下,取物质的量相同的以下四种气态烃,分别在氧气中完全燃烧,消耗氧气最多的是( )2. 等质量的以下烃完全燃烧时,消耗氧气最多的是( )3.两种气态烃以一定比例混合,在105℃时,1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体的体积为11L,以下各组混合烃中不符合此条件的是〔〕A.C3H6 C4H10 B.CH4 C3H8 C.C2H4 C4H10 D.C3H8 C4H84 L H2O,那么混合气体中〔〕A.一定有甲烷 B.一定有乙烷C.一定无甲烷D.一定有丙烷5. 时,2 L常见烃A的蒸气能在b L氧气中完全燃烧,反响后体积增至(b+4) L〔体积在同前的条件下测定〕。
烃燃烧的几条规律烃的燃烧通式是:CxHy +(X+y/4 )O2 →xCO2 + y/2 H2O(1)当温度高于100℃,生成物全部是气体,气体体积变化量为:△V=V前-V后=1- 分三种情况:①当y=4时,△V=0,体积不变。
②当y<4时,△V>0,体积减小。
③当y>4时,△V<0,体积增大。
通常把△V=0的情况称为氢4规律,即分子中含有4个氢原子的烃分子在温度高于100℃时完全燃烧,反应前后气体体积不变,如CH4、C2H4、C3H4等,与碳原子数无关。
反过来也可以根据燃烧前后体积不变来判断烃的分子组成。
(2)当室温(或者低于100℃)时烃完全燃烧,由于水是液体,体积计算时水的体积被忽略,则△V=1+,此时,△V均大于0,即体积不会不变,也不会增加,只能减小。
一、烃完全燃烧耗氧量的比较1、等物质的量的烃燃烧耗氧量的计算对于1molCxHy ,消耗氧气物质的量为(x+y/4 )mol,显然(x+ y/4)值越大,耗氧量越多。
[练习]取下列四种气态烃各1mol,分别在足量的氧气中燃烧,消耗氧气最多的是(D )A CH4B C2H6C C3H8D C4H102、等质量的烃燃烧耗氧量的计算由于等质量的C和H相比,H的耗氧量比C多。
例如12克C要消耗32克O2,而12克H要消耗96克O2。
因此等质量的不同烃完全燃烧,烃中H的质量分数越大,耗氧量越多。
等质量的烃完全燃烧时,耗氧量的多少决定于氢的质量分数,即y/x的值,y/x越大,耗氧量越多[练习]等质量的下列烃完全燃烧时,消耗氧气最多的是(A )A CH4B C2H6C C3H8D C6H6二、烃燃烧时生成的CO2和H2O的量的比较1、等物质的量的烃燃烧生成CO2和H2O的量的比较对烃CxHy来说,x越大,生成CO2越多,y越大,生成H2O越多。
2、等质量的烃燃烧生成CO2和H2O的量的比较等质量的两种烃,如果C的质量分数越大,则生成CO2的质量越多,生成H20的质量越少。
烃的燃烧规律及应用烃是一类由碳和氢元素组成的有机化合物,常见的烃包括烷烃、烯烃和炔烃。
烃具有较高的能量含量和燃烧性能,因此广泛应用于能源、化工和燃料等领域。
下面将从燃烧规律和应用两个方面来详细介绍烃的特点和用途。
燃烧规律:烃的燃烧是指烃与氧气发生氧化反应,产生二氧化碳和水。
燃烧的化学方程式如下:CnHm + (n+m/4)O2 →nCO2 + m/2H2O根据这个方程式,可以得出烃的燃烧规律:1. 反应物:烃燃烧的反应物主要是烃和氧气。
烃是能够提供燃料的有机物,而氧气是燃烧所需的氧化剂。
当烃和氧气充分接触时,燃烧反应会自发进行。
2. 产物:烃的燃烧主要产生二氧化碳和水。
二氧化碳是一种常见的废气,在空气中存在会造成温室效应。
水是燃烧过程中产生的水蒸气。
产物的生成主要取决于烃和氧气的化学反应。
3. 反应条件:烃的燃烧需要一定的温度和氧气浓度来提供充分的反应条件。
当温度较高、氧气浓度足够时,燃烧反应速率较快,燃烧产热较多。
应用:烃的燃烧具有高能量含量和方便燃烧等特点,因此被广泛用于以下领域:1. 能源:烃是重要的化石燃料,如石油和天然气主要由烃组成。
燃烧烃类化合物可以产生大量的热能,用于发电、供暖和工业生产等,是主要的能源来源之一。
2. 燃料:烃可用作汽车、飞机和船舶等交通工具的燃料。
烷烃类化合物如汽油、柴油和天然气都可以作为燃料使用,为交通工具提供动力。
3. 化工:烃可作为化学工业的原料和中间体。
通过烃类化合物可以合成各种有机化学品,如塑料、纤维、润滑油和溶剂等。
烃也可以用于制备合成氨、甲醇和乙醇等重要化学品。
4. 生活用品:烃也被用于生活用品的制备。
例如,烷烃类化合物可以提炼成石蜡,用于制作蜡烛、抛光剂和防水剂等。
而烷烃类烃燃烧产生的火焰可以用于灶具、热水器等家庭用具。
总结起来,烃的燃烧规律和应用主要体现在烃与氧气发生氧化反应,产生二氧化碳和水。
烃的高能量含量和方便燃烧性质使其在能源、化工和燃料等领域有着广泛的应用。
烃的燃烧规律总结王新平(衡水第十三中学 河北衡水 053000)【规律总结】(1) 等物质的量的烃C x H y 完全燃烧时,消耗氧气的量决定于(x +4y )的值,此值越大,耗氧量越多。
(2) 等质量的烃完全燃烧时,消耗氧气的量决定于C x H y 中xy 的值,此值越大,耗氧量越多。
(3) 等质量的且最简式相同的烃完全燃烧时,其耗氧量、生成的二氧化碳和水的量均相等。
(4) 若烃分子组成中N(C):N(H)=1:2 ,则完全燃烧后生成的二氧化碳和水的物质的量相等。
(5) 气态烃C x H y 完全燃烧后生成CO 2和H 2O 。
C x H y +(x + 4y )O 2 + 2y H 2O当H 2O 为液态时(t<100℃),气态烃燃烧前后气体总体积的变化:△V= 1 + 4y 当H 2O 为气态时(t>100℃),气态烃燃烧前后气体总体积[V(气)]的变化有以下三种情况:当y=4 时 △V = 0 反应后气体总体积不变当y>4 时 △V =4y - 1 反应后气体总体积增大当y<4 时 △V = 1- 4y 反应后气体总体积减小常温产压下呈气态地烃中,只有甲烷、乙烯、丙炔反应前后气体总体积(t>100℃时)不变。
【例题赏析】【例1】 在同温同压下,10L 某气态烃在50L 氧气里充分燃烧,得到液态水和体积为35L 的混合气体,则该烃的分子式可能为多少。
解析:设该烃的分子式为C x H y 。
则:C x H y +(x + 4y )O 22 +2y H 2O △V 1L (1+4y )L 10L (10+50-35)L1:( 1+4y )= 10 :25 解得: y=6故该烃可能为:C 2H 6 、C 3H 6 、C 4H 6【例2】 一定量的CH 4恰好与一定量的O 2完全反应得到CO 2、CO 和H 2O(g),产物的总质量为41.6g ,将其通过足量的浓H 2SO 4后,洗气瓶增中21.6g ,则此甲烷完全燃烧还需O 2的体积(标准状况下)为 ( )A. 8.96LB. 6.72LC. 4.48LD. 2.24L解析:由浓硫酸吸收水增重25.2 g ,可知CO 2和CO 的质量和是41.6g-21.6g=20g 。
烃类燃烧规律11.261、等物质的量的不同烃燃烧时的耗氧规律:(1)耗O2量取决于(x+y/4),(x+y/4)越大,消耗氧气越多。
(2)产生CO2的量取决于x,x越大,产生CO2的量越多。
(3)产生H2O的量取决于y,y越大,产生H2O的量越多。
【例1】若1mol某气态烃完全燃烧,需要3mol O2,则()A.x=2,y=2 B.x=2,y=4 C.x=3,y=6 D.x=3,y=8【例2】等物质的量的下列烃完全燃烧时,耗氧量最大的是()A.CH4 B.C2H4 C.C2H2 D.C3H42.等质量的不同烃完全燃烧时的耗氧规律:氢元素的质量分数H%越大,消耗O2越多,产生的H2O越多;反之碳元素的质量分数C%越大,消耗O2越少,产生的CO2则越多。
或者说等质量的烃完全燃烧时,消耗氧气的量取决于CxH中y/x的值,此值越大,耗氧量越多。
【例3】下列各组烃只要总物质的量一定,不论以任何比例混合,完全燃烧时耗氧量相同的是()A.CH4、C2H6 B.C2H4、C3H6 C.C2H2、C6H6 D.C5H10、C6H6【例4】等质量的下列烷烃,完全燃烧消耗氧气最多的是()A.CH4 B.C2H6 C.C3H8 D.C6H14【例5】完全燃烧质量相同的:①甲烷②丙烷③乙烯④乙炔⑤苯⑥间二甲苯时,耗氧量由多到少的顺序是:【例6】等质量的下列烃,完全燃烧生成CO2最多的是()A.CH4 B.C2H4 C.C2H2 D.C6H6【例7】下列各组物质,只要总质量一定,无论以何种比例混合,完全燃耗生成的水的质量也总是为定值的是()A.甲烷和乙烯 B.甲苯和邻二甲苯 C.乙烷和乙炔 D.丙烯和2-丁烯【例8】下列各组物质中,只要总质量一定,不论以何种比例混和,完全燃烧生成二氧化碳和水的质量也总是定值的是 ( )A.丙烷和丙烯 B.乙烯和环丙烷 C.苯和乙炔 D.甲烷和乙烷3、总物质的量一定的混合烃的燃烧;只要各组分每mol物质耗O2量相同,则完全燃烧时,其耗氧量为定值。
只要碳原子数相等则产生的CO2的量为定值;只要氢原子数相等则产生的H2O的量为定值.4、总质量一定的混合烃的燃烧;含氢质量分数相等,完全燃烧生成水的量保持不变;含碳质量分数相等,完全燃烧生成的二氧化碳的量保持不变。
5、最简式相同的烃(或有机物),无论以何种比例混合,只要混合物总质量一定,完全燃烧耗氧量为定值,产生的CO2和H2O的量总是一个定值。
【例9】下列各组物质中,只要总质量一定,不论以何种比例混和,完全燃烧生成二氧化碳和水的质量也总是定值的是()A.丙烷和丙稀 B.乙烯和环丙烷 C.乙烯和丁烯 D.甲烷和乙烷6、烃完全燃烧前后气体体积变化规律(1)燃烧后温度高于100℃,即水为气态:y=4时,ΔV=0,体积不变y>4时,ΔV>0,体积增大y<4时,ΔV<0,体积增大(y<4的烃只有C2H2)(2)燃烧后温度低于100℃,即水为液态:,总体积一定减小【例10】在一密闭容器中充入一种气态烃和足量的氧气,用电火花点燃完全燃烧后,容器中的气体体积保持不变,若气体均在120℃和相同压强下测定,这种烃可能是()A.CH4 B.C2H6 C.C2H4 D.C3H6【例11】常温常压下10 mL气态烃与50 mL O2(过量)混合并点燃,恢复到原来的状态时剩余35 mL气体,则此烃不可能是()A.C2H6 B.C3H6 C.C3H8 D.C4H6【练习1】分子式为CH4、C2H4、C2H2、C6H6、C5H10的烃。
(1)物质的量相同时,耗氧量最多的是(),生成CO2 最多的,()生成H2O最多的是()。
(2)质量相同时,耗氧量最多的是(),生成CO2 最多的是(),生成H2O最多的是()。
(3)与同质量丙烯生成CO2 的量一定相等的是(),比丙烯生成CO2多的是(),比丙烯生成CO2少的是()。
(4)在足量O2中燃烧,恢复到原状况(120℃)混合气体总体积大于原混合气体的是(),混合气体总体积等于原混合气体的( ),混合气体总体积小于原混合气体的是( )。
7、巧解含烃的混合气体计算题1、守恒法:此法在化学计算中应用很广泛,用此法可求元素的相对原子质量、物质的相对分子质量、分子式、混合物的组成以及进行溶解度、溶液浓度等方面的计算。
例1:把mmol C2H4和nmol H2混合于密闭容器中,在适当的条件下,反应达到平衡时生成pmol C2H6,若将所得平衡混合气体完全燃烧生成二氧化碳和水,则需要氧气多少摩尔?(3m+n/2)mol解析:若按化学平衡问题先求出平衡时混合气体各组分的物质的量以及它们分别燃烧各需要氧气多少摩尔,再求氧气总物质的量,则太繁琐。
C2H4和H2在整个加成反应过程中C、H原子个数都不变,因而平衡时混合气体燃烧的耗氧量等于反应前C2H4和H2燃烧的耗氧量。
练习1:一定量的甲烷CH4燃烧后得到的产物是一氧化碳、二氧化碳和水蒸气,此混合气的质量为49.6g,当其缓缓通过足量的无水氯化钙时气体质量减少25.2g,则混合气体中一氧化碳的质量是多少克?解析:设产物中一氧化碳的物质的量为x,二氧化碳的物质的量为y。
由碳原子守恒可得CH4的物质的量为x+y,又由氢原子守恒可得生成水的物质的量为2(x+y),则:2(x+y)×18g/mol=25.228g/mol×x +44g/mol×y=49.6-25.2解的x=0.4mol,y=0.3mol一氧化碳的质量为0.4mol×28g/mol=11.2g2.方程式叠加法:例2:将x mol氧气,y mol甲烷和z mol过氧化钠放入密闭容器中,在150℃条件下用点火花引发,恰好完全反应后,容器内压强为0,通过计算确立x、y和z之间的关系式:解析:根据反应后气体压强等于0,所以可将以下反应方程式:2CH4+4O2→2CO2+4H2O 2CO2+ 2Na2O2 →2Na2CO3+O2 2H2O+ 2Na2O2→4 NaOH+O2相加消去气体,得:2CH4+O2+ 6Na2O2→8NaOH+2Na2CO3 所以x:y:z=1:2:6练习2:若要使0.5mol CH4完全和氯气发生取代反应,并生成相同物质的量的四种取代物,则需要氯气的物质的量为多少摩尔?4CH4+10Cl2→CH3Cl+ CH2Cl2+ CHCl3 +CCl 4+10HCl 则需氯气1.25mol3.十字交叉法:十字交叉法一般只适用于两种已知成分组成的混合体系,解题关键往往在于求平均值。
其广泛应用于有关同位素、相对原子质量、溶质质量、二组分混合物质量分数、化学反应中的物质的量、体积、电子转移数及反应热等方面的计算。
例3:CH4和C2H4混合气体,其密度是同温同压下乙烷的2/3,求混合气体中甲烷的质量分数。
解析:相同状况下气体密度之比等于相对分子质量之比:M=2/3×M(C2H6)=20,由十字交叉法得:CH4 16 820 =2:1C2H4 28 4混合气体中甲烷的质量分数为2×16/(2×16+1×28)×100%=53.3%练习3:一种气态烷烃和一种气态烯烃,它们分子里的碳原子数相同。
将1.0体积这种混合气体在氧气中充分燃烧,生成2.0体积的二氧化碳和2.4体积的水蒸气(气体体积均在相同状况下测定)。
则混合气中烷烃和烯烃的体积比为:解析:由题意可知该混合烃的平均分子式可表示为C2H4.8,则烷烃是乙烷,烯烃是乙烯,由平均氢原子数,利用十字交叉法可以快捷的求出二者的体积比:C2H6 6 0.84.8C2H4 4 1.24.平均值法:此法是从求混合气体平均相对分子质量的公式推广而来的。
它巧用了平均含义,即M1≠M2且均大于0时,存在M =n n M n M n 212211++,只要求出平均值,就可判断出M1 和M2的取值范围,该法省去复杂的数学计算过程,从而迅速解出答案。
例4:一种气态烷烃和一种气态烯烃组成的混合物共10g ,混合气体的密度是相同状况下氢气的12.5倍,该混合气体通过溴水时。
溴水的质量增加8.4g ,则该混合气体是由什么组成的?解析:混合气体的平均相对分子质量是2×12.5=25。
根据平均值法确定该烷烃是甲烷。
平均相对分子质量等于25的烃有两种情况:两种气态烃的相对分子质量都是25,经分析没有这种气态烃,两气态烃中有一种烃的相对分子质量小于25,另一种的烃大于25,而相对分子质量小于25的烃只有甲烷,所以两种烃中其中一种必定是甲烷。
再根据平均相对分子质量求另一种烃。
设烯烃为:CnH2nm 烯烃=8.4g ,m (CH4)=10g —8.4g=1.6g 。
)2(4.86.16.16.1101n CnH M g mol g g g g+⋅-=25g/mol 解的n=2,即该烯烃是C2H4 练习4:某温度和压强下,将4g 由三种炔烃(分子中只含有一个碳碳三键)组成的混合气体与足量的氢气反应,充分加成后,生成4.4g 三种对应的烷烃,则所得烷烃中一定有: ( )A .异丁烷B .乙烷C .丙烷D .丁烷解析:炔烃转化成烷烃时,炔烃与氢气的物质的量之比为1:2,依据题意可知参加反应的氢气的物质的量为0.2mol ,则炔烃的物质的量为0.1mol,炔烃的平均相对分子质量为4/0.1=40。
由平均值法,可知三种炔烃中必有相对分子质量小于40的炔烃,而相对分子质量小于40的炔烃只有乙炔,由此可知加成后所得烷烃中必含乙烷。
5.讨论法:此法一般适用于与其他计算方法一起使用,这种解法的关键是进行全面的分析和判断:例5:1升乙炔和气态烯烃混合物与11升氧气混合后点燃,充分反应后,气体的体积为12升,求原1升混合气体中各成分及物质的量比(反应前后均为182℃、1.01×105Pa)解析:设该混合烃的平均分子组成为CxHyCxHy + (x+y/4)O2 == xCO2 + y/2H2O △V1 x+y/4 x y/2 y/4-1由△V=0得y/4-1=0,则y=4C2H2分子中氢原子个数为2,而混合烃的平均组成中氢原子个数为4,所以,烯烃中氢原子个数必大于4,又因为是气态烯烃,碳原子个数必小于或等于4,所以烯烃只能是C3H6或C4H8若是C3H6 则:C2H2 2 24 =1/1C3H6 6 2若是C4H8则: C2H2 2 24 =2/1C4H8 8 26.待定系数法:根据题意直接写出方程式,并在反应物及生成物前待以系数(化学计量数),最后找出系数间的关系。
例6:丁烷催化裂化时,碳链按两种方式断裂生成两种烷烃和烯烃,若丁烷裂化率为90%,且裂化生成的两种烯烃的质量相等,求裂化后得到的相对分子质量最小的气体在混合气体中所占的体积分数。