WB试剂配制
- 格式:docx
- 大小:9.88 KB
- 文档页数:1
![WB 实验步骤[1]](https://img.taocdn.com/s1/m/7ed6a947ad02de80d4d840b6.png)
WB 实验步骤1 组织蛋白裂解(使用试剂盒:索莱宝高效RIPA 组织细胞裂解液,SIb-R0010;PMSF ) 使用方法:按照说明书,每25mg 组织样本+300uL RIPA+3uL PMSF ,放置于tube 中,使用剪刀剪碎,匀浆机匀浆,离心(4℃,15000 r ,20-30,min ),取上清。
2 蛋白定量(试剂盒:碧云天G250染色液,P0006-1) (1)在96孔板上进行加样。
第一列 第二列(2)加入200ul G250考马斯亮蓝,静置五分钟,使用酶标仪检测。
(3)酶标仪选定,检测吸光设置:波长是595nm ,3-5。
Shaking 设置:duration10s.(4) 根据标准曲线求出蛋白浓度,所有样本的蛋白使用DDW 稀释到同一浓度后与Lane Marker Loading Buffer/5x 蛋白示踪上样缓冲液/还原混合(混合比列按照说明书确定),混匀,掌上离心机离心。
(5)100℃水浴加热8min ,室温放置,冷却后使用或者-20℃储存待用。
3 制胶根据蛋白大小选择分离胶浓度 胶浓度大小 6% 8% 10% 12% 成分 H2O 5.3ml 4.6ml 3.9ml 3.3ml 30%丙烯酰胺 2ml 2.7ml 3.4ml 4.0ml 1.5M Tris 2.5ml 2.5ml 2.5ml 2.5ml 10%SDS 100ul 100ul 100ul 100ul 10%APS100ul100ul100ul100ulDDW(高压灭菌双蒸水) BSA(蛋白标准品) DDW 裂解后的蛋白 孔1 20ul 0ul 5ul 15ul 2 19ul 1ul 5ul 15ul 3 18ul 2ul 5ul 15ul 4 16ul 4ul 5ul 15ul 5 12ul 8ul 5ul 15u[ 6 8ul 12ul 5ul 15ul 7 4ul 16ul 5ul 15ul 80ul20ul5ul15ulTEMED 6ul 6ul 6ul 6ul浓缩胶4%H2O 2ml30%丙烯酰胺0.5ml1.5M TRIS 0.5ml10%SDS 40ul10%APS 30ulTEMED 4ul总体积3ml4 电泳,低电压80V跑至marker分离,后改成大电压(100-120V)电泳液Running bufferTris 3.03g甘氨酸18.77gSDS 1.0gDDW 1000ml5转膜:大电压100V,转膜蛋白是40KD以上蛋白,转膜时间(1.0胶)40min-50min;小电压90V,转膜蛋白小蛋白。
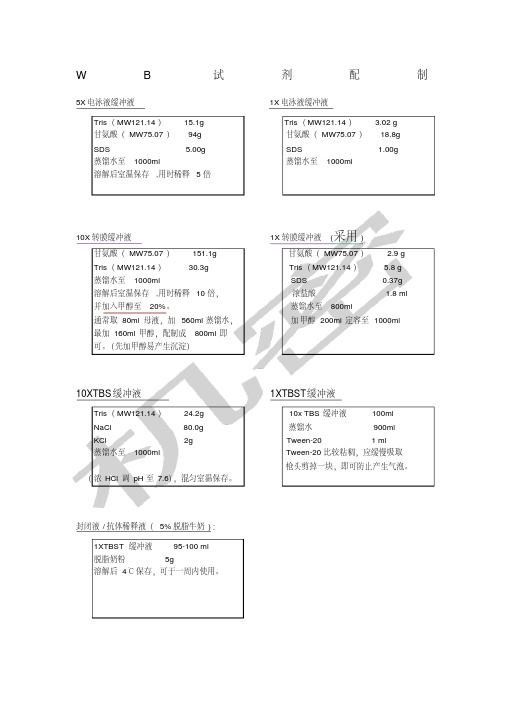
W B试剂配制5X电泳液缓冲液1X电泳液缓冲液
Tris(MW121.14)15.1g Tris(MW121.14) 3.02 g
甘氨酸(MW75.07)94g 甘氨酸(MW75.07)18.8g
SDS 5.00g SDS 1.00g
蒸馏水至1000ml 蒸馏水至1000ml
溶解后室温保存,用时稀释5倍
10X转膜缓冲液1X转膜缓冲液(采用) 甘氨酸(MW75.07)151.1g 甘氨酸(MW75.07) 2.9 g
Tris(MW121.14)30.3g Tris(MW121.14) 5.8 g
蒸馏水至1000ml SDS 0.37g
溶解后室温保存,用时稀释10倍,浓盐酸 1.8 ml
并加入甲醇至20%。
蒸馏水至800ml
通常取80ml母液,加560ml蒸馏水,加甲醇200ml定容至1000ml
最加160ml甲醇,配制成800ml即
可。
(先加甲醇易产生沉淀)
10XTBS缓冲液1XTBST缓冲液
Tris(MW121.14)24.2g 10x TBS缓冲液100ml
NaCl 80.0g 蒸馏水900ml
KCl 2g Tween-20 1 ml
蒸馏水至1000ml Tween-20比较粘稠,应缓慢吸取
枪头剪掉一块,即可防止产生气泡。
(浓HCl调pH至7.6),混匀室温保存。
封闭液/抗体稀释液(5%脱脂牛奶):
1XTBST缓冲液95-100 ml
脱脂奶粉5g
溶解后4℃保存,可于一周内使用。

动物组织wb实验步骤
动物组织Western blot实验步骤如下:
1.样品制备:将动物组织放入2 ml的离心管中,加入1 mlPBS后放入组织研磨仪中研磨1min,离心,去除PBS。
再用1mlPBS洗涤一次,离心(12000 r,10 min)弃去PBS(冰上操作)。
2.配制1mL RIPA裂解液(0.99RIPA+0.01PMSF),加入0.5-1ml的预冷的RIPA裂解液(0.1 g组织以1:10加入含PMSF/RIPA),再放入组织研磨仪中研磨3-5次,使细胞完全破碎,然后将离心管冰浴15min,每隔5min涡旋混合仪振荡30s,保证细胞完全裂解。
3.充分裂解后,12000g,4℃离心10min,将上清液转移到新的1.5ml的离心管中,即得组织总蛋白产物。
4.产物中可加入20%的甘油,保存于-20℃~-80℃。
5.注意事项:再转移上清液时不要吸入底部的沉淀并尽可能取完全上清液。
如裂解液未加入蛋白酶抑制剂,需自行加入蛋白酶抑制剂PMSF(苯甲基磺酰氟,剧毒),取适量的裂解液,再使用前数分钟加入PMSF,使其浓度为1Mm/L=0.17419g/L。
裂解蛋白的所有步骤均需要再冰上操作或4℃进行。
也可购买相关蛋白提取试剂盒按照说明书进行蛋白提取,提取变性蛋白使用国产品牌即可,如果要保持天然蛋白活性的提取,建议还是购买进口品牌。

免疫印迹(WB)实验操作具体步骤及详细说明一、试剂和溶液转印缓冲液:0.025M Tris base , 0.187 M 甘氨酸, 25%甲醇氨基黑溶液:0.1% 酸性黑10B 1×TBST:25mM Tris-HCl ( pH 8.0 ) , 0.2 M NaCl , 0.1%Tween 20 封闭液:TBST 配制的5%牛奶抗体稀释液:TBST 配制的5%牛奶显色系统:ECL 显色二、实验步骤1.电泳:将裂解液进行SDS-PAGE 电泳,80v,30 分钟,120v,90 分钟;2.转膜:PVDF 膜在甲醇中浸泡约30 秒左右,滤纸浸泡在转印缓冲液预湿,半干法转印到PVDF 膜上,10v,150 分钟;3.染色:氨基黑染色5 分钟,甲醇褪去背景色,观察条带;4.膜活化:将PVDF 膜置于甲醇活化1min,用纯水洗膜2 次后再用TBST 洗涤3 次;5.封闭:将膜条置于5%牛奶或2% BSA 中,室温混摇2h;6.一抗孵育:将待检抗体用3%牛奶或2% BSA 稀释到合适浓度(参照抗体说明书,根据客户预实验结果,稀释度上下浮动一个数量级都为正常),将膜放入对应的已稀释待检样品中,置4℃混摇孵育过夜;7.洗涤:取出膜放在TBST 中洗涤3×5min;8.二抗孵育:将膜取出放入稀释好的HRP 标记的二抗(参照二抗说明书进行稀释)中,室温混摇2h;9.洗涤:取出膜放在TBST 中洗涤3×5min;10.ECL 显色:将膜取出放入混匀的ECL 显色液中,孵育3min,将膜取出贴在有荧光角标的胶片上,迅速用保鲜膜包好;11.曝光:把底片放在暗盒中,根据荧光强度分别对X 光胶片作不同时间段的曝光,曝光结束后,将底片取出,1min 显影,30s 清洗,1min 定影,30s 清洗,晾干;12.结果分析:用扫描仪将曝光后的X 光胶片扫描,做后续结果分析。

Western blot试剂配制1.30%丙稀酰胺储存液丙稀酰胺29gN,N’-亚甲双丙稀酰胺1g双蒸水定容到100ml,经高压蒸汽灭菌的滤纸过滤避光,4℃保存于棕色瓶中2.1.5 M Tris-HCl (MW=121.1)pH 8.8Tris碱90.75g双蒸水400ml用浓HCl调pH至8.8,加双蒸水定容至500ml。
4℃冰箱保存3.1.0 M Tris pH6.8Tris碱12g双蒸水60ml用浓HCl调pH至6.8,加双蒸水定容至100ml。
4℃冰箱保存4.10%SDS(w/v)SDS 10g溶于加水至100ml,室温放置5.10%过硫酸胺(10%APS)过硫酸胺1g溶于10ml双蒸水中。
可在密闭的管子里4℃保存一周6.10×Tris-甘氨酸电泳缓冲液Tris 30.3g甘氨酸144gSDS 10g定容至1000ml室温放置。
临用时稀释成1×电泳缓冲液7.1%溴酚蓝(w/v)溴酚蓝Tris-base MilliQ 水100 mg60 mg定容至10 ml8.TEMED原液,4℃冰箱保存9.2×sample buffer(2×样品缓冲液)1.0 M Tris pH6.82.5mlSDS 0.8gDTT 0.3085g甘油3ml溴酚蓝0.004g加双蒸水至10ml,分装—20℃保存10. 4×SDS加样缓冲液10ml1M Tris-HCl(ph:6.8) 2.5mlSDS 0.8g溴酚蓝0.004g甘油4mlTakara5x buffer 总5ml1M Tris-HCl(ph:6.8) 1.25mlSDS 0.5g溴酚蓝BPB 25mg甘油 2.5ml500ul每管分装,使用前将25ul的2-ME加到没管中11.转膜缓冲液Tris 碱 5.8g甘氨酸 2.9gSDS 0.37g甲醇200ml加双蒸水至1000ml,临用前配制,4℃冷却12.1×TBSTTris 碱 3.0285 g氯化钠8.766gTween-20 500ul加双蒸水至1000ml,现配现用。

收取磷酸化WB样品的步骤操作:Western细胞裂解液使用RIPA,使用前加入(1:100)PMSF,leupeptin(1:1000),钒酸钠(1:100)以及其它蛋白酶抑制剂。
例:1mLRIPA,10μLPMSF,1μL leupeptin,10μL钒酸钠用4℃预冷的PBS漂洗细胞3次,加入裂解液(160μL)冰上裂解15min。
随后刮取细胞转移至1.5mL EP管中,冰上裂解20min,12,000rpm离心10min,取上清加入5×SDS(40μL)上样缓冲液,混匀后置于沸水浴中煮沸10min。
剩余样品冻存-20℃冰箱备用。
非磷酸化收样细胞裂解液里1:100加入PMSF。
细胞洗3次,加1mL PBS,刮到离心管里,5000rpm 4℃离心10min,弃净上清,细胞可以冻于-80℃。
加120μL裂解液(1:100加PMSF),冰上裂解30min(或裂解10min后超声),12000rpm离心10min,取上清加入5×SDS(30μL)上样缓冲液,混匀后置于沸水浴中煮沸10min。
细胞裂解液配方1% Triton X-100,150 mM sodium chloride, (NaCl)20 mM sodium fluoride, (氟化钠)20 mM sodium pyrophosphate,(焦磷酸钠)20 mM Tris–HCl(pH 8.0)1 mM EDTA,1 mM EGTA,1 mM benzamidine,(苯甲脒)1 mM phenylmethylsulfonyl fluoride, (苯甲基磺酰氟,PMSF)0.5Ag/ml leupeptin, (亮抑酶肽)1 mM sodium orthovanadate,(原钒酸钠)可以分为A液和B液体,A液用RIPA代替,B液包括:1 mM phenylmethylsulfonyl fluoride, (苯甲基磺酰氟,PMSF),0.5Ag/ml leupeptin, (亮抑酶肽),1 mM sodium orthovanadate,(原钒酸钠)。
10%分离胶一块板两块板三块板四块板8%分离胶总体积(ml)6101521总体积(ml)15 dd水 2.44 5.98.3dd水 6.9 30%聚丙烯酰胺 1.98 3.35 6.9830%聚丙烯酰胺4 1.5mol/ltris-Hcl 1.5 2.5 3.8 5.3 1.5mol/ltris-Hcl 3.8 10%SDS60μL0.10.150.2110%SDS0.15 10%AP60μL0.10.150.2110%AP0.15 TEMED 2.4μL4μL6μL8.4μL TEMED6μL 5%浓缩胶两块板四块板六块板12%分离胶总体积(ml)51015总体积(ml)5 dd水 2.85 5.78.55dd水 1.6 30%聚丙烯酰胺0.8 1.6 2.430%聚丙烯酰胺2 0.5mol/ltris-Hcl 1.25 2.5 3.75 1.5mol/ltris-Hcl 1.3 10%SDS50μL0.10.1510%SDS50μL 10%AP50μL0.10.1510%AP50μL TEMED2μL4μL6μL TEMED5μL 封闭液奶粉5%抗体稀释液TBS溶液TBST溶液奶粉5g BSA 1g氯化钠8g16g1LTBS中加入1ml吐温TTBS100ml TBST 20ml氯化钾0.2g0.4gTris3g6gdd水1000ml2000mlHcl PH调7.410乘电泳液转膜缓冲液Tris30.3g Tris 4.545g 3.03g甘氨酸187.7g甘氨酸21.6g14.4g10%SDS10g+100ml甲醇300ml200mldd水定容1000ml dd水1500ml1000ml1.5mol/L Tris.Hcl 1.0mol/L Tris.HclTris45.43g Tris30.29g dd水200ml dd水200ml浓盐酸调PH至8.8,水定容至250ml 浓盐酸调PH至7.5,定容至250ml,高温灭菌0.5mol/L Tris.HclTris15.14g10%SDSdd水200ml SDS10g 浓盐酸调PH至6.8,水定容至250ml dd水100ml 10%AP过硫酸铵0.1g上样缓冲液dd水1ml 0.5mol/L Tris-Hcl 2.5ml 二硫苏糖醇0.39g SDS0.5g 溴酚蓝0.025g 甘油 2.5ml。
电泳缓冲液(10x):Tris-Hcl:30.2gGly:187.7gSDS:10g定容至1L,稀释成1x:100ml电泳缓冲液(10x)+900ml单蒸水电转缓冲液1x:Tris-Hcl:3.03gGly:14.4dH2O:900ml100ml:甲醇,定容至1LTBS(10x,1L)Tris-Hcl:12.1gNacl:87.7g调节pH至7.6,用时稀释10倍,加1ml Tween 20,即:TBST=100ml(10x TBS)+900ml dH2O+1ml Tween 20容量为1L5x SDS-page蛋白凝胶上样缓冲液(10ml)1M Tris-Hcl:0.6ml10% SDS:2ml甘油:2.5mlBeta-巯基乙醇:0.5ml溴酚蓝:0.01g(先溶于4.4ml水中)ddH2O:4.4mlWestern blot样品制备以及蛋白质定量1. 取冰,将4°C离心机提前降温。
2. 将死细胞收集到离心管:孔板内的细胞用PBS洗1-2遍,用适量的胰酶消化,用离心管内的原培养液将孔板内细胞吹打下来,收集到离心管,室温离心1000rpm,5min。
3. 弃上清,将离心管倒扣在滤纸上,尽量吸尽残留上清。
4. 视细胞量的多少加入细胞裂解液。
(1×Cell Lysis Buffer:PMSF=100:1,1×Cell Lysis Buffer,PMSF-20°C保存。
PMSF常温易降解,拿出时间不得超过30min,必须放置冰上。
)5. 冰上裂解30min每隔10min震荡一次,离心:4°C,12000rpm,10min。
或者用超声裂解仪裂解蛋白。
6. 小心将上清转移至新EP管,记下吸取的量。
如:100μL。
7. 将收集好的蛋白保存与—20°C。
(可长期保存)蛋白质定量配置BCA工作液:根据BSA 标准品和待测样品的数量,将试剂A 和试剂B 以50:1 的体积比混匀。
Western blot试剂配制1.30%丙稀酰胺储存液丙稀酰胺29gN,N’-亚甲双丙稀酰胺1g双蒸水定容到100ml,经高压蒸汽灭菌的滤纸过滤避光,4℃保存于棕色瓶中2.1.5 M Tris-HCl (MW=121.1) pH 8.8Tris碱90.75g双蒸水400ml用浓HCl调pH至8.8,加双蒸水定容至500ml。
4℃冰箱保存3.1.0 M Tris pH6.8Tris碱12g双蒸水60ml用浓HCl调pH至6.8,加双蒸水定容至100ml。
4℃冰箱保存4.10%SDS(w/v)SDS 10g溶于加水至100ml,室温放置5.10%过硫酸胺(10%APS)过硫酸胺1g溶于10ml双蒸水中。
可在密闭的管子里4℃保存一周6.10×Tris-甘氨酸电泳缓冲液Tris 30.3g甘氨酸144gSDS 10g定容至1000ml室温放置。
临用时稀释成1×电泳缓冲液7.1%溴酚蓝(w/v)8.TEMED原液,4℃冰箱保存9.2×sample buffer(2×样品缓冲液)1.0 M Tris pH6.82.5mlSDS 0.8gDTT 0.3085g甘油3ml溴酚蓝0.004g加双蒸水至10ml,分装—20℃保存10. 4×SDS加样缓冲液10ml1M Tris-HCl(ph:6.8) 2.5mlSDS 0.8g溴酚蓝0.004g甘油4mlTakara5x buffer 总5ml1M Tris-HCl(ph:6.8) 1.25mlSDS 0.5g溴酚蓝BPB 25mg甘油 2.5ml500ul每管分装,使用前将25ul的2-ME加到没管中11.转膜缓冲液Tris 碱 5.8g甘氨酸 2.9gSDS 0.37g甲醇200ml加双蒸水至1000ml,临用前配制,4℃冷却12.1×TBSTTris 碱 3.0285 g氯化钠8.766gTween-20 500ul加双蒸水至1000ml,现配现用。