实时荧光定量PCR原理操作及其应用共41页文档
- 格式:ppt
- 大小:10.83 MB
- 文档页数:41

实时荧光定量PCR的原理操作及其应用实时qPCR的基本原理是利用DNA模板进行PCR扩增,并通过特定荧光探针或抑制剂标记扩增产物,荧光信号的强度与目标模板数量成正比。
PCR扩增过程中,荧光信号逐渐累积,通过荧光检测系统实时监测荧光的强度变化,可以获取PCR扩增曲线,并通过比较样品的荧光信号与标准曲线建立一个浓度与荧光信号的转换关系,从而确定样品中目标物质的数量。
实时qPCR的操作过程通常包括以下几个步骤:1.准备反应体系:根据所需扩增物质选择合适的引物和探针,并根据样品数量和扩增条件计算所需反应体系的配方。
反应体系中通常包括DNA模板、引物、探针、dNTPs、缓冲液和DNA聚合酶等。
2.设定PCR程序:根据不同引物的特性和样品的要求,设置PCR程序。
PCR程序通常包括一个初始变性步骤,多个循环变性/退火/延伸步骤和一个终止步骤。
循环变性/退火/延伸步骤的温度和时间通常根据引物的需求进行设定。
3.反应体系装填:将反应体系装入PCR管或耐热反应板中,确保样品和反应物均匀分布。
4.实时监测:将PCR反应体系置于实时荧光PCR仪中,根据设定的PCR程序进行扩增,并实时监测荧光信号的累积变化。
5.数据分析:根据荧光信号的变化情况,可以绘制PCR扩增曲线,并通过计算荧光信号的阈值周期数(Ct值)来确定样品中目标物质的相对数量。
比较不同样品的Ct值,可以进行定量分析。
实时qPCR具有广泛的应用。
1.基因表达分析:可以通过实时qPCR检测特定基因在不同组织或样品中的表达水平,从而研究基因在生理和病理过程中的作用。
2.病原体检测:实时qPCR可以用于快速、准确地检测和鉴定病原体,如细菌、病毒和寄生虫等,对于临床诊断和流行病学研究具有重要意义。
3.检测基因突变:实时qPCR可以用于检测个体中基因突变的存在与否,并进行基因型分析,从而研究与疾病相关的突变和遗传变异。
4.微生物学研究:可以通过实时qPCR检测微生物的数量和动态变化,了解其在环境中的分布和生物地理学特征,以及其在食品安全、环境保护等方面的应用。


实时荧光定量PCR原理与分析方法实时荧光定量PCR(qPCR)是一种基于PCR技术的DNA定量方法,可以在实时反应过程中实时监测PCR产物的累积情况。
与传统的终点PCR相比,qPCR具有更高的灵敏度和准确性,可以定量检测非常低浓度的目标DNA。
实时荧光定量PCR的原理是利用荧光染料与PCR产物结合发出荧光信号,通过监测荧光信号的强度来测定PCR产物的数量。
qPCR有两种常用的检测方法:SYBR Green I染料法和探针法(如TaqMan探针法)。
SYBR Green I染料法是一种简单而常用的qPCR检测方法。
SYBR Green I是一种DNA结合荧光染料,在PCR反应过程中会与PCR产物的DNA结合,从而产生荧光信号。
这种方法的优点是简便、经济,但缺点是非特异性,可能产生假阳性结果。
探针法是一种更为特异和准确的定量PCR方法。
在这种方法中,需要设计一对特异性引物和一个包含荧光探针的引物。
在PCR反应过程中,引物与目标DNA特异性结合,探针结合在引物的靶区上,当PCR反应进行到延伸阶段时,Taq聚合酶会切割探针上的荧光标记,导致断裂,这样就分离出信号的发射荧光信号。
探针法具有高特异性和准确性,能够避免假阳性结果。
无论是SYBR Green I染料法还是探针法,实时荧光定量PCR的分析方法都是通过构建标准曲线并计算目标DNA的模板数量来定量分析样品中的目标物质。
首先,需要用已知浓度的目标DNA制备标准品,根据不同浓度标准品的CT值(荧光信号阈值)绘制标准曲线。
然后,将样品DNA与引物一起进行PCR扩增反应,监测荧光信号强度并记录CT值。
利用标准曲线可以计算出样品中目标物质的浓度。

实时荧光定量PCR的原理及应用导读实时荧光定量PCR技术是指在PCR反应体系中加入荧光染料或荧光集团,利用荧光信号来实时监测整个PCR进程,最后通过标准曲线对未知模板浓度进行定量分析。
其特点有:(1)用产生荧光信号的指示剂显示扩增产物的量,进行实时动态连续的荧光监测,避免终点定量的不准确性,并且消除了标本和产物的污染,且无复杂的产物后续处理过程。
(2)荧光信号通过荧光染料嵌入双链DNA,或荧光探针特异结合木得检测物等方法获得,打打提高了检测的灵敏度、特异性和精确性。
Real-time O-PCR可以应用于mRNA表达的研究、DNA拷贝数的检测、单核苷酸多态性的测定、细胞因子的表达分析、肿瘤耐药基因表达的研究以及病毒感染的定量监测。
实时荧光定量PCR技术的基本原理在PCR反应体系中加入荧光染料或荧光基团,这些荧光物质有其特定的波长。
仪器可以自动检出,利用荧光信号积累,实时监测整个PCR进程,在PCR循环中,测量的信号将作为荧光阈值的坐标。
并且引入一个——Ct值(Threshold cycle)概念,Ct值是指产生可被检测到得荧光信号所需的最小循环数,是在PCR循环过程中荧光信号由本底开始进入指数增长阶段的拐点所对应的循环次数。
荧光阈值相当于基线荧光信号的平均信号标准偏差的10倍。
一般认为在荧光阈值以上所测出的荧光信号是一个可信的信号,可以用于定义一个样本的Ct值。
通常用不同浓度的标准样品的Ct值来产生标准曲线,然后计算相对方程式。
方程式的斜度可以用来检查PCR的效率,所有标准曲线的线性回归分析需要存在一个高相关系数(R²>0.99),这样才能认为实验的过程和数据是可信的,使用这个方程式计算出未知样本的初始模板量。
实时荧光定量PCR仪都有软件,可以从标准曲线中自动地计算出未知样本的初始模板量。
实时荧光定量PCR技术的应用1. 基因工程研究领域①基因表达研究:对β地中海贫血症患者β与γ珠蛋白mRNA 水平进行检测,其结果特异性强、定量准确,为了解β地中海贫血的分子病理机制及其临床诊断提供了可靠的检测数据。
实时荧光定量PCR技术原理与应用聚合酶链式反应 ( PCR) 可对特定核苷酸片断进行指数级的扩增。
在扩增反应结束之后,我们可以通过凝胶电泳的方法对扩增产物进行定性的分析,也可以通过放射性核素掺入标记后的光密度扫描来进行定量的分析。
无论定性还是定量分析,分析的都是 PCR 终产物。
但是在许多情况下,我们所感兴趣的是未经 PCR 信号放大之前的起始模板量。
例如我们想知道某一转基因动植物转基因的拷贝数或者某一特定基因在特定组织中的表达量。
在这种需求下荧光定量 PCR 技术应运而生。
所谓的实时荧光定量 PCR 就是通过对 PCR 扩增反应中每一个循环产物荧光信号的实时检测从而实现对起始模板定量及定性的分析。
在实时荧光定量 PCR 反应中,引入了一种荧光化学物质,随着 PCR 反应的进行, PCR 反应产物不断累计,荧光信号强度也等比例增加。
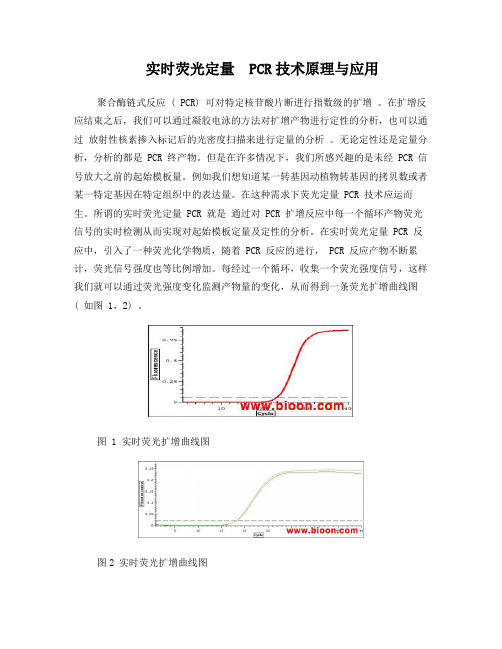
每经过一个循环,收集一个荧光强度信号,这样我们就可以通过荧光强度变化监测产物量的变化,从而得到一条荧光扩增曲线图( 如图 1,2) 。
图 1 实时荧光扩增曲线图图2 实时荧光扩增曲线图一般而言,荧光扩增曲线扩增曲线可以分成三个阶段:荧光背景信号阶段 , 荧光信号指数扩增阶段和平台期。
在荧光背景信号阶段,扩增的荧光信号被荧光背景信号所掩盖,我们无法判断产物量的变化。
而在平台期,扩增产物已不再呈指数级的增加。
PCR 的终产物量与起始模板量之间没有线性关系,所以根据最终的PCR 产物量不能计算出起始 DNA 拷贝数。
只有在荧光信号指数扩增阶段, PCR 产物量的对数值与起始模板量之间存在线性关系,我们可以选择在这个阶段进行定量分析。
为了定量和比较的方便,在实时荧光定量 PCR 技术中引入了两个非常重要的概念:荧光阈值和 CT 值。
荧光阈值是在荧光扩增曲线上人为设定的一个值,它可以设定在荧光信号指数扩增阶段任意位置上,但一般我们将荧光域值的缺省设置是 3-15 个循环的荧光信号的标准偏差的 10 倍。

实时荧光定量PCR技术的原理及其应用引言实时荧光定量PCR(Polymerase Chain Reaction)技术是一种细胞遗传学和分子生物学研究中常用的分子检测技术。
它能够迅速、准确地进行DNA或RNA的定量测量,并在许多领域中广泛应用,例如基因表达分析、病原微生物检测和病毒定量等。
本文将重点介绍实时荧光定量PCR技术的原理和一些典型应用。
实时荧光定量PCR技术原理实时荧光定量PCR技术是在传统PCR反应的基础上发展而来的一种PCR变体。
其原理可以简单概括为光信号的实时检测和荧光强度的定量分析。
实时荧光定量PCR技术的具体步骤如下:1.引物与探针设计在实时荧光定量PCR反应中,合适的引物和探针设计是至关重要的。
引物用于在反应中特异性地扩增目标DNA或RNA序列,而探针则用于荧光信号的检测。
引物和探针的设计需要确保其与目标序列的亲和力和特异性,以避免非特异性扩增和假阳性结果。
2.标定曲线制备为了进行定量分析,需要事先制备一条标定曲线。
标定曲线通常是通过浓度已知的目标序列的一系列稀释样品制备的。
这些稀释样品经过PCR扩增后,荧光信号的强度与初始浓度呈线性关系。
通过测量待测样品的荧光信号强度,并利用标定曲线进行外推,可以获得目标DNA或RNA的定量结果。
3.PCR反应体系组装PCR反应体系的组装需要考虑到引物和探针的最优浓度,以及反应缓冲液、酶和模板DNA或RNA的最佳配比。
此外,反应体系中还需要加入辅助成分,如酶抑制剂和荧光染料,以提高PCR反应的特异性和灵敏度。
4.实时荧光检测及数据分析在PCR反应进行过程中,荧光信号会随着目标DNA或RNA的扩增而增强。
实时荧光定量PCR仪会实时监测和记录荧光信号的变化情况,并生成扩增曲线。
通过分析荧光信号的增长速度和荧光信号的峰值,可以确定目标DNA或RNA的起始浓度。
实时荧光定量PCR技术应用1. 基因表达分析实时荧光定量PCR技术在基因表达分析中被广泛应用。
实时荧光定量PCR的原理操作及其应用实时荧光定量PCR的基本原理是在PCR反应体系中添加一种或多种荧光标记的探针,它与目标序列的特定区域互补,当探针与目标序列结合时,荧光信号被激发,产生荧光发射。
随着PCR反应的进行,目标序列的数量增加,荧光信号也随之增强。
通过实时监测PCR扩增过程中的荧光信号强度的变化,可以推断出起始模板的数量。
操作上,实时荧光定量PCR主要分为两个步骤:反转录和PCR。
首先,反转录将RNA逆转录合成cDNA,得到DNA模板。
然后,在PCR反应中,将DNA模板与荧光标记的探针、引物和核酸酶混合,开始PCR扩增。
PCR反应体系中的荧光探针在PCR扩增过程中的特定温度下与目标序列结合,产生荧光信号。
荧光信号被特定的光学设备检测和记录,得出PCR产物的数量。
实时荧光定量PCR具有广泛的应用领域。
在基因表达分析方面,qPCR可以用来定量测量特定基因的转录水平,研究基因的表达模式和差异。
在病原微生物检测方面,qPCR可以快速、准确地检测和鉴定细菌、病毒和寄生虫等病原体。
在遗传疾病诊断和监测方面,qPCR可以检测一些突变、插入或缺失等遗传变异,并进行遗传病的筛查与诊断。
此外,qPCR还可以用于检测和定量分析环境样品中的微生物、植物和动物等生物种群,了解物种多样性、群落结构和生态系统功能。
实时荧光定量PCR的优点包括高灵敏度、高特异性、高准确性和高重复性。
与传统PCR方法相比,qPCR不需要进行凝胶电泳分析,减少了实验操作的时间和手动操作的误差。
另外,荧光定量PCR还可以采用多通道检测不同靶标,提高实验的高通量性。
然而,实时荧光定量PCR也有一些局限性。
首先,荧光标记的探针需要根据目标序列的特点设计,设计不当可能会导致假阳性或假阴性结果。
其次,荧光信号的准确性受到反应物质的浓度和质量的影响,需要进行严格的实验操作和数据分析。
此外,实时荧光定量PCR的设备和试剂比传统PCR更昂贵,需要专业的实验室设施和经验。
实时荧光定量pcr技术原理与应用实时荧光定量PCR技术原理与应用一、引言实时荧光定量PCR技术(Real-time quantitative PCR,qPCR)是一种基于荧光信号的PCR方法,可以实时监测PCR反应的进程。
相比传统的末端定量PCR方法,qPCR具有更高的灵敏性、准确性和可靠性。
本文将介绍qPCR的原理和应用。
二、原理qPCR利用荧光探针在PCR过程中发出的荧光信号来定量PCR产物的数量。
其原理基于PCR技术,但在反应过程中引入了荧光探针。
在PCR反应的扩增过程中,荧光探针与靶DNA序列特异性结合,通过荧光信号的增强来检测靶DNA的数量。
qPCR的主要荧光探针有两种:TaqMan探针和SYBR Green探针。
TaqMan探针是一种双标记探针,它包含一个荧光染料和一个荧光淬灭剂。
在PCR反应中,TaqMan探针与靶DNA序列结合后,酶的活性将荧光染料释放出来,产生荧光信号。
SYBR Green探针是一种非特异性结合荧光染料,其荧光信号与PCR产物的数量成正比。
三、应用1. 基因表达分析qPCR广泛应用于基因表达分析。
通过检测靶基因的mRNA水平,可以评估基因的表达情况。
qPCR可以检测低表达基因和高表达基因之间的差异,并对基因调控进行定量研究。
这对于研究基因功能、诊断疾病以及药物开发具有重要意义。
2. 病原体检测qPCR在病原体的检测和诊断中起着重要作用。
通过设计特异性引物和荧光探针,可以快速、准确地检测病原体的DNA或RNA。
例如,在临床诊断中,qPCR被广泛用于检测病毒、细菌、真菌等致病微生物。
3. 遗传疾病筛查qPCR也被用于遗传疾病的筛查。
通过检测患者的DNA样本,可以准确判断某些遗传疾病的患病风险。
例如,qPCR可以检测染色体异常、突变等遗传变异,为遗传咨询和疾病预防提供重要依据。
4. 肿瘤标记物检测qPCR在肿瘤标记物检测中也有广泛应用。
通过检测肿瘤相关基因的表达水平,可以评估肿瘤的发生和发展情况。