蛋白质的复性
- 格式:ppt
- 大小:1.03 MB
- 文档页数:61

第十章蛋白质复性Protein RefoldingOff-pathwayk I k A U I NAk N On-pathway 蛋白质体外复性的主要挑战:操作条件抑制聚集体生成,提高复性收率。
主要影响因素l变性剂浓度(脲、盐酸胍)l氧化还原剂浓度、比例l pHl蛋白质稳定剂(甘油、海藻糖…)l蛋白质浓度l杂质种类和含量l变性剂浓度(脲、盐酸胍)l蛋白质聚集抑制剂(聚乙二醇、表面活性剂…)l盐的种类、浓度l混合效率l温度体外复性研究的核心问题1、模仿体内蛋白质折叠过程:构建适于蛋白质正确折叠的环境,设计能够促进蛋白质正确折叠、抑制折叠中间体聚集的折叠助剂2、发挥体外折叠的独特优势:构建体内不可能存在的独特环境,实现高效复性和分离纯化:色谱、反胶团、膜、双水相系统、沉淀……降低变性蛋白质溶液中变性剂的浓度,创造适宜的氧化还原环境(氧化还原电位),可引发蛋白质折叠复性;基本条件:-变性剂浓度:盐酸胍< 2 mol/L脲< 4 mol/L-GSH/GSSG 4/0.4 mmol/L ~ 5/5 mmol/L (例)ü直接稀释、透析、流加4.1 稀释复性复性缓冲液变性液蛋白质变性剂水、助剂Refolding bufferDenatured proteinPumpMagnetic stirrer 37 o C提高复性收率,且终浓度较高。
蛋白质复性特点-稀释复性小结低浓度下进行复性操作有利于提高活性收率;浓度提高则聚集体生产速度加快,复性收率下降;流加复性有利于实现高浓度下的高收率复性;存在适宜的变性剂浓度,使复性收率最大;抑制聚集体的生成,是提高复性收率的关键!In vivo protein folding体内折叠:是在一系列折叠酶、分子伴侣和水解酶的辅助下完成的。
F. Baneyx, M. Mujacic: Nature Biotechnology, 2004, 22: 1399折叠助剂(Folding aids)l蛋白质体内折叠是在各种折叠调解因子(modulators)和蛋白酶的共同作用下完成的;l调解因子:分子伴侣(chaperones)和折叠酶(foldases)体外蛋白质复性的策略l体外复性应模仿体内折叠过程。


蛋白质复性名词解释蛋白质是由氨基酸组成的生物大分子,是构成生物体各种组织和器官的重要成分。
蛋白质的功能多样,可以参与生物体内的酶催化、结构支持、运输、通信、能量存储、免疫防御等重要生理过程。
蛋白质的复性是指它的折叠状态和三维结构。
蛋白质synthesized 是在生物体内通过一系列复杂的生物化学反应合成的,但它不是以线性链的形式存在,而是经过折叠和组装形成复杂的三维结构。
这个过程被称为蛋白质的折叠,而折叠之后形成的三维结构就是蛋白质的复性。
蛋白质的复性是非常关键的,因为它决定了蛋白质的功能和稳定性。
如果蛋白质的复性受到破坏,它可能失去原有的生物活性和功能。
例如,当蛋白质的复性受到变性剂(如酸、碱、高温等)的作用时,蛋白质的结构可能会发生改变,导致其在生物体内无法正常发挥作用。
蛋白质的折叠和复性是一个自发的过程,在正常生理条件下,蛋白质可以自行正确地折叠成其稳定的复性。
但有时蛋白质的折叠过程会出现错位或失败,导致其形成不正确的复性。
这种情况下,被称为蛋白质的错折,错误复性的蛋白质可能会失去原有的功能,甚至产生有害的效应。
蛋白质折叠和复性的控制是一个复杂的过程,涉及到多个层面的调节。
通常,蛋白质的折叠主要由其氨基酸序列所决定,不同氨基酸之间的相互作用力(如氢键、离子相互作用、范德华力等)在折叠过程中扮演重要的角色。
此外,还有一些蛋白质专门参与蛋白质折叠和复性的分子辅助工具,如分子伴侣和分子伴侣辅助因子等,它们能够帮助蛋白质正确折叠和达到稳定的复性。
总之,蛋白质的复性是指其折叠和组装成稳定的三维结构的过程,它对蛋白质的功能和稳定性起着关键作用。
探索蛋白质复性的机制对于理解生物大分子的结构与功能具有重要意义,也对于研究蛋白质相关疾病和开发药物具有重要价值。

名词解释蛋白质的复性蛋白质的复性:现象与意义在生物化学领域中,蛋白质的复性是一个广泛而重要的研究课题。
复性是指蛋白质经历一系列空间结构和功能的调整,重建其原有的三维结构以及所能发挥的功能。
本文将探讨蛋白质复性的现象、机制以及其在生物体内的意义。
1. 蛋白质的复性现象复性是蛋白质遭受外部环境的一系列不良条件(如高温、极酸或极碱性条件、化学变性剂等)后,通过一定机制修复并重获原有结构与功能的过程。
在这个过程中,蛋白质的一级、二级和三级结构受到损伤,导致其失去正常功能。
蛋白质的复性可以发生在细胞内部和细胞外部。
在细胞内,复性通常由分子伴侣和分子伴侣系统促进,如分子伴侣热休克蛋白HSP70、HSP90等。
这些分子伴侣通过与蛋白质相互作用,引导失去结构的蛋白质重新折叠成正确的形式,并防止其在复性过程中发生聚集。
2. 蛋白质的复性机制复性过程涉及多个事件和步骤,其中最为关键的是解聚和折叠。
解聚是指复性过程中产生的不正常和不稳定的蛋白质聚集体分解为单体。
这个步骤由分子伴侣和其他调节蛋白质负责。
折叠是指蛋白质通过一系列无序到有序的结构变化,重新将其折叠成正确的三维构象。
折叠的过程中,分子伴侣系统与其他辅助蛋白质(如折叠辅助酶和蛋白激酶等)相互作用,协助和促进正确的二级和三级结构的形成。
此外,糖基化也被认为是蛋白质复性的关键机制之一。
在糖基化过程中,糖链与特定氨基酸残基结合,形成糖蛋白复合物。
这种复合物不仅能帮助维持蛋白质的稳定性,还可促进正确的折叠。
3. 蛋白质复性的意义蛋白质的复性在维持生物体内正常的生理功能中起着至关重要的作用。
在细胞内,复性可以防止异常蛋白质的聚集和沉积,减轻内环境的毒性。
此外,蛋白质复性还与许多重要的生物过程密切相关。
例如,蛋白质折叠失常与多种神经性疾病,如阿尔茨海默病和帕金森病相关。
了解复性过程可以帮助我们深入了解这些疾病的发生机制,并为研发相关的治疗方法提供新的思路。
另外,蛋白质复性也对生物技术领域具有重要意义。



蛋白质复性的条件及影响因素_cropped摘要蛋白质复性是一个过程 ,存在中间阶段 ,此阶段的各种相互作用力决定了蛋白质能否复性。
蛋白质复性要求有一定的条件 ,如 p H、温度、离子强度、蛋白质浓度等。
另外多种添加剂能促进蛋白质复性 ,其中包括表面活性剂、低浓度变性剂、分子伴侣蛋白和各种氧化还原对 ,但对于不同蛋白质 ,因其结构及理化特性不同 ,采取不同复性方法 ,可以使其达到最佳复性效果。
关键词蛋白质 ; 结构与复性蛋白质是一种具有复杂的空间立体结构的大分,某些脯氨酸异构酶在含有脯氨酸的变性蛋白结构质中被证明对复性有辅助作用。
来源于不同物种中子物质 ,易受外界条件的影响发生变性。
随着基因的同一蛋白质在氨基酸排列顺序上会存在不同程度工程技术的发展 ,许多实验通过将目的蛋白基因转入原核或真核表达体系进行表达的方法 ,得到需要的差异 , 但其折叠方式却有很大的保守性。
Wal23 的蛋白质 ,这大大丰富了蛋白质的来源。
但这些蛋 lace 研究了来源于大肠杆菌、人和乳酸杆菌的二氢白质 ,由于表达体系本身的原因 , 或实验过程的处叶酸还原酶的复性 ,虽然这 3 种蛋白在氨基酸顺序理 ,多以无活性的形式存在 ,需要进行复性。
因此 , 上只有 30 %相同 ,但是却具有相同的复性途径和两对蛋白质复性的研究必然的成为从基础的实验室生个中间体。
蛋白质的空间结构由一系列化学键来维物工程研究到最终临床应用过程中不可避免的一系 ,其中二硫键是维系蛋白质结构完整的重要共价步。
本文将目前国内外对各种蛋白质复性方面的研键 ,二硫键的打开或错误搭配会引起蛋白质高级结究作一综述。
构的丧失 ,恢复二硫键结构是蛋白质复性的重要一步。
在蛋白质的复性过程中 ,存在一系列的结构相 1 蛋白质的结构与复性 ,这些中间体分子表面有许多疏水基团似的中间体蛋白质在一定的氨基酸顺序的基础上形成非常暴露 ,对聚集较敏感 ,易于形成沉淀。
同时 ,分子内复杂的空间立体结构 ,其组成中的氨基酸本身的特部氨基酸之间存在使蛋白质正确折叠的天然作用性是蛋白质高级结构形成的决定因素和结构基础 , 力 ,蛋白质的复性过程就是这些中间体向两个方向尤其是处于关键部位的氨基酸 ,对蛋白质的生物学 4 选择性的演变过程,蛋白质复性效率就取决于正功能有根本的影响 ,例如镰刀型红细胞贫血症中血确折叠和变性聚集之间的竞争。


蛋白质复性方法及其注意事项蛋白前期准备(1)查阅目标蛋白相关文献,了解其等电点,标签等注意点。
(2)如果目标蛋白易降解,可在纯化时加1-2mMDTT,全程低温,及时处理。
(3)透析Buffer的选择可参考文献。
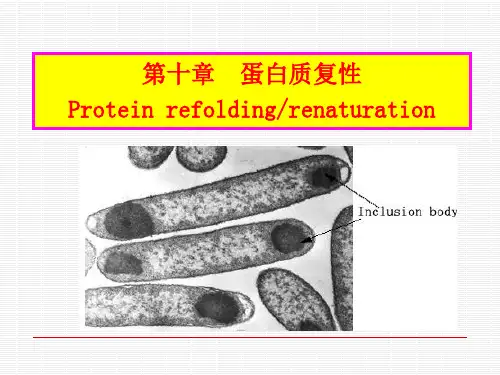
蛋白复性包涵体:在某些生长条件下,大肠杆菌能积累某种特殊的生物大分子,它们致密地集聚在细胞内,或被膜包裹或形成无膜裸露结构,这种水不溶性的结构称为包涵体(Inclusion Bodies,IB)。
在E.coli中累积的重组蛋白会迅速地以包涵体形式被沉淀出来,这些包涵体蛋白是丧失生物活性的不可溶的错误折叠蛋白的聚集体。
包涵体的处理一般包括这么几步:包涵体的洗涤、溶解、纯化及复性。
如果过表达蛋白在包涵体中,那么通常有两个选择可以考虑:(1)退一步,优化表达条件;(2)接受包涵体并采取策略来将蛋白溶解以及复性。
这里主要考虑第二种方案。
包涵体的洗涤破碎细胞都会使细胞内蛋白质或核酸水解酶释放到溶液中,使大分子生物降解,导致天然物质量的减少,加入蛋白酶抑制剂等,还可通过选择pH、温度或离子强度等,使这些条件都要适合于目的物质的提取。
洗涤Buffer:50mM Tris-HCl(pH8.0), 2mM EDTA, 2mM DTT,150mM NaCl, 1% Triton X-100, 1mg/ml Leupeptin, 1mg/ml Pepstatin,1mM TCEP。
超声时用40-60ml裂解液,因为我们的超声仪很适合用100ml小烧杯,装40-60ml裂解液,这样能让超声头离液面不高不低,不会洒出来.菌多就延长超声时间(全程冰浴)。
包涵体的溶解1、对于尿素和盐酸胍的选择:尿素和盐酸胍属中强度变性剂,易经透析和超滤除去。
它们对包涵体氢键有较强的可逆性变性作用,所需浓度尿素8-10M,盐酸胍6-8M。
尿素溶解包涵体较盐酸胍慢而弱,溶解度为70-90%,尿素在作用时间较长或温度较高时会裂解形成氰酸盐,对重组蛋白质的氨基进行共价修饰,但用尿素溶解具有不电离,呈中性,成本低,蛋白质复性后除去不会造成大量蛋白质沉淀以及溶解的包涵体可选用多种色谱法纯化等优点,故目前已被广泛采用。

蛋白的变性和复性变性:蛋白质的空间结构是体现生物功能的基础,蛋白质折叠则是形成空间结构的过程。
蛋白质一级结构决定其高级结构的著名学说, 认为蛋白质折叠是受热力学因素控制的. 天然蛋白质处于能量最低(即热力学最稳定)的状态. 一般来说, 天然蛋白质的结构是相对稳定的, 结构的稳定性也是其保持生物个体功能和物种的相对稳定所要求的.蛋白质担负着复杂的生化反应, 同时在生物合成以后, 蛋白质本身也经历着繁杂的生理过程. 蛋白质自翻译以后, 还需进行一系列的翻译后过程, 包括跨膜转运、修饰加工、折叠复性、生化反应、生物降解等. 这些过程似乎都伴随着蛋白质的结构转换, 不但受蛋白质肽链自身的热力学稳定性所控制, 而且还受动力学过程控制.变性原因:蛋白质因受某些物理或化学因素的影响,分子的空间构象被破坏,从而导致其理化性质发生改变并失去原有的生物学活性的现象称为蛋白质的变性作用(denaturation)。
变性作用并不引起蛋白质一级结构的破坏,而是二级结构以上的高级结构的破坏,变性后的蛋白质称为变性蛋白。
引起蛋白质变性的因素很多,物理因素有高温、紫外线、X-射线、超声波、高压、剧烈的搅拌、震荡等。
化学因素有强酸、强碱、尿素、胍盐、去污剂、重金属盐(如Hg2+、Ag+、Pb2+等)三氯乙酸,浓乙醇等。
不同蛋白质对各种因素的敏感程度不同。
蛋白质变性后许多性质都发生了改变,主要有以下几个方面:(一)生物活性丧失蛋白质的生物活性是指蛋白质所具有的酶、激素、毒素、抗原与抗体、血红蛋白的载氧能力等生物学功能。
生物活性丧失是蛋白质变性的主要特征。
有时蛋白质的空间结构只有轻微变化即可引起生物活性的丧失。
(二)某些理化性质的改变蛋白质变性后理化性质发生改变,如溶解度降低而产生沉淀,因为有些原来在分子内部的疏水基团由于结构松散而暴露出来,分子的不对称性增加,因此粘度增加,扩散系数降低。
(三)生物化学性质的改变蛋白质变性后,分子结构松散,不能形成结晶,易被蛋白酶水解。
目录一、脲和盐酸胍在包涵体蛋白质纯化中的作用二、包涵体变复性三、包涵体洗涤纯化——7~10四、包涵体提出、纯化和复性一、二、包涵体变复性包涵体是指细菌表达的蛋白在细胞内凝集,形成无活性的固体颗粒。
一般含有50%以上的重组蛋白,其余为核糖体元件、RNA聚合酶、内毒素、外膜蛋白ompC、ompF和ompA等,环状或缺口的质粒DNA,以及脂体、脂多糖等。
基本信息中文名称包涵体变复性复性方法稀释复性原因基因工程菌的表达产率过高包涵体变性破菌洗涤溶解目录1包涵体2包涵体变性3包涵体复性包涵体是指细菌表达的蛋白在细胞内凝集,形成无活性的固体颗粒。
一般含有50%以上的重组蛋白,其余为核糖体元件、RNA聚合酶、内毒素、外膜蛋白ompC、ompF和ompA等,环状或缺口的质粒DNA,以及脂体、脂多糖等,大小为0.5-1μm,具有很高的密度(约1.3mg/mL),无定形,呈非水溶性,只溶于变性剂如尿素、盐酸胍等。
NMR等新技术的应用表明包涵体具有一定量的二级结构,他们可能在复性的启动阶段中具有一定的作用。
包涵体的形成原因主要因为在重组蛋白的表达过程中缺乏某些蛋白质折叠的辅助因子,或环境不适,无法形成正确的次级键等原因形成的。
1.基因工程菌的表达产率过高,超过了细菌正常的代谢水平,由于细菌的δ因子的蛋白水解能力达到饱和,使之表达产物积累起来。
研究发现在低表达时很少形成包涵体,表达量越高越容易形成包涵体。
原因可能是合成速度太快,以至于没有足够的时间进行折叠,二硫键不能正确的配对,过多的蛋白间的非特异性结合,蛋白质无法达到足够的溶解度等。
2.重组蛋白的氨基酸组成:一般说含硫氨基酸越多越易形成包涵体,而脯氨酸的含量明显与包涵体的形成呈正相关。
3.重组蛋白所处的环境:发酵温度高或胞内pH接近蛋白的等电点时容易形成包涵体。
4.重组蛋白是大肠杆菌的异源蛋白,由于缺乏真核生物中翻译后修饰所需酶类和辅助因子,如折叠酶和分子伴侣等,致使中间体大量积累,容易形成包涵体沉淀。
蛋白质复性方法及其注意事项蛋白前期准备( 1)查阅目标蛋白相关文献,了解其等电点,标签等注意点。
(2)如果目标蛋白易降解,可在纯化时加1-2mMDTT,全程低温,及时处理。
( 3)透析Buffer 的选择可参考文献。
蛋白复性包涵体:在某些生长条件下,大肠杆菌能积累某种特殊的生物大分子,它们致密地集聚在细胞内,或被膜包裹或形成无膜裸露结构,这种水不溶性的结构称为包涵体( Inclusion Bodies,IB)。
在E.coli中累积的重组蛋白会迅速地以包涵体形式被沉淀出来,这些包涵体蛋白是丧失生物活性的不可溶的错误折叠蛋白的聚集体。
包涵体的处理一般包括这么几步:包涵体的洗涤、溶解、纯化及复性。
如果过表达蛋白在包涵体中,那么通常有两个选择可以考虑: (1)退一步,优化表达条件;(2)接受包涵体并采取策略来将蛋白溶解以及复性。
这里主要考虑第二种方案。
包涵体的洗涤破碎细胞都会使细胞内蛋白质或核酸水解酶释放到溶液中,使大分子生物降解,导致天然物质量的减少,加入蛋白酶抑制剂等,还可通过选择pH、温度或离子强度等,使这些条件都要适合于目的物质的提取。
洗涤Buffer:50mM Tris-HCI(pH8.0), 2mM EDTA, 2mM DTT150mM NaCI, 1% Triton X-100, 1mg/ml Leupeptin, 1mg/ml Pepstatin,1mM TCEP。
超声时用40-60ml裂解液,因为我们的超声仪很适合用100ml小烧杯装40-60ml裂解液,这样能让超声头离液面不高不低,不会洒出来.菌多就延长超声时间(全程冰浴)。
包涵体的溶解1、对于尿素和盐酸胍的选择:尿素和盐酸胍属中强度变性剂,易经透析和超滤除去。
它们对包涵体氢键有较强的可逆性变性作用,所需浓度尿素8-10M,盐酸胍6-8M。
尿素溶解包涵体较盐酸胍慢而弱,溶解度为70-90%,尿素在作用时间较长或温度较高时会裂解形成氰酸盐,对重组蛋白质的氨基进行共价修饰,但用尿素溶解具有不电离,呈中性,成本低,蛋白质复性后除去不会造成大量蛋白质沉淀以及溶解的包涵体可选用多种色谱法纯化等优点,故目前已被广泛采用。