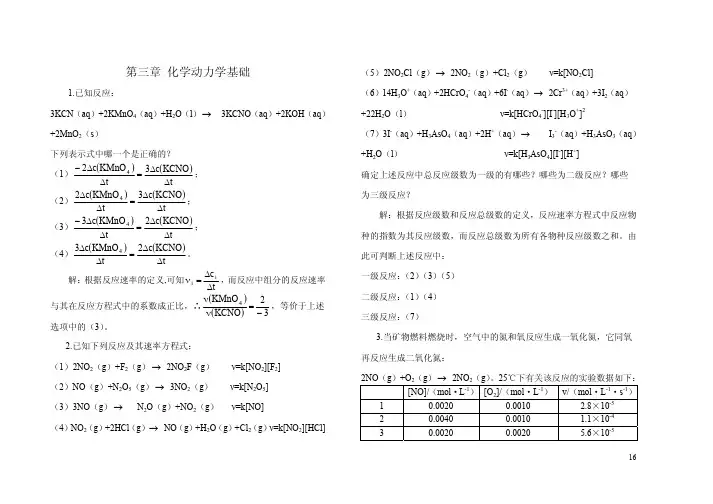
第三章 化学动力学基础
- 格式:ppt
- 大小:1.64 MB
- 文档页数:46


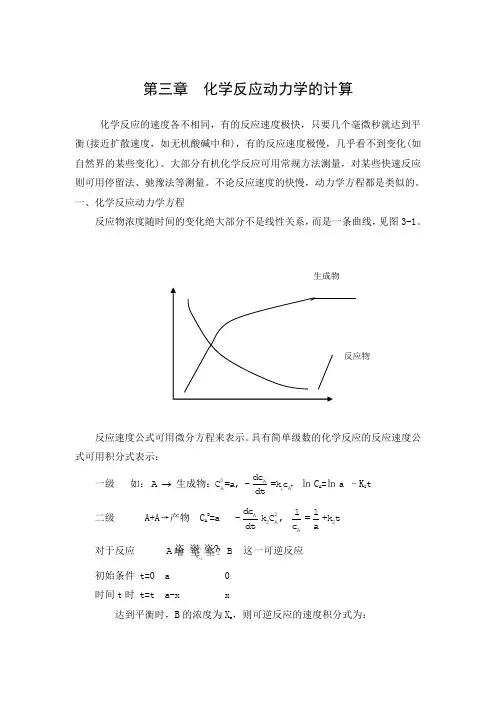
第三章 化学反应动力学的计算化学反应的速度各不相同,有的反应速度极快,只要几个毫微秒就达到平衡(接近扩散速度,如无机酸碱中和),有的反应速度极慢,几乎看不到变化(如自然界的某些变化)。
大部分有机化学反应可用常规方法测量,对某些快速反应则可用停留法、驰豫法等测量。
不论反应速度的快慢,动力学方程都是类似的。
一、化学反应动力学方程反应物浓度随时间的变化绝大部分不是线性关系,而是一条曲线,见图3-1。
反应速度公式可用微分方程来表示。
具有简单级数的化学反应的反应速度公式可用积分式表示:一级 如:0AA1Adc A C =a, -=k c dt 生成物:,㏑C A =㏑a –K 1t 二级 A+A →产物 C A 0=a 2A 2A 2A d c 11-k C , =+k t d t c a对于反应 1-1k k A B 这一可逆反应初始条件 t=0 a 0 时间t 时 t=t a-x x达到平衡时,B 的浓度为X e ,则可逆反应的速度积分式为: 级数:1-1 1-10k A A e e 1A -1B k 0e 0C =a dc x xA B=-k C +k C : =kt dt a x -xC =0ln 1-21-10Ak0A e e e B 1A -1B C k e e 0CC =a dc x ax +x(a-x )A B+C C =0=-k C +k C C : =kt dt 2a-x a(x -x)C =0ln 二、常微分方程的解化学反应动力学方程是用微分方程表示的,对于简单的反应,可直接求得微分方程的解。
微分方程:()(1)(,,,......)......(1)n n y f x y y y -'=在区间a<x<b 的解,是指()y x ϕ=,这样一个函数,在所述区间内存在导数()(),(),......()n x x x ϕϕϕ'''。
且对于区间a<x<b 内的每一个x ,等式(1)都成立。

第三章化学动力学基础一、判断题(每题1分,共10分)1. 溶液中,反应物A在t1时的浓度为c1,t2时的浓度为c2,则可以由(c1-c2)/(t1-t2)计算反应速率,当△t→0时,则为平均速率。
()2. 反应2A+2B→C,其速率方程式r = kc(A)[c(B)]2,则反应级数为3。
()3. 化学反应3A(aq)+B(aq)→2C(aq),当其速率方程式中各物质浓度均为1.0 mol∙L--1时,其反应速率系数在数值上等于其反应速率。
()4. 对零级反应来说,反应速率与反应物浓度无关。
()5. 反应aA(aq)+bB(aq)→gG(aq)的反应速率方程式为r = k[c(A)]a[c(B)]b,则此反应一定是一步完成的简单反应。
()6. 可根据反应速率系数的单位来确定反应级数。
若k的单位是mol1-n∙L n-1∙s-1,则反应级数为n。
()7. 对不同化学反应来说,活化能越大者,活化分子分数越多。
()8. 通常升高同样温度,E a较大的反应速率增大倍数较多。
()9. 一般温度升高,化学反应速率加快。
如果活化能越大,则反应速率受温度的影响也越大。
()10. 催化剂只能改变反应的活化能,不能改变反应的热效应。
()二、填空题(每空2分,共40分)1. 元反应A+B→C的反应速率方程式r =________________,其反应级数为_______。
2. 质量作用定律仅适用于________反应;反应速率系数k的单位与元反应方程式中的_____________有关。
3. 某反应的反应速率系数单位为:mol∙L-1·s-1,则该反应的反应级数为________.4. 某反应A→B+C,当A的浓度为0.20 mol·L-1时,反应速率是0.0050 mol∙L-1∙s-1,若是零级反应,反应速率系数为____________,若是一级反应,反应速率系数为_______________。


第三章化学动力学基础1. 有A气体和B气体进行反应,若将A气体浓度增加一倍,速率增加400 %,若将B气体的浓度增加一倍,速率增加200%,试写出反应式。
2. 下列生成NO2的反应:2NO +。
2 —2NO2其反应速率表示式为v 二k[NO]2[O2]如果压力增加到原来的两倍,试计算速率之变化。
3. 在抽空的刚性容器中,引入一定量纯A气体,发生如下反应:A(g)——B(g) + 2C(g)。
设反应能进行完全,经恒温到323K时,开始计时,测定体系总压随时间的变化关系如下:求该反应级数及速率常数4. 若气体混合物体积缩小到原来的1/3,下列反应的初速率变化为多少?2SO2 + O2 > 2SO3的k = 1.35 105. 在308K 时,反应N2O5© —2NO2(g) +1/2O2(g)在318K时,k = 4.98 10「5,试求这个反应的活化能?6. CH3CHO 的热分解反应是:CH3CHO(g) > CH4(g) + CO(g)在700K 时,k=0.0105,已知Ea=188.1kJ mol-二试求800K 时的k。
7. 已知HCI(g)在1atm和25C时的生成热为一88.2kJ mol",反应H2(g) + Cl 2(g) = 2HCI(g)的活化能为112.9kJ mol_1。
试计算逆反应的活化能。
8. 某一个化学反应,当温度由300K升高到310K时,反应速率增加了一倍,试求这个反应的活化能。
9. 某化学反应,在300K时,20min内反应完成了50%,在350K时,5min内反应完成了50%,计算这个反应的活化能。
10. 已知在320 C时反应SO2Cl2(g) > SO2(g)+Cl 2(g)是一级反应,速率常数为2.2 10「5S「试求:(1)10.0gSO2 Cl2分解一半需多少时间?(2)2.00gSO2Cl2经2h之后还剩多少克?39kJmo「S当人发烧到313K时,11. 在人体内,被酵母催化的某生化反应的活化能为此反应的速率常数增大到多少倍?催化剂12. ---------------------------------------------------------- 蔗糖催化水解C12H22O11+H2O* 2C6H12O6是一级反应,在25 C速率常数为5.7 10电"。

第三章化学动力学基础填空题:1、在氨合成的催化反应中,某温度下该反应的反应速率测量结果为:∆c(NH3)/∆t =2.0×10-4mol·L-1·s-1;如果以-∆c(N2)/∆t表示反应速率,其值为mol·L-1·s-1;若以-∆c(H2)/∆t表示,则为mol·L-1·s-1。
2、反应2NO(g)+Cl2(g)→2NOCl(1)在-10℃下的反应速率实验数据如下:浓度c/(mol·L-1)初始速率r(mol·L-1·min-1)NO Cl210.100.100.1820.100.200.3630.200.20 1.45推断NO的反应级数为,C12的反应级数为;-10℃下,该反应的速率系数k=。
3、对于元反应,某物种的反应级数一定等于该物种在反应方程式中的系数。
通常,反应速率系数随温度升高而,k与物种浓度,k的单位取决于。
若某反应的速率系数的单位是s-1,则该反应为级反应。
4、反应A(g)+2B(g)→C(g)的速率方程为r=kc(A)·c(B)。
该反应为级反应,k的单位是。
当只有B的浓度增加2倍时,反应速率将增大倍;当反应容器的体积增大到原来的3倍时,反应速率将倍。
5、某一级反应的半衰期T1/2=2.50h,则该反应的速率系数k=s-1;若此反应中物种A的浓度降低至初始浓度的25%,则所需时间为。
6、催化剂能加快反应速率的主要原因是反应活化能,使活化分子分数。
7、如果某反应的速率方程为:r=kc(A)[c(B)]3/2,则该反应一定元反应。
在复合反应中,中间产物的能量比相关元反应中活化络合物的能量。
8、元反应A+B→C的反应速率方程式v=____,其反应级数为__。
9、某反应的反应速率系数单位为:mol·L-1·s-1,则该反应的反应级数为___,若反应速率系数的单位为:L2·mol-2·s-1,则该反应的反应级数为___。


