如何巧记并运用 阿伏伽德罗定律的推论
- 格式:pdf
- 大小:146.27 KB
- 文档页数:1





阿伏伽德罗定律以及推论【知识整合】一、阿伏加德罗定律在相同温度和压强下,相同体积.............的任何气体都含有相同数目的分子数。
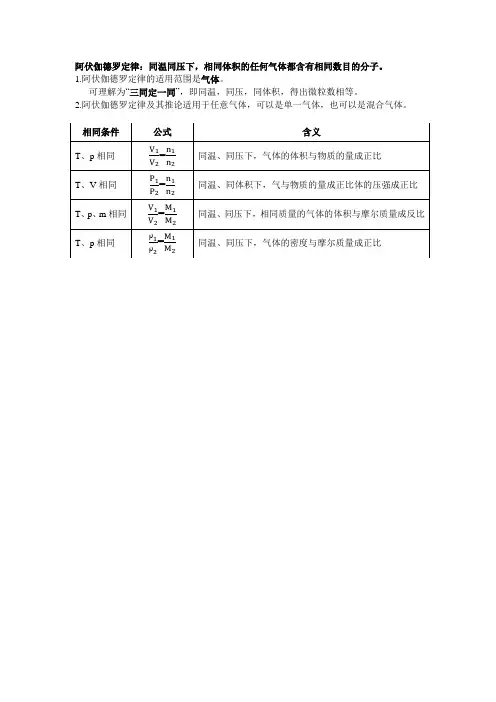
注意:在该定律中有“四同”:同温、同压、同体积、同分子数目,有“三同”就可定“一同”。
二、阿伏加德罗定律的推论根据阿伏加德罗定律及气态方程(pV =nRT )限定不同的条件,便可得到阿伏加德罗定律的多种形式, ○1T 、p 相同21N N =21V V 同温同压下,气体的分子数与其体积成正比○2T 、V 相同21p p =21N N 温度、体积相同的气体,压强与其分子数成正比○3n 、p 相同21V V =21T T 分子数相等、压强相同的气体,体积与其温度成正比○4n 、T 相同21p p =12V V 分子数相等、温度相同的气体,压强与其体积成反比○5○6○7T 、p 、m 相同21MM =12V V 同温同压下,等质量的气体相对分子质量与其体积成反比【典例分析】例1、 同温同压下,质量相等的O 2与CO 2,密度比为_______,体积比为_______;同温同压下,体积相等的O 2与CO 2,密度之比为_______,质量之比为_________。
例2、 同温同压下,某瓶充满O 2,质量为116g ,充满CO 2质量为122g ,充满气体X ,质量为114g ,则X 的相对分子质量为( )A .28B .60C .32D .44例3、体积相同的容器,一个盛有一氧化氮,另一个盛有氮气和氧气,在同温同压下两容器内的气体一定具有相同的( ) A. 原子总数 B. 质子总数 C. 分子总数 D. 质量例4、某非金属单质A 和氧气发生化合反应生成B 。
B 为气体,其体积是反应掉氧气体积的两倍(同温同压)。
以下对B 分子组成的推测一定正确的是()A. 有1个氧原子B. 有2个氧原子C. 有1个A 原子D. 有2个A 原子例5、在150℃时,(NH 4)2CO 3分解的方程式为:(NH 4)2CO 3=====△2NH 3↑+H 2O↑+CO 2↑,若完全分解,产生的气态混合物的密度是相同条件下氢气密度的( ) A .96倍 B .48倍 C .12倍 D .10倍【测评反馈】1.同温、同压下,下列有关比较等质量的二氧化硫气体和二氧化碳气体的叙述中正确的是( )A .密度比为16:11B .密度比为11:16C .体积比为1:1D .体积比为11:162.下列各组中,两种气体的分子数一定相等是( )A .温度相同、体积相同的O 2和2NB .质量相等、密度不等的2N 和42HC C .体积相等、密度相等的CO 和42H CD .压强相同、体积相同的2N 和2O3.在一定条件下,气体A 可发生如下反应:,若知所得混合气体对氢气的相对密度为4.25,则A 的相对分子质量可能为( ) A .34 B .8.5C .17 D .16 4.在一定温度和压强下,1体积2X (气)和3体积2Y (气)化合生成2体积Z (气),则Z 的分子式是( )A .3XYB .XYC .Y X 3D .32Y X5.在标准状况下,如果25.0LO 含有m 个2O 分子,则阿伏加德罗常数可表示为( ) A .m/22.4 B .44.8mC .22.4m D .m/326.在同温、同压下,有同质量的气体X 和Y 。

阿伏加德罗定律
阿伏伽德罗定律(Avogadro's Law)是化学和物理学中的一个基本定律,由意大利化学家阿伏伽德罗(Amedeo Avogadro)于1811年提出。
该定律表明,在相同的温度和压力条件下,等体积的气体中包含的分子数相等。
具体来说,阿伏伽德罗定律可以表示为:相同条件下,等
压下不同气体的体积与该气体包含的粒子数成正比。
这意
味着,如果将两种不同的气体分别放置在相同的温度和压
力下,它们的体积与其中所包含的分子数成正比关系。
阿伏伽德罗定律的数学表达式可以写为 V = k * n,其中V
代表气体的体积,n代表气体中的分子数,k为比例常数。
根据这个定律,当气体的分子数增加时,其体积也会增加,反之亦然。
阿伏伽德罗定律对于研究气体的性质和气体化学反应等方面具有重要的应用价值,为化学和物理学领域的研究提供了基础理论支持。

阿伏加德罗定律及其推论1.理想气体状态方程我们设定:T .温度;p .气体夺强;n .物质的量;V .气体的体积;m .气体的质量;M .气体的摩尔质量; .气体的密度N .气体的分子数。
理想气体状态方程为:(1)111T V p =222T V p ;(2)pV =nRT =RT Mm (R 为常数)。
对(2)若p 的单位为大气压(atm ),V 为升(L ),T 为绝对温度时,R =0.082。
若p 为帕斯卡(Pa ),V 为立方米(m 3),T 为绝对温度时,R =8.31。
2.阿伏加德罗定律在相同温度和压强下,相同体积.............的任何气体都含有相同数目的分子数。
这是意大利科学家阿伏加德罗最早提出的,因此称为“阿伏加德罗定律”。
理解时注意:在该定律中有“四同”:同温、同压、同体积、同分子数目,有“三同”就可定“一同”。
如,同温同压下,同体积的两种气体必含有相同数目的分子;同温同压下,同分子数目的两种气体必然同体积;再如,在同温下,两种气体同体积又同分子数目,则必然同压。
3.阿伏加德罗定律的推论根据阿伏加德罗定律及气态方程(pV =nRT )限定不同的条件,便可得到阿伏加德罗定律的多种形式,熟练并掌握了它们,解答有关问题时,可达到事半功倍的效果。
条件结论语言叙述T 、p 相同 21N N =21V V 同温同压下,气体的分子数与其体积成正比 T 、V 相同21p p =21N N 温度、体积相同的气体,压强与其分子数成正比 n 、p 相同21V V =21T T 分子数相等、压强相同的气体,体积与其温度成正比 n 、T 相同21p p =12V V 分子数相等、温度相同的气体,压强与其体积成反比 T 、p 、m 相同21M M =12V V 同温同压下,等质量的气体相对分子质量与其体积成反比。


热点九质量守恒定律阿伏加德罗常数及定律【必备知识规律总结】一、质量守恒定律1.内容参加化学反应的物质的质量总和等于反应后生成的物质的质量总和。
2.实质化学反应前后元素的种类和原子的个数不发生改变。
二、气体摩尔体积一定条件下,1摩尔任何气体所占的体积(V m L/mol)标准状况下,V m =22.4 L/mol三、阿伏加德罗定律1.内容在同温同压下,同体积的任何气体含有相同的分子数。
即“三同”定“一同”。
2.推论:⑴同温同压下,V1/V2=n1/n2⑵同温同体积时,p1/p2= n1/n2=N1/N2⑶同温同压等质量时,V1/V2=M2/M1⑷同温同压同体积时,W1/W2=M1/M2=ρ1/ρ2注意:(1)阿伏加德罗定律也适用于混合气体。
(2)考查气体摩尔体积时,常用在标准状况下非气态的物质来迷惑考生,如H2O、SO3、已烷、辛烷、CHCl3、乙醇等。
(3)物质结构和晶体结构:考查一定物质的量的物质中含有多少微粒(分子、原子、电子、质子、中子等)时常涉及稀有气体He、Ne等单原子分子,Cl2、N2、O2、H2双原子分子。
胶体粒子及晶体结构:P4、金刚石、石墨、二氧化硅等结构。
(4)要用到22.4L·mol-1时,必须注意气体是否处于标准状况下,否则不能用此概念;(5)某些原子或原子团在水溶液中能发生水解反应,使其数目减少;(6)注意常见的的可逆反应:如NO2中存在着NO2与N2O4的平衡;(7)不要把原子序数当成相对原子质量,也不能把相对原子质量当相对分子质量。
(8)较复杂的化学反应中,电子转移数的求算一定要细心。
如Na2O2+H2O;Cl2+NaOH;电解AgNO3溶液等。
四、阿伏加德罗常数物质的量是以阿伏加德罗常数来计量的,0.012kg碳-12所含的碳原子数就是阿伏加德罗常数(N A)。
6.02×1023是它的近似值。
注意:叙述或定义摩尔时一般用“阿伏加德罗常数”,在具体计算时常取“6.02×1023”。

阿伏伽德罗定律及其推论(总5页)-CAL-FENGHAI.-(YICAI)-Company One1-CAL-本页仅作为文档封面,使用请直接删除阿伏加德罗定律及其推论课堂学习提纲一、基础知识回顾1、物质的量与微粒个数关系式2、摩尔质量、物质的量、物质质量关系式3、气体摩尔体积定义,单位,影响气体的体积的主要因素、、。
标况下气体体积大小主要取决于标况下气体体积与物质物质的量的关系4、巩固练习:(1)在反应X+2Y﹦R+2M中,已知R和M的摩尔质量之比为22:9,当与Y完全反应后,生成,则在此反应中Y和M的质量比为()A. 16:9B. 23:9C. 32:9D. 46:9(2)碳元素的相对原子质量为12,12C原子的质量为bg,A原子的质量为ag,阿伏加德罗常数为N A,则A的相对原子质量为()A. 12a/bB. aNaC. 12b/aD. 12aN A二、阿伏加德罗定律及其推论新知识要点1、阿伏加德罗定律:在相同、相同,相同的任何气体都含有数目的分子。
阿伏加德罗定律也适用于不反应的混合气体。
2、阿伏加德罗定律推论:使用气态方程PV=nRT有助于理解推论。
理想气体状态方程:PV=nRT(P—气体的压强,单位Pa;V—气体在给定条件下的体积,单位m3;T—绝对温度,单位K;n—物质的量,单位mol;R—摩尔气体常数,数值为·mol-1·K-1)。
、n=m/M、V=m/ρ,阿伏加德罗定律有根据气态状态方程PV=nRT,结合n=N/NA多个推论,下面重点练习四个重要推论:推论1 同温同压下,两气体的体积之比等于其之比,等于其之比。
用关系式表达即T、P相同。
例1、体积相同的容器,一个盛有一氧化氮,另一个盛有氮气和氧气,在同温同压下两容器内的气体一定具有相同的()A. 原子总数B. 质子总数C. 分子总数D. 质量例2、化合物A是一种不稳定的物质,它的分子组成可用OxFy表示,10mLA气体能分解生成15mL O2和10mL F2(同温同压)。
高中化学之阿伏伽德罗定律及其推论解析
学生在做题过程中老是记不住阿弗伽德罗定律及其推论的公式,其实这些不用死记硬背,推导方法很简单。
先看看它的定义及推论。
一.定义
阿伏伽德罗定律:同温同压下,相同体积的任何气体都含有相同数目的分子。
二.推论
三.具体解析
推导过程中会用到理想气体状态方程,具体方法看下图:
1.阿弗伽德罗定律推导
2.四个推论的推导
看完了推导过程,是不是很简单。
四.注意事项
1.阿弗伽德罗定律的适用范围是气体。
可理解为“三同定一同”,即同温,同压,同体积,得出微粒数相等。
2.阿弗伽德罗定律及其推论适用于任意气体,可以是单一气体,也可以是混合气体。
最后,看一道例题吧,如下图:
解析:A项,同温度,同体积,二者压强不一定相等,则二者的分子数不一定相等,原子数也不一定相等了
B项,二者的质量相等,摩尔质量也相等,那么二者的物质的量相等。
都是双原子分子,那么原子数目一定相等
D项,同体积,同压强,但温度不一定相当,二者的物质的量不一定相等,都是三原子分子,所以原子数目也不一定相等
C项,看下图:
此题正确选项为B
解析完毕。
阿伏伽德罗定律推论推导过程
阿伏伽德罗定律是一个重要的物理定律,它描述了电路中电流和电压的关系。
它是由意大利物理学家阿伏伽德罗在1745年提出的,他发现了一个重要的定律,
即电流和电压之间的关系,这就是阿伏伽德罗定律。
阿伏伽德罗定律可以用一个简单的公式来表示:I=V/R,其中I表示电流,V
表示电压,R表示电阻。
这个公式表明,电流是电压除以电阻的结果。
阿伏伽德罗定律的推导过程是这样的:首先,我们假设一个电路,其中有一个
电池和一个电阻。
电池可以产生电压,而电阻可以阻止电流的流动。
电池产生的电压可以通过电阻,从而产生电流。
接下来,我们可以用一个简单的公式来表示电流和电压之间的关系:I=V/R,
其中I表示电流,V表示电压,R表示电阻。
这个公式表明,电流是电压除以电阻
的结果。
最后,我们可以得出结论:电流和电压之间的关系可以用阿伏伽德罗定律来表示:I=V/R,其中I表示电流,V表示电压,R表示电阻。
总之,阿伏伽德罗定律是一个重要的物理定律,它描述了电路中电流和电压之
间的关系,可以用一个简单的公式来表示:I=V/R,其中I表示电流,V表示电压,R表示电阻。
它的推导过程是假设一个电路,其中有一个电池和一个电阻,电池产
生的电压可以通过电阻,从而产生电流,最后得出结论:电流和电压之间的关系可以用阿伏伽德罗定律来表示。
阿伏伽德罗常数定律公式阿伏伽德罗常数,又称阿伏伽德罗数,是指在一个摩尔物质中,粒子的数量与摩尔数的比值。
它是化学中一个非常重要的常数,常用于计算化学反应中的物质的量。
阿伏伽德罗常数的数值为6.022×10²³,这个数值的大小是惊人的,它意味着一个摩尔物质中含有6.022×10²³个粒子。
阿伏伽德罗常数的定律公式是N=NA×n,其中N表示粒子的数量,NA表示阿伏伽德罗常数,n表示摩尔数。
这个公式的意义是,一个摩尔物质中的粒子数量等于阿伏伽德罗常数乘以摩尔数。
这个公式的应用非常广泛,不仅在化学中,还在物理、生物等领域中得到了广泛的应用。
阿伏伽德罗常数的发现是一个非常有趣的故事。
19世纪初,意大利化学家阿伏伽德罗在研究气体的化学反应时,发现气体的体积与温度、压力、摩尔数等因素有关。
他通过实验发现,当气体的温度和压力不变时,气体的体积与摩尔数成正比。
这个发现被称为阿伏伽德罗定律。
阿伏伽德罗定律的发现,为化学研究提供了重要的理论基础。
在此基础上,阿伏伽德罗提出了阿伏伽德罗常数的概念。
他认为,在一个摩尔物质中,粒子的数量应该是一个固定的值,这个值就是阿伏伽德罗常数。
这个理论得到了实验的验证,阿伏伽德罗常数也因此得以确立。
阿伏伽德罗常数的应用非常广泛。
在化学反应中,我们常常需要计算物质的量,这时就需要用到阿伏伽德罗常数。
例如,我们可以通过阿伏伽德罗常数计算出一摩尔氧气中含有多少个氧分子,或者计算出一摩尔盐酸中含有多少个盐酸分子。
这些计算对于化学实验和工业生产都非常重要。
除了在化学中的应用,阿伏伽德罗常数还在其他领域中得到了广泛的应用。
在物理学中,它被用来计算原子和分子的质量。
在生物学中,它被用来计算细胞和分子的数量。
阿伏伽德罗常数的应用范围非常广泛,它是现代科学中不可或缺的一部分。
总之,阿伏伽德罗常数是化学中一个非常重要的常数,它的发现和应用对化学、物理、生物等领域的发展都产生了重要的影响。
阿伏伽德罗的公式阿伏伽德罗的公式,这可是化学世界里的一个重要宝贝!咱们先来说说阿伏伽德罗常量,它约等于 6.02×10²³个/摩尔。
这个常量就像是化学世界中的一把神奇的尺子,能帮助我们量出物质的微粒数量。
比如说,在咱们的日常生活中,你喝的一杯水,里面的水分子数量那可多到超乎想象。
要是没有阿伏伽德罗的公式,要想知道这杯水里到底有多少水分子,简直就是天方夜谭。
我记得有一次,在化学课上,老师给我们做了一个实验。
那是一个关于气体体积和物质的量关系的实验。
老师把一些氢气装进一个气球里,然后通过一系列的操作和计算,给我们展示了如何运用阿伏伽德罗的公式来得出氢气的物质的量。
当时我就觉得,这个公式简直太神奇了!就这么一个简单的数字和公式,居然能让我们弄清楚那些看不见摸不着的微粒的数量和关系。
再说说阿伏伽德罗定律,同温同压下,相同体积的任何气体都含有相同数目的分子。
这就好比是一群小朋友在操场上排队,不管是男生队还是女生队,只要队伍的长度一样,人数也就一样多。
咱们来做个小计算。
假设在一个标准状况下,有一升氧气,通过阿伏伽德罗的公式,我们就能算出里面氧气分子的数量。
然后再对比同样体积的氮气,也能算出氮气分子的数量。
是不是感觉特别神奇?而且阿伏伽德罗的公式在化学的很多领域都大有用处。
比如在化学反应中,通过这个公式,我们可以知道参与反应的各种物质的微粒数量比例,从而更好地理解和控制化学反应。
在工业生产中,阿伏伽德罗的公式也发挥着重要作用。
就拿制造化肥来说吧,要知道需要多少原料才能生产出特定数量的化肥产品,就得靠这个公式来帮忙计算。
总之,阿伏伽德罗的公式虽然看起来有点复杂,但它就像是一把万能钥匙,能打开化学世界中许多神秘的大门,让我们更深入地了解物质的本质和变化。
所以呀,同学们可得好好掌握这个神奇的公式,说不定以后就能用它来解决很多实际的问题,创造出更多有趣的化学奇迹呢!。