1、求生成物的分子式
例题1、在一定温度和压强下,1体积X2(气)跟3 体积Y2(气)化合生成2体积气态化合物A,则化合 物A的化学式是(A )
A、XY3 B、XY 分析:
C、X3Y D、X2Y3
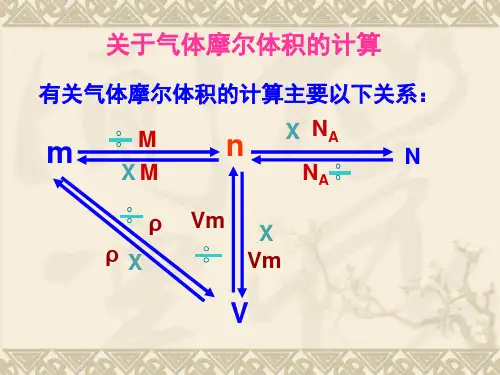
(1)由阿伏加德罗定律的推论:同温、同压下, V1/V2=n1/n2,得:
n(X2): n(Y2): n(A) = 1: 3 :2 (2)由物质的量之比=化学方程式各物质前的系数比, 反应的化学方程式可表示为:X2+3Y2=2A。
4、结合化学方程式的计算
例题4、在一定体积的密闭容器中放入3L气体R和气5L气体Q, 在一定条件下发生反应:2R(g)+5Q(g)=4X(g)+n y(g)。 反应完全后,容器温度不变,混合气体的压强是原来的87.5%, 则化学方程式中的n值是( A )。 A、2 B、3 C、4 D、5
巧解分解法析:一::因由可反题假应意设完:充成反入后应3m,前o压后l气强体体变积R小不和,变5m故、ol该温气反度体应不Q,是变由气,反体则应分可方子由程数推式减论:
(1)若反应前后气体的总物质的量不变,则反应前后体系 压强不变。如: H2+C l2 =2HCl(点燃),则n1=n2,有P1=P2
(2)若为气体物质的量减少的化学反应,则反应后体系压 强减小。如: 2CO+O2=2CO2(点燃)则n2<n1,有P2<P1
(3)若为气体物质的量增加的化学反应,则反应后体系压 强增加。如:2C(S)+O2(g)=2CO2(g)(点燃)则n2>n1, 有P2>P1
17 、人生需要时时提醒,责任需要时时敲打。 9 、祸兮福之所倚,福兮祸之所伏。孰知其极?其无正也。正复为奇,善复为妖。人之迷,其日固久。 1 、想急于得到所需的东西,一时冲动,草率行事,就会身遭不幸。遇事时要多动脑,多思考,才能成功。 16 、如果青春是醺人欲醉的海风,那么自信就是这和风前行的路标;如果青春是巍峨入云的高耸,那么拼搏就是这山脉层层拔高的动力;如果青春是高歌奋进的谱曲,那么坚强就是这旋律奏响的最 强音! 16 、有希望就会有动力,只要坚持不懈,黑暗过去,迎接的就是无限光明。 2 、有时费尽唇舌,争执一个不易化解的问题,还不如来一个简单的行动容易。这样的话,你就能化解敌人的攻势于无形。 9 、有时,成功就在我们眼前,但却被我们所忽略,以致最终地丧失。把握眼前,坚持做好每件事,那么,成功将会离我们越来越近。 5 、乐观,是达到成功之路的信心;不怀希望,不论什么事情都做不出来。 1 、人生,就要闯出一条路来!为了事业,为了奋斗的人生,尽管失去许多,但有失必有得!而得到的往往会比失去的更重要,它是人生的价值与意义。 14 、人生就是生活的过程。哪能没有风、没有雨?正是因为有了风雨的洗礼才能看见斑斓的彩虹;有了失败的痛苦才会尝到成功的喜悦。 7 、只有你的未来,才能挥霍我的现在;只有我的最爱,给我最致命的伤害。