生物化学第四章
- 格式:pptx
- 大小:4.24 MB
- 文档页数:74


一一一氨基酸及其重要衍生物的生物合成下册P340 31章§4.1 概论不同生物合成氨基酸的能力不同,合成氨基酸的种类也有很大差异。
必需氨基酸:肌体维持正常生长所必需而又不能自己合成,需从外界获取的氨基酸。
人和大白鼠需以下十种氨基酸(由大白鼠喂饲试验得来):Phe、Lys、Ile、Leu 、Met、Thr、Trp、Val、(His、Arg)。
对于成人为前八种,对幼小动物为十种。
非必需氨基酸:肌体可以通过其他原料自己合成的氨基酸。
高等植物可以合成自己所需全部氨基酸。
微生物合成氨基酸能力有很大差距。
E.coli可合成全部所需氨基酸,乳酸菌则不能合成全部。
§4.2 氨基酸生物合成途径:可用为生物遗传突变株研究。
使突变株在氨基酸的某个合成环节上产生缺失,造成某种中间物积累,从而判明各个中间代谢环节,由此已阐明20种氨基酸的生物合成途径。
在生物合成中,氨基酸的氨基多来自Glu的转氨基反应,而各种碳骨架起源于TCA、糖酵解等代谢途径,由此划分为若干类型。
根据生物合成起始物的不同,可将氨基酸生物合成途径归纳为六族。
P341 图31-1为氨基酸生物合成的分族情况:①谷氨酸族②天冬氨酸族③丝氨酸族④丙氨酸族⑤芳香氨基酸族⑥组氨酸。
P341图31-2为20种氨基酸生物合成概貌。
一一一谷氨酸族氨基酸的生物合成:均以α-酮戊二酸为前提。
α-酮戊二酸形成Glu后可生成Gln、Pro和Arg(P344,P345 图31-6,P346 图31-7);在真菌中还可生成Lys(P347图31-8)。
一一一天冬氨酸族氨基酸的生物合成:草酰乙酸生成Asp后可生成Asn,经天冬氨酸β-半醛可生成Lys(P349图31-9),再经高丝氨酸可生成Thr,进一步生成Ile,还可生成Met(P350图31-10,P351 图31-11,图31-12)。
一一一丙氨酸族氨基酸的生物合成:丙酮酸可直接生成Ala,经α-酮异戊酸可生成Val和Leu(P352 图31-13,P353 图31-15)。

第四章蛋白质的三维结构稳定蛋白质三维结构的作用力一、多肽主链折叠的空间限制从理论上讲,一个多肽主链能有无限多种构象。
从理论上讲个多肽主链能有无限多种构象但是,只有一种或很少几种天然构象,且相当稳定。
但是只有种或很少几种天然构象且相当稳定因为:天然蛋白质主链上的单键并不能自由旋转1、肽链的二面角★只有α碳原子连接的两个键(C α—N 和C α-C )是单键,能自由旋转。
★扭角:环绕C α—N 键旋转的角度为Φ,环绕C α—C 键旋转的角度称Ψ。
可旋转±180度,一般呈顺时针旋转。
旋转受H.O 基的限制多肽主链的构象可以用每个C 的对原子以及R 基的限制。
多肽主链的构象可以用每个a-C 的一对扭角来描述。
★当Φ(Ψ)旋转键两侧的主链呈顺式时,规定Φ(Ψ)=0°★从Cα沿键轴方向看,顺时针旋转的Φ(Ψ)角为正值,反之为负值。
2、拉氏构象图:可允许的Φ和Ψ值Φ和Ψ同时为0的构象实际不存在二面角(Φ、Ψ)所决定的构象能否存在,主要取决于两个相邻肽单位中非键合原子间的接近有无阻碍。
个相邻肽单位中非键合原间的接有Cα上的R基的大小与带电性影响Φ和Ψ◆拉氏构象图:Ramachandran根据蛋白质中非键合原子间的最小接触距离(范德华距离),确定了哪些成对二面角(Φ、Ψ)所规定的两个相邻肽单位的构象是允许的,哪些是不允许的,并且以Φ为横坐标,以Ψ为纵坐标,在坐标图上标出,该坐坐标以为纵坐标在坐标图上标出该坐标图称拉氏构象图。
⑴实线封闭区域一般允许区,非键合原子间的距离大于一般允许距离,此区域内任何二面角确定的构象都是允许的,且构象稳定。
的且构象稳定⑵虚线封闭区域是最大允许区,非键合原子间的距离介于最小允许距离和般允许距离之间,立体化学允许,但许距离和一般允许距离之间,立体化学允许,但构象不够稳定。
⑶虚线外区域是不允许区,该区域内任何二面角确定的肽链构象,都是不允许的,此构象中非键合原子间距离象都是不允许的此构象中非键合原子间距离小于最小允许距离,斥力大,构象极不稳定。

+第四章生物氧化【目的和要求】1.掌握生物氧化、氧化磷酸化的概念。
2.掌握线粒体呼吸链的组成、排列顺序、种类。
3.掌握氧化磷酸化的偶联部位,胞液中NADH的氧化,二条穿梭途径。
4.熟悉氧化磷酸化的基本过程、影响因素及其调节,P/O,ATP的生成和利用。
5.了解生物氧化的特点及方式,氧化磷酸化偶联机理,其他氧化体系。
【本章重难点】1.呼吸链组成、脱氢部位及产能部位,偶联机制。
2.氧化磷酸化概念,影响因素。
3.二种穿梭作用。
4.呼吸链组成、脱氢部位及产能部位。
5.氧化磷酸化偶联机制。
学习内容第一节概述第二节生成ATP的氧化体系第三节其他氧化体系第一节概述一、概述⒈生物氧化的概念生物氧化(Biological Oxidation)物质在生物体内氧化分解的过程称为生物氧化,主要是指糖、脂肪、蛋白质等有机物在生物体内分解时逐步释放能量,最终生成CO2和H2O的过程。
生物氧化的主要生理意义是为生物体提供能量.⒉生物氧化的过程⒊生物氧化的特点⑴相同点:体内氧化与体外氧化① 物质氧化方式:加氧、脱氢、失电子.②物质氧化时消耗的氧量、得到的产物和能量相同。
⑵不同点 :体内氧化 体外氧化 ①反应条件: 温和 剧烈 ②反应过程:分步反应,能量逐步释放 一步反应,能量突然释放 ③产物生成: 间接生成 直接生成 ④能量形式: 热能、ATP 热能、光能第二节 生成ATP 的氧化体系一、呼吸链 (Respiratory Chain)⒈呼吸链(respiratory chain ):一系列酶和辅酶按照一定的顺序排列在线粒体内膜上,可以将代谢物脱下的氢(H ++e )逐步传递给氧生成水同时释放能量,由于此过程与细胞摄取氧的呼吸过程有关,所以这一传递链称为呼吸链。
多糖 脂肪 蛋白质葡萄糖 甘油+脂肪酸 氨基酸HC O 2T A C乙酰C o AO 2H 2O能量⒉呼吸链的组成用胆酸、脱氧胆酸等反复处理线粒体内膜,可将呼吸链分离得到四种仍具有传递电子功能的酶的复合体。




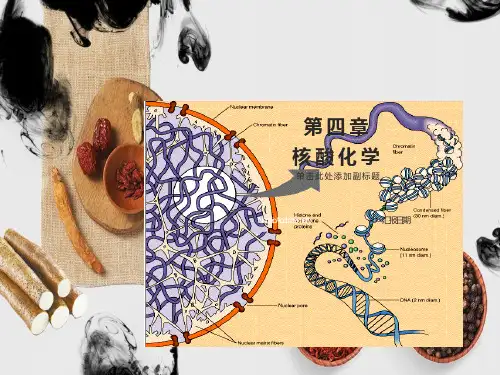


第四章核酸化学第一节导言一、核酸分类和分布脱氧核糖核酸(deoxyribonucleic acid, DNA):遗传信息的贮存和携带者,生物的主要遗传物质。
在真核细胞中,DNA主要集中在细胞核内,线粒体和叶绿体中均有各自的DNA。
原核细胞没有明显的细胞核结构,DNA存在于称为类核的结构区。
每个原核细胞只有一个染色体,每个染色体含一个双链环状DNA。
核糖核酸(ribonucleic acid, RNA):主要参与遗传信息的传递和表达过程,细胞内的RNA主要存在于细胞质中,少量存在于细胞核中,病毒中RNA本身就是遗传信息的储存者。
另外在植物中还发现了一类比病毒还小得多的侵染性致病因子称为类病毒,它是不含蛋白质的游离的RNA 分子,还发现有些RNA具生物催化作用(ribozyme)。
细胞核RNA1、mRNA与hnRNAmRNA约占细胞RNA总量的5%,是蛋白质合成的模板。
真核生物mRNA的前体在核内合成,包括整个基因的内含子和外显子的转录产物,形成分子大小极不均匀的hnRNA。
2、snRNAsnRNA主要存于细胞核中,占细胞RNA总量的0.1~1%,与蛋白质以RNP(核糖核酸蛋白)的形式存在,在hnRNA和rRNA的加工、细胞分裂和分化、协助细胞内物质运输、构成染色质等方面有重要作用。
7二、核酸研究简史1869年Miescher博士论文工作中测定淋巴细胞蛋白质组成时, 发现了不溶于稀酸和盐溶液的沉淀物, 并在所有细胞的核里都找到了此物质, 故命名核质(Nuclein)。
1879年Kossel经过10年的努力, 搞清楚核质中有四种不同的组成部分: A,T, C和G。
1889年Altman建议将核质改名为“核酸”, 并且已经认识到“核质” 乃“核酸” 与蛋白质的复合体。
1909年Levene发现酵母的核酸含有核糖。
1930年Levene发现动物细胞的核酸含有一种特殊的核糖即脱氧核糖, 得出了一个错误概念: 植物核酸含核糖,动物核酸含脱氧核糖。
⽣物化学第四章酶第四章酶酶是⼀类具有⾼效率、⾼度专⼀性、活性可调节的⾼分⼦⽣物催化剂。
1957巴斯德提出酒精发酵是酵母细胞活动的结果。
1 分⼦Glc→2分⼦⼄醇+2分⼦CO2 从Glc开始,经过12种酶催化,12步反应,⽣成⼄醇。
1897 Buchner兄弟证明发酵与细胞的活动⽆关,不含细胞的酵母汁也能进⾏⼄醇发酵。
1913 Michaelis和Menten提出⽶⽒学说—酶促动⼒学原理。
1926 Sumner⾸次从⼑⾖中提出脲酶结晶,并证明具有蛋⽩质性质。
1969 化学合成核糖核酸酶。
1967-1970 从E.coli中发现第I、第II类限制性核酸内切酶。
1986 Cech发现四膜⾍细胞⼤核期间26S rRNA前体具有⾃我剪接功能。
ribozyme ,deoxyribozymeE.coRI5’——GAA TTC——3’3’——CTTAAG——5’限制作⽤修饰作⽤5’——GAATTC——3’5’——GAATTC——3’3’——CTTAAG——5’ 3’——CTTAAG——5’第⼀节酶学概论⼀、酶的⽣物学意义⼤肠杆菌⽣命周期20分钟,⽣物体内化学反应变得容易和迅速进⾏的根本原因是体内普通存在⽣物催化剂—酶。
没有酶,⽣长、发育、运动等等⽣命活动就⽆法继续。
限制性核酸内切酶(限制-修饰)⼆、酶的概念及其作⽤特点1、酶是⼀种⽣物催化剂酶是⼀类具有⾼效率、⾼度专⼀性、活性可调节的⾼分⼦⽣物催化剂。
⽣物催化剂:酶(enzyme),核(糖)酶(ribozyme),脱氧核(糖)酶(deoxyribozyme)2、酶催化反应的特点(1)、催化效率⾼酶催化反应速度是相应的⽆催化反应的108-1020倍,并且⾄少⾼出⾮酶催化反应速度⼏个数量级。
(2)、专⼀性⾼酶对反应的底物和产物都有极⾼的专⼀性,⼏乎没有副反应发⽣。
(3)、反应条件温和(4)、活性可调节根据据⽣物体的需要,许多酶的活性可受多种调节机制的灵活调节,包括:别构调节、酶的共价修饰、酶的合成、活化与降解等。
Enzyme磨粉去糠打碎酶的应用比酶的研究具有更长的历史成酒发酵装瓶DiscoveringE n z y m e (1991) p .22麦芽萌发浸润Sumner 对酵素的发现有重大贡献温度时间进行酶反应的试管SumnerUrease crystal(1926)D i s c o v e r i n g E n z y m e (1991) p .82(2)专一性高酶对反应的底物和产物都有极高的专一性,几乎没有副反应发生。
(3)反应条件温和(易失活)常温、常压,中性pH环境。
(4)活性可调节别构调节、酶的共价修饰、酶的合成、活化与降解等。
(5)酶的催化活性需要辅酶、辅基、金属离子二、酶的化学本质及其组成(一)酶的化学本质z绝大多数酶是蛋白质证据(1)酸水解的产物是氨基酸,能被蛋白酶水解失活;(2)具有蛋白质的一切共性,凡是能使蛋白质变性的因素都能使酶变性;(具有蛋白质的颜色反应)。
z少数酶是RNA(核酶)(二)酶的化学组成酶是一类具有催化功能的蛋白质。
酶的分类:单纯酶类(simple enzyme):仅由蛋白质组成。
脲酶、溶菌酶、淀粉酶、脂肪酶、核糖核酸酶等复(缀)合酶类(conjugated enzyme):复合酶=蛋白质+非蛋白质成分全酶=酶蛋白(脱辅酶)+辅酶(酶因子):超氧化物歧化酶(Cu2+、Zn2+)、乳酸脱氢酶(NAD+)NADH bindingdomain Substrate bindingdomainNADHGly-3-PKleinsmith& Kish (1995) Principles of Cell and Molecular Biology (2e) p.25Glyceraldehyde-3-phosphatedehydrogenase系统命名系统名应包括底物名称,反应性质以及反应名称,最后加“酶”字。
若作用的底物有两种,则须同时列出,并用":"将其隔开;若作用物之一为水,则可略去.底物的名称必须确切,L,D型及a,b型均应列出.1.氧化还原酶类:催化氧化还原反应通式:AH2+B→BH2+A其中:A为质子供体,B为质子受体如:乳酸脱氢酶催化的反应:乳酸+NAD+→丙酮酸+NADH22.转移酶类:催化底物之间基团的转移反应.通式:AR+B→BR+A其中:R为转移基团,R不为2H如:己糖激酶、转氨酶、脂酰转移酶、糖基转移酶等3.水解酶类:催化底物的水解反应通式:AB+HO→AH+BOH2如:淀粉酶,脂肪酶,蛋白质酶等4.裂合酶类:催化底物裂解或缩合反应(可逆),通式:AB→A+B如:醛缩酶,水合酶,脱氨酶等。