生物化学 第四章 酶
- 格式:docx
- 大小:25.38 KB
- 文档页数:3








第四章酶Enzymes本章主要内容(9学时)一.酶的概念(重点)二.维生素与辅酶(重点)三.酶促反应动力学(重点)四.酶的结构和催化作用机制(重点)五.酶的调控(重点)六.人工酶与酶工程(自学为主)一、酶的概念⏹生物机体的一切生理活动,都是由无数复杂的化学变化(反应)来实现的。
⏹生物体内进行的所有这些化学变化都在酶的催化下进行的。
⏹Much of the history of biochemistry is the history of enzyme research.一、酶的概念⏹In the late 1700s, biological catalysis was first recognized.⏹1897年,E. Büchner,首次从酵母细胞中提取出酶,实现无细胞生醇发酵。
一、酶的概念⏹1926年,James Sumner,结晶出第一个蛋白酶---脲酶。
⏹pepsin, trypsin, andother digestive enzymesAll enzymes are proteins.一、酶的概念⏹J. B. S. Haldane⏹A paper entitled “Enzymes”.weak bonding interactions between an enzyme and its substrate might be used to catalyze a reaction.一、酶的概念⏹1989年,推翻“酶都是蛋白质”这一传统概念。
⏹In 1982,Thomas Cech,RNA spliced itselfaccurately without anyprotein enzymes fromTetrahymena(四膜虫).Most Enzymes Are Proteins.一、酶的概念酶是生物催化剂⏹生物催化剂(Biocatalysts):活细胞产生的一类具有催化功能的生物分子。

第四章酶选择题1.以下是影响酶促反应初速度的因素,例外的是:A[S]B[E]C[pH]D时间E温度2.下列有关LDH同工酶的叙述哪个是正确的?A由不同亚基组成的寡聚体B对同一底物具有不同专一性C对同一底物具有相同的Km值D电泳迁移率往往相同E结构相同来源不同3.酶分子在催化反应时,具有下列哪一种能量效应?A增高反应活化能B降低反应活化能C产物能量水平D产物能量水平E反应自由能4.下列哪一项不是辅酶的功能?A转移基团B传递氢C传递电子D某些物质分解代谢时的载体E决定酶的专一性5.酶共价修饰调节的主要方式是A甲基化与去甲基B乙酰化与去乙酰基C磷酸化与去磷酸D聚合与解聚E酶蛋白的合成与降解6.丙二酸对琥珀酸脱氢酶的影响是属于:A产物反馈抑制B产物阻遏抑制C非竞争性抑制D竞争性抑制E不可逆抑制7.酶的活性中心是指:A酶分子上的几个必需基团B酶分子与底物结合的部位C酶分子结合底物并发挥催化作用的关键性三维结构区D酶分子中心部位的一种特殊结构E酶分子催化底物变成产物的部位8.酶原激活的生理意义是:A加速代谢B恢复酶活性C促进生长D避免自身损伤E保护酶的活性9.测定酶活性时要测定酶促反应的初速度,其目的是为了:A为了节约底物B为了使酶促反应速度与酶浓度成正比C为了尽快完成测定工作D为了防止出现底物抑制E为了使反应不受温度的影响10.米氏方程的意义是能很好地解释:A多酶体系反应过程的动力学过程B多底物酶促反应过程的动力学过程C单底物单产物酶促反应的动力学过程D非酶促简单化学反应的动力学过程E别构酶的酶促反应的动力学过程名词解释:1全酶2辅酶3底物4酶的活性中心5必需基团6酶原激活7活化能8Km9竞争性抑制作用10关键酶问答题1什么是酶?酶的化学本质是什么?2试述酶促反应的特点。
3试述影响酶促反应速度的因素?4当一酶促反应的速度为Vmax的80%时,Km=1.5mmol/L,求[S]?5二异丙基氟磷酸(DIFP)能使酶失活,它作用于酶活性中心的什么基团?为什么解磷定可以恢复酶的活力?6酶在的三种可逆性抑制剂作用下V、Km分别有什么变化?7什么是酶的变构调节,试述酶变构调节的特点。
⽣物化学第四章酶第四章酶酶是⼀类具有⾼效率、⾼度专⼀性、活性可调节的⾼分⼦⽣物催化剂。
1957巴斯德提出酒精发酵是酵母细胞活动的结果。
1 分⼦Glc→2分⼦⼄醇+2分⼦CO2 从Glc开始,经过12种酶催化,12步反应,⽣成⼄醇。
1897 Buchner兄弟证明发酵与细胞的活动⽆关,不含细胞的酵母汁也能进⾏⼄醇发酵。
1913 Michaelis和Menten提出⽶⽒学说—酶促动⼒学原理。
1926 Sumner⾸次从⼑⾖中提出脲酶结晶,并证明具有蛋⽩质性质。
1969 化学合成核糖核酸酶。
1967-1970 从E.coli中发现第I、第II类限制性核酸内切酶。
1986 Cech发现四膜⾍细胞⼤核期间26S rRNA前体具有⾃我剪接功能。
ribozyme ,deoxyribozymeE.coRI5’——GAA TTC——3’3’——CTTAAG——5’限制作⽤修饰作⽤5’——GAATTC——3’5’——GAATTC——3’3’——CTTAAG——5’ 3’——CTTAAG——5’第⼀节酶学概论⼀、酶的⽣物学意义⼤肠杆菌⽣命周期20分钟,⽣物体内化学反应变得容易和迅速进⾏的根本原因是体内普通存在⽣物催化剂—酶。
没有酶,⽣长、发育、运动等等⽣命活动就⽆法继续。
限制性核酸内切酶(限制-修饰)⼆、酶的概念及其作⽤特点1、酶是⼀种⽣物催化剂酶是⼀类具有⾼效率、⾼度专⼀性、活性可调节的⾼分⼦⽣物催化剂。
⽣物催化剂:酶(enzyme),核(糖)酶(ribozyme),脱氧核(糖)酶(deoxyribozyme)2、酶催化反应的特点(1)、催化效率⾼酶催化反应速度是相应的⽆催化反应的108-1020倍,并且⾄少⾼出⾮酶催化反应速度⼏个数量级。
(2)、专⼀性⾼酶对反应的底物和产物都有极⾼的专⼀性,⼏乎没有副反应发⽣。
(3)、反应条件温和(4)、活性可调节根据据⽣物体的需要,许多酶的活性可受多种调节机制的灵活调节,包括:别构调节、酶的共价修饰、酶的合成、活化与降解等。
第四章酶1.米氏方程的推导中假设______。
A.V与[ES]成正比B.[S]约等于[E] C.由于反应可逆,有些产物被转变为底物D.[S]》[E] E.以上都不对2.如果要求酶促反应V=Vmax×90%,则[S]应为Km的倍数是______。
A.4.5 B.9 C.8 D.5 E.90 3.关于酶的抑制剂的叙述正确的是______。
A.酶的抑制剂中一部分是酶的变性剂B.酶的抑制剂只与活性中心上的基团结合C.酶的抑制剂均能使反应速度下降D.酶的抑制剂一般是大分子物质E.酶的抑制剂都能竞争性地使酶的活性降低4.酶催化底物反应时,将产生下列哪一种能量效应?______ A.提高反应所需的活化能B.降低反应所需的活化能C.降低反应的能量水平D.提高产物的能量水平6.关于米氏常数Km的说法。
哪个是正确的?_______ A.饱和底物浓度时的速度B.在一定酶浓度下,最大速度的一半C.饱和底物浓度的一半D.速度达最大速度半数时的底物浓度E.降低一半速度时的抑制剂浓度9.酶的纯粹竞争性抑制剂具有下列哪种动力学效应?_______ A.Vmax不变,km增大B.Vmax不变,km减小C.Vmax增大,km不变D.Vmax减小,km不变E.Vmax和km,都不变10.丙二酸对琥珀酸脱氢酶的影响是属于______。
A.产物反馈抑制B.产物阻遏抑制C.非竞争性抑制D.竞争性抑制E.不可逆抑制11.对于一个符合米氏方程的酶来说,对于一个符合米氏方程的酶来说,当当[S]=Km,[I]=KI时,I为竞争抑制剂,则V为。
A.Vmax×2/3 B.Vmax×1/3 C.Vmax×1/2 .存在 抑制剂时酶促反应速度达到最大反应速度一半时的底物浓度不.存在22.乳酸脱氢酶是两种肽链的四聚体,让两种肽链随意组合形成该酶,可能.乳酸脱氢酶是两种肽链的四聚体,让两种肽链随意组合形成该酶,可能 构成几种同工酶?______ A .2 B .3 C .4 D .5 23.关于酶促反应的叙述正确的是_______。
第 4 章酶单元自测题(一)名词解释或概念比较1.活化能,2.转换数,3.酶的专一性,4.反馈抑制,5.多酶复合体,6.绝对专一性,7.核酶,8.抗体酶,9.固定化酶,10.乒乓反应,11.可逆抑制作用与不可逆抑制作用,12.酶的活性中心,13.邻近效应与定向效应,14.同工酶,15.蛋白激酶与蛋白磷酸酶,16.趋异进化与趋同进化,17.脱辅酶(脱辅基酶蛋白),18.酶原,19.丝氨酸蛋白酶,20.竞争性抑制作用,21.非竞争性抑制作用,22.反竞争性抑制作用,23.酶促反应初速度,24.前馈调节,25.化学酶工程与生物酶工程,26.过渡态底物类似物(一)名词解释或概念比较1.在一定的温度下将 1 摩尔底物全部转化成活化态所需要的自由能,单位是 kJ/mol。
2.在一定条件下每秒钟每个酶分子催化底物的分子数,或每秒钟每微摩尔酶分子催化底物的微摩尔数。
3.酶对底物有严格的选择性,酶往往只能催化一种或一类反应,作用于一种或一类化合物。
4.在酶催化的级联反应中,催化第一步反应的酶往往被级联反应的终端产物抑制,或催化前一步反应的酶被后面的产物抑制,这种抑制叫反馈抑制。
5.几种功能相关的酶依靠非共价键形成复合体,通常催化一个级联反应或一部分,可以提高催化效率。
6.酶只作用于一种底物,而不作用于其它任何底物,这种专一性称为绝对专一性。
7.具有催化功能的 RNA。
8.具有抗体的识别、结合专一性,又具有催化功能的蛋白质,或称有催化活性的抗体。
抗体酶的本质是是免疫球蛋白,但是在易变区具有酶的性质。
9.将水溶性的酶用物理或化学的方法处理,使之不溶于水,但不改变原有的酶活性。
固定化酶提高了对酸碱和温度的稳定性,增加了酶的使用寿命。
10.是一种多底物酶促反应。
底物 A 先与酶结合,催化生成产物 P,当产物 P 释放以后,底物 B 再与酶结合,催化生成产物催化生成产物 Q,最后释放产物 Q。
11.可逆抑制作用:抑制剂与酶以非共价键结合而引起活力降低或丧失,可以用物理方法(例如透折法)除去抑制剂,恢复酶的活性。
第四节酶的调节2015-07-06 71620 0细胞内许多酶的活性是可以调节的。
通过适当的调节,有些酶可在有活性和无活性、或者高活性和低活性两种状态之间转变。
此外,某些酶在细胞内的量可以发生改变,从而改变酶在细胞内的总活性。
细胞根据内外环境的变化而调整细胞内代谢时,都是通过对关键酶的活性进行调节而实现的。
一、酶活性的调节是对酶促反应速率的快速调节细胞对现有酶活性的调节包括酶的别构调节和酶促化学修饰调节,它们属于对酶促反应速率的快速调节。
(一)别构效应剂通过改变酶的构象而调节酶活性体内一些代谢物可与某些酶的活性中心外的某个部位非共价可逆结合,引起酶的构象改变,从而改变酶的活性,酶的这种调节方式称为酶的别构调节(allosteric regulation),也称为变构调节。
受别构调节的酶称为别构酶( allosteric enzyme),引起别构效应的物质称为别构效应剂(allosteric effector)。
酶分子与别构效应剂结合的部位称为别构部位( allosteric site)或调节部位( regulatory site)。
有些酶的调节部位与催化部位存在于同一亚基;有的则分别存在于不同的亚基,从而有催化亚基和调节亚基之分。
根据别构效应剂对别构酶的调节效果,有别构激活剂( allosteric activator)和别构抑制剂( allosteric inhibitor)之分。
别构效应剂可以是代谢途径的终产物、中间产物、酶的底物或其他物质。
别构酶分子中常含有多个(偶数)亚基,具有多亚基的别构酶也与血红蛋白一样,存在着协同效应,包括正协同效应和负协同效应。
如果效应剂与酶的一个亚基结合,此亚基的别构效应使相邻亚基也发生别构,并增加对此效应剂的亲和力,这种协同效应称为正协同效应;如果后续亚基的别构降低对此效应剂的亲和力,则称为负协同效应。
如果效应剂是底物本身,正协同效应的底物浓度曲线为S形曲线(图3 -18)。
第4章酶单元自测题(一)名词解释或概念比较1.活化能,2.转换数,3.酶的专一性,4.反馈抑制,5.多酶复合体,6.绝对专一性,7.核酶,8.抗体酶,9.固定化酶,10.乒乓反应,11.可逆抑制作用与不可逆抑制作用,12.酶的活性中心,13.邻近效应与定向效应,14.同工酶,15.蛋白激酶与蛋白磷酸酶,16.趋异进化与趋同进化,17.脱辅酶(脱辅基酶蛋白),18.酶原,19.丝氨酸蛋白酶,20.竞争性抑制作用,21.非竞争性抑制作用,22.反竞争性抑制作用,23.酶促反应初速度,24.前馈调节,25.化学酶工程与生物酶工程,26.过渡态底物类似物(一)名词解释或概念比较1.在一定的温度下将1摩尔底物全部转化成活化态所需要的自由能,单位是kJ/mol。
2.在一定条件下每秒钟每个酶分子催化底物的分子数,或每秒钟每微摩尔酶分子催化底物的微摩尔数。
3.酶对底物有严格的选择性,酶往往只能催化一种或一类反应,作用于一种或一类化合物。
4.在酶催化的级联反应中,催化第一步反应的酶往往被级联反应的终端产物抑制,或催化前一步反应的酶被后面的产物抑制,这种抑制叫反馈抑制。
5.几种功能相关的酶依靠非共价键形成复合体,通常催化一个级联反应或一部分,可以提高催化效率。
6.酶只作用于一种底物,而不作用于其它任何底物,这种专一性称为绝对专一性。
7.具有催化功能的RNA。
8.具有抗体的识别、结合专一性,又具有催化功能的蛋白质,或称有催化活性的抗体。
抗体酶的本质是是免疫球蛋白,但是在易变区具有酶的性质。
9.将水溶性的酶用物理或化学的方法处理,使之不溶于水,但不改变原有的酶活性。
固定化酶提高了对酸碱和温度的稳定性,增加了酶的使用寿命。
10.是一种多底物酶促反应。
底物A先与酶结合,催化生成产物P,当产物P释放以后,底物B再与酶结合,催化生成产物催化生成产物Q,最后释放产物Q。
11.可逆抑制作用:抑制剂与酶以非共价键结合而引起活力降低或丧失,可以用物理方法(例如透折法)除去抑制剂,恢复酶的活性。
生物化学 第四章 酶
1、什么是酶?(酶的定义是什么)?酶的化学本质是什么?
(1)酶是由活细胞产生的对特异底物具有高效催化作用的蛋白质和核酸
(2) 化学本质:蛋白质
2、什么是单体酶?寡聚酶?多酶复合体?多功能酶?
单体酶:由一条多肽链构成的酶,溶菌酶;
寡聚酶:由多个相同或不同亚基以非共价键连接的酶,磷酸化酶a ;
多聚复合体:由几种酶靠非共价键彼此嵌合而成。
可一次催化连锁反应的复合体,丙酮酸脱氢酶系;
多功能酶:一条多肽链上同时具有多种不同催化活性的酶,生物进化中基因融合的产物,DNA 聚合酶
3、简述酶的分类?单纯酶、结合酶的定义是什么?酶蛋白、辅助因子的作用? 酶的分类:单体酶、寡聚酶、多酶复合体及多功能酶
单纯酶:仅由多肽链组成,如淀粉、脲酶、核糖核酸酶等
结合酶:由蛋白质部分和非蛋白质部分组成,其催化作用依赖于两部分的共同参与,如氨基转移酶、碳酸酐酶、乳酸脱氢酶等。
酶蛋白的作用:决定反应专一性
辅助因子的作用:决定反应的种类与性质
4、辅助因子的分类及分类依据是什么?各自(辅酶、辅基)的作用分别由哪些? 辅助因子的分类:辅酶和辅基。
分类依据:按照其与酶蛋白结合的紧密程度及作用特点不同
辅酶的作用:与酶蛋白共价键结合紧密,不可用透析、超滤方法除去 辅基的作用:与酶蛋白非共价键结合不牢固,可用透析、超滤方法除去
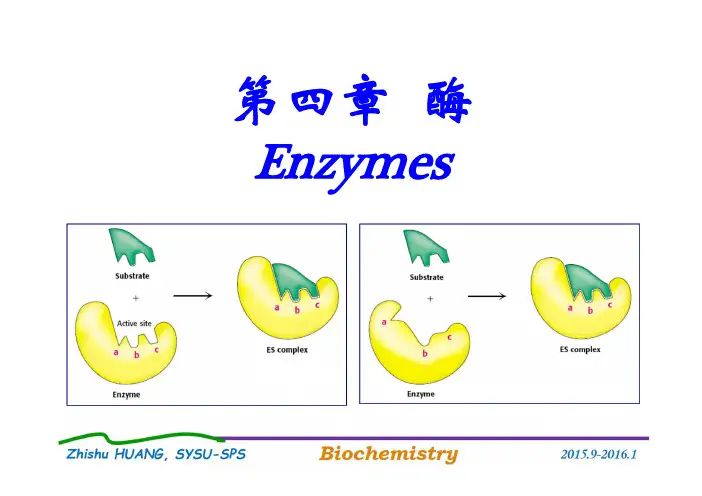
5、什么是酶的活性中心?酶的活性中心包括哪些基团?这些基团的功能是什么? 酶的活性中心:酶分子中必需基团相对集中,形成一个与底物特异性结合并催化其反应生成产物的具有特定三维结构的区域。
活性中心的基团 (1)结合基团:可与底物结合
(2)催化基团:催化底物发生化学反应
6、什么是酶原?什么是酶原激活?酶原激活的机制是什么?简述酶原激活的生理意义?
酶原:是细胞内合成或初分泌时处于无活性状态的酶的前体 酶原激活:在一定条件下,酶原向有活性酶转化的过程。
酶原激活的生理意义:(1)酶原是酶的安全转运形式,避免细胞产生的酶对细胞进行自身消化,并使酶在特定的部位和环境中发挥作用,保证体内代谢正常进行。
(2)酶原是酶的安全储存形式,在需要时,酶原适时地转变成有活性的酶,发挥其催化作用。
7、什么是同工酶?乳酸脱氢酶同工酶有哪几种?血清中同工酶活性改变有何临床意义?
同工酶:催化同一化学反应,但酶蛋白分子结构、理化性质和免疫学性质不同的一组酶。
乳酸脱氢酶同工酶:1LDH 、2LDH 、3LDH 、4LDH 、5LDH 血清中同工酶活性改变的临床意义:疾病诊断
8、根据酶促反应的类型,酶可以分为哪几类?
氧化还原酶类、转移酶类、水解酶类、裂解酶类、异构酶类、合成酶类
9、酶不同于一般催化剂的显著特点有哪些?酶促反应的机制是什么? 高效性、高度专一性、高度不稳定性、酶活性的可调控性
酶促反应的机制:酶与底物相互接近时,其结构相互诱导、相互变形和相互适应,进而相互结合。
10、什么是酶促反应动力学?影响酶促反应速率的因素有哪些?
酶促反应动力学:研究酶促反应速度及各种因素对酶促反应速度的影响,并加以定量的阐述。
影响酶促反应速率的因素:底物浓度、酶浓度、温度、PH 、激活剂、抑制剂
11、什么米氏方程?米氏方程中各字母代表什么? 米氏方程:]
[][max s K s v V m += [s]:底物浓度、V :不同[s]时的反应速度、Vmax :最大反应速度、Km :米氏常数
12、什么是Km 值?Km 值的意义?
Km 值:酶的特征性常数
Km :可表示酶对底物的亲和力,越大,亲和力越小
13、简述酶浓度如何影响酶促反应速度?
当[s]>>[E],酶可被底物饱和的情况下,反应速度与酶浓度成正比
14、什么是酶的最适温度?温度如何影响酶促反应的速度?
最适温度:酶促反应速度最快时的反应体系温度。
双重影响:温度升高,酶促反应速度升高;由于酶的本质是蛋白质,温度升高,可引起酶的变性,从而反应速度降低
15、什么是酶的最适PH 值?PH 值如何影响酶促反应的速度?
最适PH 值:酶催化活性最大时的环境PH
如何影响:由于PH 的改变导致了酶的催化基团以及底物分子的解离状态改变或者导致了酶蛋白的变性。
16、什么是酶的激活剂?
使酶由无活性变为有活性或使酶活性增高的物质。
17、什么是酶的抑制剂?抑制剂的分类及分类依据是什么?
酶的抑制剂:能使酶催化活性下降而不引起酶蛋白变性的物质
分类:不可逆抑制、可逆抑制:竞争性抑制、非竞争性抑制、反竞争性抑制 分类依据:根据抑制剂与酶的作用方式及抑制作用是否可逆。
18、酶的抑制作用分为哪几类?什么是不可逆抑制?有机磷农药中毒机制和解毒方法是什么?重金属离子中毒机制和解毒方法是什么?
抑制作用:不可逆抑制、可逆抑制
不可逆抑制:抑制剂与酶的必需基团以共价键结合,从而抑制酶的活性。
由于是共价结合,因此不能用透析、超滤等物理方法去除抑制剂
有机磷农药中毒机制:有磷杀虫剂能特异性作用于胆碱酯酶活性中心的丝氨酸羟基(-OH),不可逆的抑制酶的活性,使乙酰胆碱不能及时分解,导致胆碱能神经过度兴奋,出现恶心、呕吐、多汗、惊厥、瞳孔缩小等症状。
解毒方法:解磷定等药物可与有机磷杀虫剂结合,使酶和有机磷杀虫剂分离而复活
重金属离子中毒机制:重金属离子可以与巯基酶(E-SH)活性中心内的巯基结合而
使酶失活。
解毒方法:含有游离巯基的二巯基丁二酸钠、二巯基丙醇等可以置换出巯基酶上的金属离子,使酶恢复活性。
19、什么是可逆性抑制作用?可逆性抑制作用分为哪几类?
可逆性抑制作用:抑制剂与酶以非共价键形式结合使酶活性降低甚至消失,采用透析或超滤等方法可去除抑制剂,使酶恢复活性。
分类:竞争性抑制、非竞争性抑制、反竞争性抑制
20、什么是竞争性抑制?竞争性抑制的特点是什么?磺胺药物抑菌的机制是什么?丙二酸对琥珀酸脱氢酶的抑制作用机制是什么?
竞争性抑制:抑制剂与底物的结构相似,与底物竞争结合酶的活性中心,造成酶活性下降
竞争性抑制特点:(1)I与S结构类似,相互竞争酶的活性中心。
(2)抑制程度取决于抑制剂与酶的相对亲和力及底物浓度
磺胺药物抑菌的机制:作为二氢叶酸合成酶的竞争性抑制剂,影响二氢叶酸的合成,使细菌代谢紊乱,细菌繁殖受到抑制,达到抑菌的效果
丙二酸对琥珀酸脱氢酶的抑制作用机制:琥珀酸脱氢酶是机体内参与三羧酸循环的一种重要的脱氢酶,其辅基为FAD,如心肌中的琥珀酸脱氢酶在缺氧的情况下,可使琥珀酸脱氢生成延胡索酸,脱下之氢可将蓝色的甲烯蓝还原成无色的甲烯白。
这样,便可以显示琥珀酸脱氢酶的作用。
丙二酸的化学结构与琥珀酸相似,它能与琥珀酸竞争而和琥珀酸脱氢酶结合。
若琥珀酸脱氢酶已与丙二酸结合,则不能再催化琥珀酸脱氢,
21、什么是非竞争性抑制?非竞争性抑制的特点是什么?
非竞争性抑制:抑制剂(I)与底物(S)的结构不相似,不与底物竞争酶(E)的活性中心,而是与活性中心以外的必需基团结合,使酶的构象改变而丧失活性非竞争性抑制的特点:(1)抑制剂与酶活性中心外的必需基团结合,底物与抑制剂之间无竞争关系;(2)抑制程度取决于抑制剂的浓度;
22、酶活性的调节包括哪两类?什么是别构调节?别构酶?别构部位?
酶活性的调节分类:酶的共价修饰调节、别构调节
别构调节:特定小分子物质能与酶分子活性中心外的调节部位以非共价键结合,使酶构象改变,进而改变酶活性状态
23?
酶的化学修饰:酶蛋白肽链上的一些基团可与某种化学基团发生可逆的共价结合,从而改变酶的活性
常见的共价修饰形式:磷酸化和脱磷酸化、乙酰化和脱乙酰化、甲基化和脱甲基化、腺苷化和脱腺苷化、-SH与-S-S-互变
24、什么是酶含量的调节?
通过改变酶的合成或降解速度以调节酶的含量
25、酶的先天性异常可以导致哪些疾病的发生?
白化病(酪氨酸酶)、苯丙酮酸尿症(苯丙氨酸羟化酶)、蚕豆病(葡糖-6-磷酸酶)、范科尼综合征(细胞色素c氧化酶)。