第四章_芳环上的取代反应解析
- 格式:ppt
- 大小:1.43 MB
- 文档页数:74


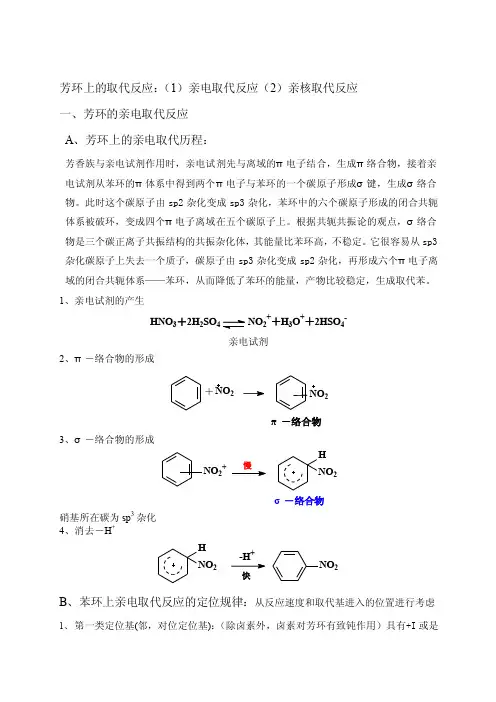
芳环上的取代反应:(1)亲电取代反应(2)亲核取代反应 一、芳环的亲电取代反应 A 、芳环上的亲电取代历程:芳香族与亲电试剂作用时,亲电试剂先与离域的π电子结合,生成π络合物,接着亲电试剂从苯环的π体系中得到两个π电子与苯环的一个碳原子形成σ键,生成σ络合物。
此时这个碳原子由sp2杂化变成sp3杂化,苯环中的六个碳原子形成的闭合共轭体系被破环,变成四个π电子离域在五个碳原子上。
根据共轭共振论的观点,σ络合物是三个碳正离子共振结构的共振杂化体,其能量比苯环高,不稳定。
它很容易从sp3杂化碳原子上失去一个质子,碳原子由sp3杂化变成sp2杂化,再形成六个π电子离域的闭合共轭体系——苯环,从而降低了苯环的能量,产物比较稳定,生成取代苯。
1、亲电试剂的产生HNO 3+2H 2SO4NO 2++H 3O ++2HSO 4-亲电试剂2、π-络合物的形成+NO 2π-络合物23、σ-络合物的形成NO 2+HNO2σ-络合物硝基所在碳为sp 3杂化 4、消去-H ++NO 2H NO 2快B 、苯环上亲电取代反应的定位规律:从反应速度和取代基进入的位置进行考虑1、 第一类定位基(邻,对位定位基):(除卤素外,卤素对芳环有致钝作用)具有+I 或是+C 效应,其作用是增大芳环的电子云密度。
致活基NH 2NHR2OHORNHCROPhR致钝基F Cl BrI2、 第二类定位基(间位定位基):具有-I 或-C 效应,使芳环上的电子云密度降低,均为致钝基NO 2NR 3COOHCOORSO 3HCNCHOCROCCl 3C 、影响亲电取代的因素:(1)芳环上取代基对于E +进入芳环位置的影响第一类定位基-邻对位定位基第二类定位基-间位定位基共振式越多, 正电荷分散程度越大,芳正离子越稳定。
(2) 动力学控制与热力学控制: α位取代-动力学控制产物; β位取代-热力学控制产物。
(3) 邻位和对位定向比:a 亲电试剂的活性越高,选择性越低。


有机反应历程(四)4.芳环上的取代反应(1)亲电取代反应芳环为大π体系,电子云密度丰富,极易进行亲电取代反应。
反应历程是:①亲电试剂E+可取代有致钝基团的芳环;中等亲电试剂:R3C+,RCH2X—FeX3,RC≡O+,团的芳环;度致活的芳环。
②苯环上两类定位基邻对位定位基(第一类)发生反应;外,都能发生反应;弱活化:-CH3,-R,-Ar,-CH=CH2;弱钝化:-F、-Cl、-Br、-I。
结构特点:与苯环直接相连的原子上有负电荷或未共享电子对,能向苯环供电共轭或超共轭。
间位定位基(第二类)强致钝基团:-+NR3,-NO2,-CF3,-CCl3,-CN,一般只在间位取代,只有强亲电试剂能与之反应:结构特点:与苯环直接相连的原子上有正电荷,吸电子基或重键(有吸电子性的),能使苯环电子云密度减弱。
CH3、CH2Cl、CHCl2是邻对位定位基,CCl3是间位定位基。
有二个取代基的定位效应主要由较强的定位基决定。
【例1】芳香族化合物氯苯(Ⅰ)、硝基苯(Ⅱ)、N,N-二甲苯胺(Ⅲ)、苯甲醚(Ⅳ)等进行硝化时,其反应速度的快慢顺序如何?A.Ⅰ>Ⅱ>Ⅲ>ⅣB.Ⅲ>Ⅳ>Ⅰ>ⅡC.Ⅳ>Ⅲ>Ⅱ>ⅠD.Ⅱ>Ⅰ>Ⅳ>Ⅲ解:B。
【例2】某溴苯与Br2+FeBr3反应只得到一种三溴苯产物,该溴苯应为:解:C。
因-Br是邻对位定位基,所以,A.和B.都有两种三溴苯产物,而D.有3种三溴苯产物。
(2)亲核取代反应在特殊结构或特殊条件下产生。
①加成—消除历程芳环上有吸电子基使之活化,以-NO2最强,如OH-、CN-、-OR、胺等。
生成碳负离子络合物中间体叫Meisenheimer络合物。
例如,已被核磁和X射线所证实。
【例3】2,4-二硝基氯苯和氨发生反应生成2,4-二硝基苯胺的反应历程是什么?A.亲电取代反应B.双分子消除—加成反应C.双分子加成—消除反应D.单分子亲核取代反应答:C.②苯炔历程(消除—加成历程)发生于试剂碱性很强时。





技术资料共享知识精细有机单元反应习题集精细有机单元反应教材编写组2007,6第一章绪论一、填空题1、所谓“精细化率”是指。
2、精细化学品是经加工的,具有或最终使用性的,品种、产量小、附加高的一大类化工产品。
3、我国原化学工业部上个世纪八十年代颁布的《关于精细化工产品的分类的暂行规定和有关事项的通知》中明确规定,中国精细化工产品包括个产品类别。
4、有机精细化学品的合成是由若干个基本反应组成。
这些基本反应我们称之单元反应。
重要的单元反应有。
5、在新的合成路线设计和选择时,要优先考虑、污染环境不大且容易治理的工艺路线。
6、天然气的主要成分是。
根据甲烷含量的不同,天然气可分为两种。
7、煤通过方法提供化工原料。
8、催化重整是得到三种重要芳烃原料的方法。
二、判断题1、氧化锌类感光材料、铁酸盐类磁性材料、精细陶瓷产品、包括导电陶瓷、透光陶瓷等一般均属有机精细化学品。
2、在合成路线设计中,反应的排列方式也直接影响总收率。
一般来说,在反应步数相同的情况下,线性法的总收率高于收敛法,因此,尽可能采用线性法。
3、碳水化合物是由碳、氢、氧三种元素组成,它们的分子组成一般可表示为Cx(H2O)y, 如葡萄糖C6H12O6=C6(H2O)6,蔗糖C12H22O11=C12(H2O)11,所以说碳水化合物是由碳和水组成的化合物。
4、在进行合成路线设计和选择时,应尽量少用或不用易燃、易爆和有剧毒原料和试剂。
5、合成路线中反应步数和反应总收率是评价合成路线的最直接、最主要的标准。
三、简答题1、为什么说合成路线中反应步数和反应总收率是评价合成路线的最直接、最主要的标准。
2、简述精细化学品合成的原料来源。
3、在设计精细有机合成路线时,需要考虑哪些主要问题?4、写出以下基本化工原料主要来自哪种资源:(1)甲烷;(2)一氧化碳;(3)乙炔;(4)乙烯;(5)C18~C30直链烷烃;(6)C12~C18直链脂肪烃;(7)苯;(8)萘。
5、对精细化学品的定义进行释义。
芳环上的取代氯化反应
芳环取代氯化反应是一种常见的有机化学反应,用于在芳环分子
的位置上引入氯原子。
该反应通常以氯化剂和芳环化合物为反应物,经过催化剂的作用,氯元素被取代到芳环化合物的碳原子上。
在常见的芳环取代氯化反应中,常用的氯化剂包括氯化亚铁(III)、氯化铁(III)、氯化亚锡(IV)等,催化剂常见的有氯化铜(II)、三氯化铝、五氯化钒等。
反应过程中,氯化剂首先被还原为氯离子,然后与芳环化合物发
生取代反应。
反应中,催化剂起到催化作用,降低了反应的活化能。
催化剂通常通过与氯离子形成络合物,加快了反应速率。
反
应的基本机理是亲电取代机理,即氯离子通过亲电攻击芳环化合物,将氯原子引入到芳环位置上。
芳环取代氯化反应的反应条件可以根据具体的反应物来确定。
通常,在适当的溶剂中进行反应,并控制反应温度和反应时间,以
获得较好的产率和选择性。
通过芳环取代氯化反应,可以在芳环化合物的分子结构上引入氯
原子,改变其物化性质以及反应性质。
此外,芳环取代氯化反应
还可用于合成具有特定结构的有机化合物,如取代基含有氯原子
的药物、杀虫剂等。
芳环取代氯化反应是一种常用的有机化学反应,能够在芳环化合
物的位置上引入氯原子。
该反应需要适当的氯化剂和催化剂,同
时在合适的条件下进行,以获得较好的反应产率和选择性。