马松三色染色液
- 格式:doc
- 大小:51.17 KB
- 文档页数:2

Masson 三色染色试剂盒(甲苯胺蓝)说明书修订日期:2018.07.31Cat number:KGMST-8004Store at 2-8℃ for 12 monthsFor Research Use Only(科研专用)【适用范围】Masson 三色染色试剂盒主要用于结缔组织染色。
用于判定各种组织、器官的病变程度与修复情况,以不同色调显示与区分某些非结缔组织及物质成分;如显示与区分肌肉及其肿瘤组织的正常或异常成分。
尤适用于软组织肿瘤的鉴别诊断。
【主要成分】【染色步骤】1、切片脱蜡处理至水。
2、滴加 1 滴(50-100µl)苏木素染色液(试剂 A)染色 5-10 分钟。
蒸馏水冲掉染液。
3、蒸馏水或自来水冲洗 2-5 分钟。
4、滴加 1 滴(50-100µl)复合染色液(试剂 B)染色 5 分钟。
5、蒸馏水或自来水冲洗一下(2-3 秒,冲掉染液即可)。
6、滴加 1 滴(50-100µl)磷钼酸(试剂 C)染色 1 分钟。
7、甩干或自然晾干。
8、滴加 1 滴(50-100µl)甲苯胺蓝染色液(试剂 D)染色 5min 左右。
9、蒸馏水或自来水冲洗一下(2-3 秒,冲掉染液即可)。
10、放入烘箱(50-60 摄氏度)烘干。
中性树胶封片。
【结果】胶元纤维、黏液、软骨、神经纤维呈蓝色;肌肉、弹力纤维呈红色;神经轴索呈粉红色;纤维素呈紫红色;红血球呈橘红色。
细胞核呈蓝紫色。
【注意事项】1、不同的固定液或固定时间以及不一样的组织,染色效果可有差异,要根据显微镜下观察来掌握染色或分化时间。
2、染色液必须充分淹盖组织。
3、每次染色宜用阳性切片作对照。
【有效期】12 个月仅供研究、不用于临床诊断。

Masson三色法(根据Masson,1929)一、试剂配制(一)Weigert氏铁苏木素液(可用Herris苏木素代替)甲液:苏木素1g无水酒精(或95%酒精)100ml乙液:29%三氯化铁水溶液4ml蒸馏水95ml (30%三氯化铁溶液则为100ml)盐酸1ml临用时,取甲、乙液等量混合即可应用。
混合时应将乙液加人甲液内,染液呈紫黑色。
铁苏木素不能象明矾苏木素一样配制后可放置贮存备用,因铁与染色剂的色素根会化合生成不溶性沉淀,所以铁作媒染液时,必须与染液分别配制和分别保存,染片时临时混合应用。
由于这是一种铁苏木素,它将胞核染成黑色。
能抵抗在对比染色液中所含分色剂的脱色作用,且不会被光线退色,因此比钾矾苏木素染色较为持久。
(二)丽春红酸性品红液丽春红(Ponceau 2R)0.7g酸性品红(acid fuchsin)0.3g蒸馏水99ml冰醋酸(glacial acetic acid) 1ml(三)1%磷钼酸水溶液磷钼酸(phosphomolybdic acid)1g蒸馏水加至100ml(四)2%苯胺蓝液苯胺蓝(aniline blue)2g冰醋酸(glacial acetic acid )2ml蒸馏水加至100ml(五)亮绿液亮绿(light green)1g蒸馏水99ml冰醋酸(glacial acetic acid )1ml(六)Bouin氏液苦味酸饱和液(1.22%)75ml福尔马林25ml冰醋酸5ml此液一般在临用时配制,对皮肤及肌腱有软化作用。
二、操作方法1.组织固定于Bouin氏液,流水冲洗一晚,常规脱水包埋。
2.切片脱蜡至水:(1)二甲苯中脱蜡10分钟×3次,用吸水纸吸干液体;(2)100%乙醇5分钟×2次,用吸水纸吸干液体;(3)95%乙醇5分钟×2次,用吸水纸吸干液体;;(4)流水2分钟,用吸水纸吸干水分;3.Weiger氏铁苏木素染5-10分钟。

Masson染色,操作规程实验目的: Masson染色,用于显示组织中纤维的染色方法之一实验原理:Masson氏染色时胶原纤维呈蓝色(被苯胺蓝所染),肌纤维呈红色(被酸性品红和丽春红所染),这与阴离子染料分子的大小和组织的渗透性有关。
不同的组织和细胞成分,它们的孔隙大小是不同的。
孔隙的大小,决定了组织的渗透性。
如孔隙小,组织结构致密,渗透性低;孔隙宽,组织结构疏松,渗透性高。
如已固定的组织用一系列阴离子水溶性染料先后或混合染色,则可发现红细胞被最小分子的阴离子染料着染.肌纤维与胞质被中等大小的阴离子染料着染,而胶原纤维则被大分子的阴离子染料着染。
由此说明了红细胞对阴离子染料的渗透性最小,肌纤维与胞质次之,而胶原纤维具有最大的渗透性。
根据组织不同的渗透性能,选择分子大小不同的阴离子染料进行染色,便可把不同组织成分显示出来.而染料分子的大小,主要由其分子量来体现。
小分子量者易于穿透结构致密、渗透性低的组织,而大分子最者则只能进入结构疏松,渗透性高的组织。
一般来说,结构疏松,渗透性高的组织多选择大分子染料,而结构致密,渗透性低的组织多选择小分子染料。
试剂仪器:Harris 氏苏木精:苏木精0.4g,硫酸铝钾6g,黄色氧化汞0.16g,蒸馏水80ml。
将蒸馏水预热,预热过程中加入硫酸铝钾,沸腾后拔下电源,加入苏木精,接通电源再度沸腾后,拔掉电源,缓慢加入氧化汞,搅拌混匀,冷却后第二天加入5%比例的冰醋酸即可用。
透明玻璃瓶装缓慢氧化可省略冰醋酸,长期有效。
Masson丽春红酸性复红液:丽春红0.7g,酸性复红0.3g,蒸馏水99ml,冰醋酸1ml。
1%冰醋酸水溶液:冰醋酸1 ml,蒸馏水100 ml。
1%磷钼酸水溶液:磷钼酸1g,蒸馏水100 ml。
1%苯胺蓝水溶液:苯胺蓝1g,蒸馏水100 ml,冰醋酸2 ml。
1%光绿水溶液:光绿 1g,蒸馏水100 ml实验操作程序:1、石蜡切片脱蜡至水。
2、铬化处理或去汞盐沉淀(甲醛固定的组织此步可略)。

一种不易褪色的masson三色染色方法及其应用
Masson三色染色法是一种染色方法,用于检测细胞中的蛋白
质和核酸,是一种不易褪色的染色法。
Masson三色染色法的原理是:将需要染色的细胞或组织切片,用三种不同的染料分别染色,分别指示蛋白质,核酸和细胞壁结构。
染料的种类有:碘酒素、亚硝酸盐和胭脂红。
碘酒素用于染色蛋白质,亚硝酸盐用于染色核酸,胭脂红用于染色细胞壁结构。
Masson三色染色法可以用于显示细胞结构,也可以用于检测
细胞中的蛋白质和核酸的分布情况。
它可以用于细胞结构的分析,也可以用于病理学的诊断。
此外,Masson三色染色法还
可以用于细胞培养,观察细胞的生长及其他变化。



masson三色染色原理马森三色染色的原理马森三色染色是一种组织学染色技术,用于区分神经组织的不同成分。
它基于通过磷钨酸-血红素溶液和靛胭脂溶液的顺序染色,这赋予神经元不同的颜色。
磷钨酸-血红素溶液的染色原理磷钨酸-血红素溶液是一种呈酸性的溶液,含有磷钨酸和血红素。
磷钨酸是一种多价阴离子,对组织中的碱性成分,如细胞核和细胞质,具有亲和力。
血红素是一种铁卟啉分子,与氧气结合形成稳定的络合物。
当磷钨酸-血红素溶液应用于组织时,磷钨酸会与细胞核和细胞质中的碱性成分结合,形成不溶性沉淀。
血红素与氧气结合,形成棕红色的血红素氧络合物,沉积于这些碱性成分上。
因此,细胞核和细胞质被染成深棕色。
靛胭脂溶液的染色原理靛胭脂是一种阳离子染料,对组织中的酸性成分,如细胞外基质和神经胶质纤维,具有亲和力。
当靛胭脂溶液应用于组织时,它会与这些酸性成分结合,形成不溶性蓝紫色沉淀。
神经胶质纤维是神经胶质细胞产生的长而细的纤维,它们包裹着神经元并提供支持。
通过与靛胭脂结合,这些纤维被染成蓝色。
神经元的染色神经元的细胞体主要由细胞核和细胞质组成,它们富含碱性成分。
因此,它们在磷钨酸-血红素溶液中被染成深棕色。
神经元的轴突和树突是神经元的细胞突起,它们由神经胶质细胞包裹。
神经胶质细胞产生的神经胶质纤维含有酸性成分,因此它们在靛胭脂溶液中被染成蓝色。
通过磷钨酸-血红素溶液和靛胭脂溶液的顺序染色,马森三色染色可以区分神经元的不同成分:细胞核和细胞质呈深棕色,神经胶质纤维呈蓝色。
这种差异允许在显微镜下对神经组织进行详细的观察和分析。

马松三色染色原理masson.Masson染色(2010-09-02 14:43:20转载标签:杂谈分类:实验日志masson 染色原理Masson三色法(根据Masson,1929试剂配制(一Weigert氏铁苏木素液(见苦味酸——酸性品红法(二丽春红酸性品红液丽春红(Ponceau 2R 0.7g酸性品红(acid fuchsin 0.3g蒸馏水 99ml冰醋酸(glacial acetic acid 1ml(三 1%磷钼酸水溶液磷钼酸(phosphomolybdic acid 1g蒸馏水加至 100ml(四 2%苯胺蓝液苯胺蓝(aniline blue 2g冰醋酸(glacial acetic acid 2ml蒸馏水加至 100ml(五亮绿液亮绿(light green 1g蒸馏水 99ml冰醋酸(glacial acetic acid 1ml操作方法1. 组织固定于Bouin氏液或Zenker氏液,流水冲洗一晚,常规脱水包埋。
2. 切片脱蜡至水。
如用Zenker氏液固定者,应进行除汞处理,其步骤如下:(1 切片脱蜡后于0.5%碘酒精作用10分钟。
(2 稍水洗(3 5%硫代硫酸钠作用5分钟。
(4 流水冲洗10分钟3. Weiger氏铁苏木素染5-10分钟。
4. 流水稍洗。
5. 1%盐酸酒精分化。
6. 流水冲洗数分钟。
7. 丽春红酸性品红液染5-10分钟。
8. 蒸馏水稍冲洗。
9. 1%磷钼酸水溶液处理约5分钟。
10.不用水洗,直接用苯胺蓝液或绿液复染5分钟。
11.1%冰醋酸处理1分钟。
12.95%酒精脱水多次。
13.无水酒精脱水,二甲苯透明,中性树胶封固结果:胶原纤维虽蓝色(用苯胶蓝液复染或绿色(用亮绿复染。
胞质、肌纤维和红细胞红色。
胞核蓝褐色。
注意事项:1.组织用Bouin氏液或Zenker氏液固定为佳。
如已用10%甲酸液固定,切片可在脱蜡至水后.再放入Bouin氏液作用一晚或置37。
C温箱内1-2小时,然后流水冲洗切片至黄色消失再进行染色。

Masson三色染色主要用途:主要用于胶原纤维和肌纤维的鉴别染色。
检验原理:由mallory三色染色改造,利用两种或三种阴离子染料混合一起或先后作用完成染色,与阴离子染料分子大小和组织的渗透性有关。
根据组织不同的渗透性能,选择分子大小不同的阴离子的染料进行染色,便可把不同组织成份显示出来。
主要成份:1.weigert铁苏木素A液2.weigert铁苏木素B液3.丽春红酸性品红染液4.磷钼酸溶液5.苯胺蓝溶液样本要求:组织片充分固定和脱蜡。
检验方法:1.组织固定于bouin氏液或zenker氏液,流水冲洗过夜,常规脱水包埋2.切片脱蜡至水3.weigert铁苏木素(weigert铁苏木素A、B液等比例混和)染5-10分,流水稍洗4. 1%盐酸酒精分化,流水冲洗数分5. 丽春红酸性品红染液染5-10分,流水稍冲洗。
6.磷钼酸溶液处理约5分钟,不用水洗,直接用苯胺蓝人染液复染5分钟7. 1%冰醋酸处理1分钟,95%酒精脱水多次。
.无水酒精脱水、二甲苯透明,中性树胶封固。
检验结果:胶原纤维、粘液、软骨呈蓝色,肌纤维、纤维素和红细胞染红色、胞核染蓝黑色。
、注意事项:1.weigert铁苏木素分A、B两液,应与临用前将两液等分混合,而不宜预先混合,否则容易氧化沉淀而逐渐失去染色能力。
2.组织用bouin氏液或zenker氏液固定为佳,如已用10%甲醛液固定,切片可在脱蜡至水后,再放入bouin氏液作用一晚或置37℃温箱内1-2小时,然后流水冲洗切片至黄色消失再进行染色。
3.磷钼酸处理时,要镜下控制,见肌纤维呈红色,胶原纤维呈淡红色即可。
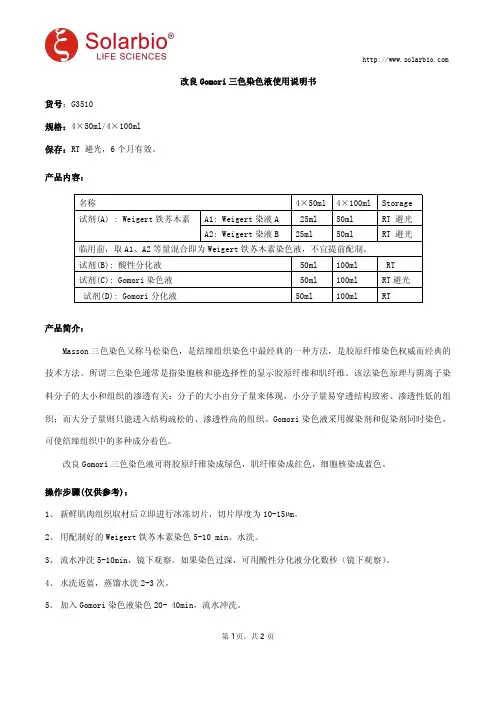
改良Gomori三色染色液使用说明书货号:G3510规格:4×50ml/4×100ml保存:RT避光,6个月有效。
产品内容:名称4×50ml4×100ml Storage试剂(A):Weigert铁苏木素A1:Weigert染液A25ml50ml RT避光A2:Weigert染液B25ml50ml RT避光临用前,取A1、A2等量混合即为Weigert铁苏木素染色液,不宜提前配制。
试剂(B):酸性分化液50ml100ml RT试剂(C):Gomori染色液50ml100ml RT避光试剂(D):Gomori分化液50ml100ml RT产品简介:Masson三色染色又称马松染色,是结缔组织染色中最经典的一种方法,是胶原纤维染色权威而经典的技术方法。
所谓三色染色通常是指染胞核和能选择性的显示胶原纤维和肌纤维。
该法染色原理与阴离子染料分子的大小和组织的渗透有关:分子的大小由分子量来体现,小分子量易穿透结构致密、渗透性低的组织;而大分子量则只能进入结构疏松的、渗透性高的组织。
Gomori染色液采用媒染剂和促染剂同时染色,可使结缔组织中的多种成分着色。
改良Gomori三色染色液可将胶原纤维染成绿色,肌纤维染成红色,细胞核染成蓝色。
操作步骤(仅供参考):1、新鲜肌肉组织取材后立即进行冰冻切片,切片厚度为10-15µm。
2、用配制好的Weigert铁苏木素染色5-10min。
水洗。
3、流水冲洗5-10min,镜下观察。
如果染色过深,可用酸性分化液分化数秒(镜下观察)。
4、水洗返蓝,蒸馏水洗2-3次。
5、加入Gomori染色液染色20-40min,流水冲洗。
6、在上述操作过程中按蒸馏水:Gomori分化液=4:1比例配制Gomori分化工作液。
7、用Gomori分化工作液洗30s-90s,以镜下观察适当为宜,流水冲洗。
8、95%乙醇快速脱水,无水乙醇脱水3次,每次5-10s。

Masson 三色染色液20ml*5RT产品简介:由Mallory 三色染色改造,利用两种或三种阴离子染料混合一起或先后作用完成染色,与阴离子染料分子的大小和组织的渗透性有关。
根据组织不同的渗透性能,选择分子大小不同的阴离子的染料进行染色,便可把不同组织成分显示出来。
包装内容:保存条件:室温保存,有效期1年。
操作说明:1、 组织固定于4%多聚甲醛溶液,Bouin 氏液或Zenker 氏液,流水冲洗过夜,常规脱水包埋。
2、 切片脱蜡至水。
3、 Weigert 铁苏木素(Weigert 铁苏木素A 、B 液等比例混合液)染5-10min ,流水稍洗。
4、 1%盐酸酒精稍分化,流水冲洗数分钟返蓝。
5、 丽春红酸性品红染液染5-10min ,蒸馏水快速冲洗。
6、 磷钼酸溶液处理约2min ,不用水洗直接用苯胺蓝染液复染5min 。
7、 1%冰醋酸处理1min ,95%酒精脱水多次。
8、 无水酒精脱水,二甲苯透明。
中性树胶封固。
染色结果:胶原纤维、粘液、软骨呈蓝色。
弹力纤维呈棕色。
肌纤维、纤维素和红细胞染红色。
细胞核染蓝黑色。
注意事项:1、 Weigert 铁苏木素分A 、B 两液,临用前将两液等比例混合使用。
不宜预先混合,否则容易氧化沉淀而失去染色力。
2、 组织用Bouin 氏液或Zenker 氏液固定为佳。
如已用甲醛液固定,切片可在脱蜡至水后,放入2.5%重铬酸钾媒染剂中处理12-18h ,然后流水冲洗切片至黄色消失再进行染色。
3、 磷钼酸处理尽可能在镜下控制,见肌纤维呈红色,胶原纤维呈淡红色即可。
4、 切片在各级酒精中脱水,时间不宜过长,否则会将着染的颜色脱去。
图例:心脏组织染masson,胶原纤维呈蓝色,肌纤维,红细胞呈红色。
马松三色染色原理masson.Masson染色(2010-09-02 14:43:20转载标签:杂谈分类:实验日志masson 染色原理Masson三色法(根据Masson,1929试剂配制(一 Weigert氏铁苏木素液(见苦味酸——酸性品红法(二丽春红酸性品红液丽春红(Ponceau 2R 0.7g酸性品红(acid fuchsin 0.3g蒸馏水 99ml冰醋酸(glacial acetic acid 1ml(三 1%磷钼酸水溶液磷钼酸(phosphomolybdic acid 1g蒸馏水加至 100ml(四 2%苯胺蓝液苯胺蓝(aniline blue 2g冰醋酸(glacial acetic acid 2ml蒸馏水加至 100ml(五亮绿液亮绿(light green 1g蒸馏水 99ml冰醋酸(glacial acetic acid 1ml操作方法1. 组织固定于Bouin氏液或Zenker氏液,流水冲洗一晚,常规脱水包埋。
2. 切片脱蜡至水。
如用Zenker氏液固定者,应进行除汞处理,其步骤如下:(1 切片脱蜡后于0.5%碘酒精作用10分钟。
(2 稍水洗(3 5%硫代硫酸钠作用5分钟。
(4 流水冲洗10分钟3. Weiger氏铁苏木素染5-10分钟。
4. 流水稍洗。
5. 1%盐酸酒精分化。
6. 流水冲洗数分钟。
7. 丽春红酸性品红液染5-10分钟。
8. 蒸馏水稍冲洗。
9. 1%磷钼酸水溶液处理约5分钟。
10.不用水洗,直接用苯胺蓝液或绿液复染5分钟。
11.1%冰醋酸处理1分钟。
12.95%酒精脱水多次。
13.无水酒精脱水,二甲苯透明,中性树胶封固结果:胶原纤维虽蓝色(用苯胶蓝液复染或绿色(用亮绿复染。
胞质、肌纤维和红细胞红色。
胞核蓝褐色。
注意事项:1.组织用Bouin氏液或Zenker氏液固定为佳。
如已用10%甲酸液固定,切片可在脱蜡至水后.再放入Bouin氏液作用一晚或置37。
C温箱内1-2小时,然后流水冲洗切片至黄色消失再进行染色。
马松三色染色在儿童狼疮性肾炎中的应用比较儿童SLE是儿童常见的肾脏病,其病理诊断及其分型对患儿的治疗,预后有着重要意义。
本文通过介绍三种masson染色方法,病在肾穿标本中进行试验摸索,发现加入Bouin 后固定液可显著改善标本的染色效果,而用丽春红,酸性品红混合液染色的标本免疫复合物显示效果较好,但层次稍弱,而用变色酸2R染色的标本,颜色鲜艳,免疫复合物显示清晰,层次分明,是一种效果相对较好的方法,可能更加有助于对狼疮性肾炎的诊断。
标签:儿童肾活检;Masson三色染色;狼疮性肾炎系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种全身性自身免疫性疾病,是一种常见的结缔组织病,累及肾脏则称为狼疮性肾炎(lupus nephritis,LN)。
儿童肾脏累及率明显高于成人,为40%-90%[1]。
儿童SLE起病大多以肾脏症状为首发表现,临床表现以肾炎肾病为主,病理类型以Ⅳ型最多[2]。
肾穿刺活检组织常规特殊染色有3种染色:过碘酸雪夫反应(PAS)、高碘酸-乌洛托品银(PASM)、Masson染色。
其中M asson三色染色主要是用来观察肾小球嗜复红蛋白沉积物(免疫复合物)及肾脏内胶原纤维增生等,对狼疮性肾炎(LN)的诊断具有重要作用。
我们意识到传统的masson三色染色法[3]操作较繁琐,时间长,对肾小球内免疫复合物显色颜色浅淡,基底膜、系膜、胶原纤维及胞质、红细胞颜色对比不鲜艳。
许多学者也对Masson三色染色法进行了各种各样的探索和改良。
但由于各实验室条件及操作者的水平存在差异,因此改善的方法得不到广泛的认可和推广。
现收集目前常用的几种Masson染色法及改良后的效果进行比较,对各实验条件及可行性进行分析比较,摸索找出一种效果显著又适合推广的方法,希望对儿童肾活检狼疮性肾炎诊断提供更好的诊断素材。
1 材料与方法1.1 材料收集南京市儿童医院临床住院患儿肾活检组织,经10% 福尔马林固定,常规脱水、透明、包埋,选取20例已明确诊断为Ⅲ型和Ⅳ型狼疮性肾炎的患儿肾穿刺标本病理诊断剩下的石蜡块,每块连续切2 μm 切片3张,分别采用三种不同方法进行Masson三色染色。
Masson 三色染色液(固绿法)简介:结缔组织狭义上是指其含有的三种纤维:胶原纤维、网状纤维、弹力纤维,而胶原纤维(collagen fiber)是分布最广、含量最多的一种纤维。
Masson 三色染色又称马松染色,是结缔组织染色中最经典的一种方法,是胶原纤维染色权威而经典的技术方法。
所谓三色染色通常是指染胞核和能选择性的显示胶原纤维和肌纤维。
Leagene Masson 三色染色的特点:①染色稳定;②分化时间短,1~2s ;③色彩清晰鲜艳;④适用范围广,适宜于组织的石蜡切片、冰冻切片等染色;⑤所染切片保存时间长且不易褪色。
组成:操作步骤(仅供参考):1、切片常规脱蜡至水,用配制好的Weigert 铁苏木素染色。
2、用酸性乙醇分化液分化,水洗。
3、用Masson 蓝化液返蓝,水洗。
4、蒸馏水洗。
5、丽春红品红染色液染色。
6、在上述操作过程中按蒸馏水:弱酸溶液=2:1比例配制弱酸工作液,用弱酸工作液洗。
7、磷钼酸溶液洗。
8、用配制好的弱酸工作液洗。
9、直接入固绿染色液中染色。
编号 名称DC00347×50mlDC00347×100ml Storage试剂(A) :Weigert 铁苏木素染色液A1:Weigert 染液A 25ml 50ml RT 避光 A2: Weigert 染液B25ml50mlRT试剂(B): 酸性乙醇分化液 50ml 100ml RT 试剂(C): Masson 蓝化液 50ml 100ml RT 试剂(D): 丽春红品红染色液 50ml 100ml RT 避光 试剂(E): 弱酸溶液 50ml 100ml RT 试剂(F): 磷钼酸溶液 50ml 100ml RT 避光 试剂(G): 固绿染色液 50ml100ml RT 避光使用说明书 1份10、用配制好的弱酸工作液洗。
11、95%乙醇快速脱水。
无水乙醇脱水3次,每次5~10s。
12、二甲苯透明3次,每次1~2min。
MASSON染色操作流程及步骤:1、切片常规脱蜡至水[1-2]。
2、用配制好的Weigert 铁苏木素染色液染色5min-10min[3]。
3、酸性乙醇分化液分化5-15s,水洗[4]。
4、Masson 蓝化液返蓝3-5min,水洗[4]。
5、蒸馏水洗1min。
6、丽春红品红染色液染色5-10min[5]。
7、在上述操作过程中按蒸馏水:弱酸溶液=2:1 比例配制弱酸工作液,用弱酸工作液洗1min。
8、磷钼酸溶液洗1-2min [6]。
9、用配制好的弱酸工作液洗1min。
10、直接放入苯胺蓝染色液中染色1-2min[6]。
11、用配制好的弱酸工作液洗1min。
12、95%乙醇快速脱水。
13、无水乙醇脱水3 次,每次5-10s[7]。
14、二甲苯透明3 次,每次1-2min[6]。
15、中性树胶封固[8]。
心得体会及注意事项:1、二甲苯Ⅰ-二甲苯Ⅰ-每次五分钟,100%无水乙醇-95%乙醇-80%乙醇-70%乙醇每次3分钟,最后放入水中2min。
2、二甲苯有毒,要带口罩做好自我防护。
3、Weigert 铁苏木素:配比1:1要现用现配,注意避光,染色时间以5分钟为宜。
4、精确染色时间,酸性乙醇分化时间应该依据切片薄厚,组织的类别和新旧而定,冲洗要彻底。
5、医大摸索丽春红品红染色时间7分钟。
6、暂定时间为2min。
7、梯度脱水93% 乙醇10F、100%无水乙醇10F。
8、盖盖玻片时注意不要有气泡产生。
说明书中注意事项:1、切片脱蜡应尽量干净。
2、取A1、A2 等量混合,成为Weigert 铁苏木素染色液,一般24h 失去染色能力。
3、组织固定起着非常重要的作用,使用不同的固定液可延长或缩短染色时间。
4、经典masson 三色染色中,用Harris 苏木精染核,但Harris 苏木精染核后切片颜色不够鲜艳,本染液采用Weigert 染细胞核,因为染色的目的主要在于区分胶原纤维和肌纤维,一般也可以省略该染色步骤。
Masson染色Masson染色,用于显示组织中纤维的染色方法之一。
试剂:Regaud 氏苏木精:苏木精1g,95%酒精10ml,甘油10ml,蒸馏水80ml。
将苏木精加入蒸馏水内加温溶解,冷却后加入酒精和甘油,放数日后即可应用。
Masson丽春红酸性复红液:丽春红0.7g,酸性复红0.3g,蒸馏水99ml,冰醋酸1ml。
0.2%冰醋酸水溶液:冰醋酸0.2 ml,蒸馏水100 ml。
1%磷钼酸水溶液:磷钼酸1g,蒸馏水100 ml。
苯胺蓝水溶液:苯胺蓝2g,蒸馏水98 ml,冰醋酸2 ml。
1%光绿水溶液:光绿 1g,蒸馏水100 ml。
Masson三色法步骤1、石蜡切片脱蜡至水。
2、铬化处理或去汞盐沉淀(甲醛固定的组织此步可略)。
3、依次自来水和蒸馏水洗。
4、用Regaud苏木精染液或Weigert苏木精液染核5-10min。
5、充分水洗,如过染可盐酸酒精分化。
6、蒸馏水洗。
7、用Masson 丽春红酸性复红液5-10min。
8、以2%冰醋酸水溶液浸洗片刻。
9、1%磷钼酸水溶液分化3-5min。
10、不经水洗,直接用苯胺蓝或光绿液染5min。
11、以0.2%冰醋酸水溶液浸洗片刻。
12、95%酒精、无水酒精、二甲苯透明、中性树胶封固。
结果:胶原纤维、粘液、软骨呈蓝色(如光绿液染色为绿色),胞浆、肌肉、纤维素、神经胶质呈红色,胞核黑蓝色。
体会与说明:1、控制好染色步骤。
2、组织固定起着很重要的作用,根据不同的固定液可延长或缩短染色时间。
3、0.2%冰醋酸水溶液洗,可使色调清晰鲜艳。
4、磷钼酸水溶液对丽春红、酸性复红有分化作用,分化时镜下控制,肌纤维和纤维素呈红色,胶原纤维呈淡粉红色即可。
常用染色步骤HE,马松,糖原联系人:周昌斌137******** 133********苏木素伊红染色液一.苏木素伊红染色液套装组合:Harris苏木素染色液50ml水溶性伊红染色液50ml苏木素染色分化液50ml苏木素染色返兰液50ml概述:苏木素伊红染色是组织病理学经典的常规染色方法,历经上百年的应用历史至今仍无可替代。
因此,苏木素伊红染色是病理切片制作中极为重要的技术环节。
二.染色方法:1. 切片脱蜡二甲苯I 5分钟,2. 切片脱蜡二甲苯II 5分钟,3. 100%1、100%2、95%1、95%2、70%梯度乙醇各30,秒钟,4. 自来水流水冲洗1分钟,5. 苏木素染色5—8分钟(依染液新旧调整染色时间),6. 自来水流水冲洗1分钟,7. 进入分化液分化数秒钟,8. 自来水流水冲洗1分钟,9. 进入返兰液处理5—10秒钟,10. 自来水流水冲洗2分钟,11. 进入伊红染色液1-3分钟,12. 自来水冲洗30—60秒钟,13. 75%I、75%II乙醇脱水分色各10秒钟,14. 95%乙醇1、95%乙醇2各脱水10秒钟,15. 100%乙醇1、100%2脱水30-60秒钟,16. 二甲苯1、二甲苯2透明各1分钟,17. 中性树胶封固。
三.染色技术要点:苏木素染色液在静止由于时染液表面于空气中的氧分子接触极液体代表面水分蒸发会产生氧化作用并形成氧化膜。
因此,在使用前应使用滤纸吸附去除氧化膜以免污染切片。
一般情况下应建立良好的使用习惯,每隔2~3天将苏木素染液彻底过滤一次。
为保证HE切片的恒定染色质量建议每500ml苏木素染色液染1200~1500张切片为宜。
苏木素染色液在用于免疫组织化学染色的的复染时应注意调控染色时间,核染色过浅不易辨识组织结构而核染色过深则喧宾夺主,一般复染的时间应控在10-30秒以内。
此外,复染后的分化和返兰步骤不应省略否则将造成整张切片呈淡蓝色,使DAB呈现土黄色。
分化和返兰步骤是HE染色关键点,应在染色实践中依据分化液和返兰液的新旧调整分化和返兰的处理时间。
马松三色染色液
【产品名称】
Masson三色染色液
【包装规格】
货号:DC0032
套组包装规格:8×20ml/盒、8×100ml/盒、8×250ml/盒
【预期用途】
主要用于组织中结缔组织、肌肉和胶原纤维的组织细胞学染色。
【检验原理】
马松染色又称,Masson三色染色,是胶原纤维染色权威而经典的技术方法,所谓三色染色通常是指染胞核和能选择性的显示胶原纤维和肌纤维。
该法染色原理与阴离子染料分子的大小和组织的渗透有关:分子的大小由分子量来体现,小分子量易穿透结构致密、渗透性低的组织;而大分子量则只能进入结构疏松的、渗透性高的组织,苯胺蓝的分子量很大,染色后肌纤维呈红色,胶原纤维呈蓝色,主要用于区分胶原纤维和肌纤维。
【主要组成成分】
试剂组成主要成分
1、Weigert铁苏木素A液苏木素
2、Weigert铁苏木素B液三氯化铁
3、酸性乙醇分化液乙醇
4、蓝化液碳酸盐
5、丽春红品红染色液丽春红、品红
6、乙酸溶液乙酸
7、磷钼酸溶液磷钼酸
8、苯胺蓝染色液苯胺蓝
【储存条件及有效期】
5℃~35℃保存,原包装未开封染色液的有效期为l8个月,在有效期内的已开封染色液建议在开封后6个月内使用完,每次用后应及时拧紧瓶盖,以免挥发或变质。
【样本要求】
组织片充分固定和脱蜡。
【检验方法】
1、组织固定于Bouin氏固定液(另购)或Zenker氏固定液(另购)或10%中性福尔马林固定液(另购)等,流水冲洗,常规脱水包埋;
2、切片常规脱蜡至水;
3、取适量的Weigert铁苏木素A液和Weigert铁苏木素B液等量混合,即为Weigert铁苏木素染色液,用Weigert铁苏木素染色液染色,流水稍洗;
4、酸性乙醇分化液分化数秒,流水冲洗数分钟;
5、蓝化液返蓝数秒,流水冲洗数分钟;
6、丽春红品红染色液染色,流水稍冲洗;
7、按蒸馏水和乙酸溶液按比例配制乙酸工作液,用乙酸工作液洗切片;
8、磷钼酸溶液处理,倾去玻片上磷钼酸溶液(不用水洗);
9、苯胺蓝染色液复染,倾去玻片上染色液(不用水洗);
10、用乙酸工作液处理切片,至切片无蓝色脱出(必要时镜下控制);
11、95%乙醇迅速脱水,无水乙醇脱水3次,二甲苯透明,中性树胶封固。
【检验方法的局限性】
仅限于病理组织内容物染色观察。
【注意事项】
1、组织固定尽量采用Bouin氏或Zenker氏固定液,固定后应充分冲洗;如果无Bouin 氏或Zenker氏固定液,亦可采用10%中性福尔马林固定液;使用不同的固定液可延长或缩短染色时间。
2、Weigert铁苏木素A液和Weigert铁苏木素B液应于临用前等量混合使用,而不宜预先混合,否则容易氧化沉淀而逐渐失去染色力。
3、酸性乙醇分化液分化时间应根据切片厚薄、组织的类别和新旧而定。
4、如蓝化液使用量较大,可自行配制Scott促蓝液或0.1~1%碳酸锂水溶液予以替代。
5、磷钼酸处理时最好在镜下控制,分化到胶原纤维呈淡红色、纤维呈红色即可,分化时间根据染色深浅而定,一般1~2分钟。
6、部分组织95%乙醇脱水时容易造成脱色过度,应注意肉眼控制。
7、本产品仅用于体外诊断,应由专业人士使用及进行结果的判读。
8、使用前应详细阅读说明书,并做好个人卫生防护,在有效期内使用,生产日期、生产批号和失效日期见包装。
9、用后应按医院或环保部门要求处置废弃物。
【基本信息】
备案人/生产企业名称:安徽雷根生物技术有限公司
住所:淮北凤凰山经济开发区凤冠路三期标准化厂房三号厂房。