(医疗药品)药用植物组织培养实验指导
- 格式:doc
- 大小:47.30 KB
- 文档页数:35


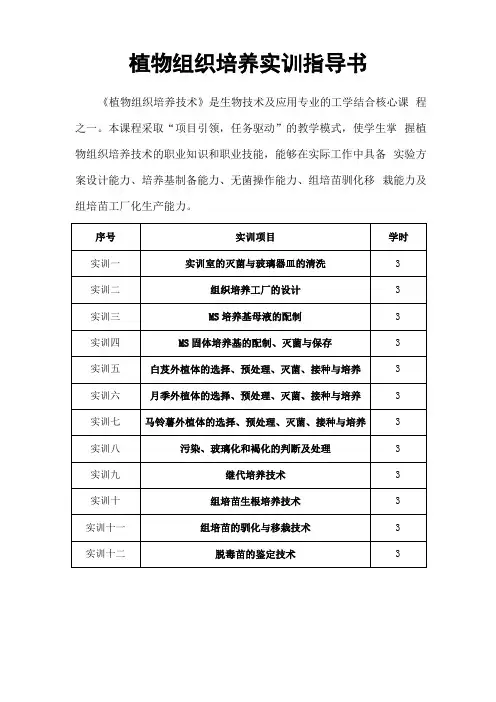
植物组织培养实训指导书《植物组织培养技术》是生物技术及应用专业的工学结合核心课程之一。
本课程采取“项目引领,任务驱动”的教学模式,使学生掌握植物组织培养技术的职业知识和职业技能,能够在实际工作中具备实验方案设计能力、培养基制备能力、无菌操作能力、组培苗驯化移栽能力及组培苗工厂化生产能力。
实训一:实训室的灭菌与玻璃器皿的清洗一、目的要求1.通过实训,使学生了解各种洗涤液的特性;2.掌握酸液的配制方法和组织培养中常用器皿的洗涤技术;3.通过实训,培养学生良好的卫生习惯,建立组织培养的无菌意识;4.会配制新杰尔灭溶液。
二、材料用具1.灭菌用具:2%新洁尔灭、高锰酸钾、甲醛、70%酒精、洗涤剂、各种培养皿、工作服、口罩、手套、试管刷。
2.洗涤用具:肥皂液、洗衣粉、重铬酸钾粉末、1%HCL、70%酒精、瓶刷等。
三、方法步骤(一)培养室的灭菌1、地面、墙面和工作台的灭菌2、无菌室和培养室的灭菌(二)玻璃器皿的洗涤(酸洗)玻璃器皿的洗涤一般要经过浸泡、刷洗、浸酸和清洗四个步骤。
重铬酸钾洗涤(三种)液配制:重铬酸钾50g,加1L蒸馏水,加热溶化,冷却后再缓缓加入工业浓硫酸90ml。
1、新玻璃器皿的洗涤用1%HCL的溶液浸泡一昼夜,再用清水反复洗涤,最后用蒸馏水冲淋一遍,干燥后备用。
2、用过的玻璃器皿先将器皿中得残留物质除去,用清水冲洗,再用洗衣粉洗涤,最后用清水冲洗3~4遍,把字迹擦洗干净,干燥后使用。
3、污染的培养瓶的处理首先经高压蒸汽灭菌,再按(2)的步骤洗涤。
4、用过的吸管、滴管、容量瓶先放在重铬酸钾溶液浸泡2h以上,取出后经流水冲洗30min左右,干燥后使用。
四、实训报告①.植物组织培养室的灭菌方法步骤。
②.写出洗涤液的配置步骤。
③.记录各种培养瓶的洗涤方法。
实训二:组织培养工厂的设计一、目的要求通过实训,使同学们对现代组培苗生产模式有一个更为深刻的认识,能熟练的根据生产规模设计合理的厂房及工艺流程。
二、材料用具组培苗生产小工厂、绘图纸、绘图笔三、方法步骤(一) 组培工厂的参观1.参观组培实验中心2.组培工厂的组成:准备室、灭菌室、缓冲室、无菌室、培养室、驯化室3.各室内仪器设备的种类及摆放(二) 设计一200m2组培工厂,要求绘出大概的布局图。

实验一组培器皿及器械的洗涤、灭菌及环境的消毒一、实验目的通过实验,使学生了解并掌握组织培养用实验器皿及器械的洗涤、灭菌,环境的消毒方法。
二、实验原理实验仪器及器械的清洗、消毒和灭菌是组织培养成功的关键所在,是外植体免受污染的前提。
由于灭菌剂的种类不同,所以选择消毒剂既要考虑良好的消毒、杀菌作用,同时易被蒸馏水冲洗掉。
无菌的环境是植物组织培养成功的前提,因为绝大多数操作程序要求在无菌条件下进行。
三、实验操作步骤(一)器皿与用具的洗涤1、玻璃器皿的洗涤新购置的玻璃器皿或多或少都含有游离的碱性物质。
使用前要先用1%稀HCL 浸泡一夜,再用肥皂水洗净,清水冲洗后,再用蒸馏水冲洗1次,晾干后备用。
用过的玻璃器皿,用清水冲洗,蒸馏水冲洗一次,干后备用即可。
对于已被污染的玻璃器皿则必须在高压蒸汽灭菌后,倒去残渣,用毛刷刷去瓶壁上的培养液和病斑后,再用清水冲洗干净,蒸馏水冲淋一遍,晾干备用,切忌不可用水直接冲洗,否则会造成培养环境的污染。
清洗后的玻璃器皿,瓶壁应透明发亮,内外壁水膜均一,不挂水珠。
2、金属用具的洗涤新购置的金属用具表面上有一层油腻,需擦净油腻后再用热肥皂水洗净,清水冲洗后,擦干备用。
用过的金属用具,用清水洗净,擦干备用即可。
3、每人清洗部分玻璃器皿清水洗净→浸入洗衣粉溶液中洗刷→清水反复冲洗→蒸馏水淋一遍→烘干备用。
对于较脏玻璃器皿的洗涤:采用先碱后酸的方法,即用洗衣粉洗刷后冲洗干净→晾干→浸入酪酸洗液(一种强氧化剂,去污能力强,配制方法:重铬酸钾40克,溶解在500ml在水中,然后徐徐加入450ml粗制浓硫酸),浸泡时间视器皿的肮脏程度而定→清水反复冲洗干净→蒸馏水淋洗一遍→烘干备用。
对于带有石蜡或胶布的器皿:先将其除去,再用常规洗涤,石蜡用水煮沸数次即可去掉,胶布粘着物则需用洗衣粉液煮沸数小时,再用水冲洗,凉干后浸入洗液,以后的步骤同前。
(二)玻璃器皿、用具及环境的灭菌1、玻璃器皿和用具的灭菌(1)采用干热灭菌法:将洗干净晾干后的培养皿、三角瓶、吸管等玻璃用具和解剖针、解剖刀、镊子等金属器具,用纸包好,放进电热烘干箱,当温度升至100℃时,启动箱内鼓风机,使电热箱内的温度均匀。

《植物组织培养》实验指导书实验性质:设计性武汉工业学院生物科学与制药工程系《生物工程实验》课程组编写二零零五年六月植物组织培养实验性质:设计性实验学时:8分组人数:2人1.1实验目的和要求(1)了解植物细胞和组织培养技术的定义和基本要求(2)熟悉无菌操作的要求,初步掌握无菌操作技术(3)初步掌握常规的植物组织培养技术1.2实验原理细胞分化(cell diferentiation)指细胞后代在形态、结构和功能等发生变化的过程,归根结底是某些功能基因的开启或者关闭。
一般说来,终端分化细胞已经失去分化潜能,只具有单能性;而大部分细胞只保留了部分分化潜能,称为多能性。
对于动物而言,只有部分干细胞仍保留了分化的全能性。
而植物体的任何一个细胞都具有生长分化成为一个完整植株的能力,称为植物细胞的全能性(totipotency)。
植物组织培养就是利用植物的全能性进行离体无菌植物培养的一门技术。
植物组织培养最原始的意义是指愈伤组织培养,但发展至今,其范围已经扩展至植物和它的离体器官、组织、细胞和原生质体的离体无菌培养:植株培养。
指以具备完整植株形态的材料(如幼苗和较大的植株)作为外植体的无菌培养。
胚胎培养。
指以从胚珠中分离出来的成熟或未成熟胚为外植体的离体无菌培养。
器官培养。
指以植物的根,茎,叶,花,果等器官为外植体的离体无菌培养,如根的根尖和切段,茎的茎尖,茎节和切段,叶的叶原基,叶片,叶柄,叶鞘和子叶,花器的花瓣,雄蕊(花药,花丝),胚珠,子房,果实等的离体无菌培养。
组织培养。
指以分离出植物各部位的组织(如分生组织,形成层,木质部,韧皮部,表皮,皮层,胚乳组织,薄壁组织,髓部等),或已诱导的愈伤组织为外植体的离体无菌培养。
这是狭.义的组织培养......。
细胞培养。
指以单个的游离细胞(如用果酸酶从组织中分离的体细胞,或花粉细胞,卵细胞)为接种体的离体无菌培养。
原生质体培养。
指以除去细胞壁的原生质体为外植体的离体无菌培养。
植物组织培养实训指导书《植物组织培养技术》是生物技术及应用专业的工学结合核心课程之一。
本课程采取“项目引领,任务驱动”的教学模式,使学生掌握植物组织培养技术的职业知识和职业技能,能够在实际工作中具备实验方案设计能力、培养基制备能力、无菌操作能力、组培苗驯化移栽能力及组培苗工厂化生产能力。
实训一:实训室的灭菌与玻璃器皿的清洗一、目的要求1.通过实训,使学生了解各种洗涤液的特性;2.掌握酸液的配制方法和组织培养中常用器血的洗涤技术;3.通过实训,培养学生良好的卫生习惯,建立组织培养的无菌意识;4.会配制新杰尔灭溶液。
二、材料用具1.灭菌用具:2%新洁尔灭、高镒酸钾、甲醛、70%酒精、洗涤剂、各种培养血、工作服、口罩、手套、试管刷。
2.洗涤用具:肥皂液、洗衣粉、重铬酸钾粉末、1%HCL、70%酒精、瓶刷等。
三、方法步骤(一)培养室的灭菌1、地面、墙面和工作台的灭菌2、无菌室和培养室的灭菌(二)玻璃器皿的洗涤(酸洗)玻璃器血的洗涤一般要经过浸泡、刷洗、浸酸和清洗四个步骤。
重铬酸钾洗涤(三种)液配制:重铬酸钾508,加工蒸馏水,加热溶化,冷却后再缓缓加入工业浓硫酸90ml。
1、新玻璃器血的洗涤用1%HCL的溶液浸泡一昼夜,再用清水反复洗涤,最后用蒸馏水冲淋一遍,干燥后备用。
2、用过的玻璃器血先将器血中得残留物质除去,用清水冲洗,再用洗衣粉洗涤,最后用清水冲洗3—4遍,把字迹擦洗干净,干燥后使用。
3、污染的培养瓶的处理首先经高压蒸汽灭菌,再按(2)的步骤洗涤。
4、用过的吸管、滴管、容量瓶先放在重铬酸钾溶液浸泡2h以上,取出后经流水冲洗30min左右,干燥后使用。
四、实训报告①.植物组织培养室的灭菌方法步骤。
②.写出洗涤液的配置步骤。
③.记录各种培养瓶的洗涤方法。
实训二:组织培养工厂的设计一、目的要求通过实训,使同学们对现代组培苗生产模式有一个更为深刻的认识,能熟练的根据生产规模设计合理的厂房及工艺流程。
二、材料用具组培苗生产小工厂、绘图纸、绘图笔三、方法步骤(-)组培工厂的参观1.参观组培实验中心2.组培工厂的组成:准备室、灭菌室、缓冲室、无菌室、培养室、驯化室3.各室内仪器设备的种类及摆放(二)设计一 200m2组培工厂,要求给出大概的布局图。

《植物组织培养》实验指导教师:任峻目录实验一参观植物组织培养实验室实验二培养基母液配制实验三培养基配制与灭菌实验四植物快速繁殖培养实验考核一、课程的性质与任务植物细胞工程实验技术一般包括植物细胞组织离体培养技术、细胞融合技术、细胞拆合技术、外源基因转移技术等一系列重要的基础技术。
通过实验课程的学习,实验方法立足于初学者的专业基础和一般实验室的条件,将《植物细胞组织培养技术》课程的理论知识、一般的实验技能和科学研究的初步方法融为一体。
培养学生理论联系实际、独立思考及实践动手能力。
二、实验的目的与基本要求通过本课程的学习使学生掌握植物细胞工程技术的基本原理和实验操作方法,掌握植物细胞体外培养技术,结合科研和生产实际,提高学生分析问题、解决问题的能力。
以适应今后在教学、科研和生产开发等各方面对当代生命科学人才知识结构的需求。
在实验教学过程中,要求学生学习态度严谨,操作动作规范,观察记录耐心细致,独立思考,综合分析实验结果,充分理解后认真地完成实验报告。
09本《植物组织培养》实验考核一、考核方式:实验操作。
二、考核时间:三、考核地点:四、监考教师:实验考核以实验操作形式进行,根据实验4或实验5实验的实验结果(失败或成功)决定实验方案,如果失败,分析失败原因,提出改进措施,在重做中进行实验操作考核,如果成功则继续下一步的实验,实施实验操作考核。
二.考核办法:考核方法主要观察学生的实验操作是否正确,污染率是否高,并要求学生写出实验报告,总结实验中常出现的问题。
在3个课时内小组协作完成实验内容。
包括以下几个方面:1.对实验仪器设备的选择及操作。
湿热灭菌操作过程;无菌操作过程。
2.培养基的配制试剂的配制;母液的移取;实验配方计算。
3.培养条件的设置。
4.实验报告的规范性与科学性。
实验一 参观植物组织培养实验室一、实验的目的和要求掌握植物组织培养实验室的设计要点和必备的仪器设备。
二、实验内容:1. 植物组织培养实验室的设计要点。

《植物组织培养》实践教学指导书目录实验实训部分实验一植物组织培养实验室及常用仪器设备的构造及使用实验二无菌操作技术(选做)实验三接种训练实验四组培苗的移栽驯化实验五试管苗的转接与扩繁(选做)实验六生根培养(选做)实验七胡萝卜离体根的培养(选做)实验八茎尖的组织培养(选做)实验九茎段的组织培养实验十百合鳞茎的组织培养(选做)实验十一叶片的组织培养(选做)实验十二花药培养实验十三西葫芦子房的培养(选做)实验十四苹果胚(embryo)培养(选做)实验十五黄瓜下胚轴愈伤组织的诱导(选做)实验十微茎尖的剥离训练专业实训部分实训一培养基的制作实训二器官培养技能实训三果树、蔬菜、经济类植物组织培养一、果树类组织培养(一)苹果的组织培养(二)草莓微茎尖培养(三)枣的组织培养(四)树莓的组织培养二、蔬菜类组织培养(一)芦笋的组织培养(二)无籽西瓜的组织培养(三)大蒜的组织培养(四)马铃薯组织培养三、经济类组织培养(一)香石竹的组织培养(二)菊花茎段的组织培养(三)菊花微茎尖的组织培养(四)唐菖莆的组织培养(五)串红的组织培养(六)蝴蝶兰的组织培养附1:观看组织培养实验室和组培工厂化生产的录像或课件附2:组培技能考核标准实验实训部分实验一植物组织培养实验室及常用仪器的构造及使用一、目的要求(一)一般掌握组织培养常用仪器设备的结构与维护;(二)熟练掌握常用仪器设备的正确使用方法。
二、常用仪器设备分析天平;灭菌器;蒸馏水器等。
三、方法步骤(-)岛津进口电子分析天平的构造及使用1.构造:岛津进口电子分析天平主要由:天平机体、称重舱、天平盘、键板(包括4个键)、液晶显示屏等构成。
2.使用:(1)调平天平放稳后,转动脚螺旋,使水平气泡在水平指示的红环内;(2)自检在空载下,天平内部进行自检,显示屏上相继显示CHE3→0,CAL4→0,CAL,END,CAL,OFF;(3)全显示按“ON/OFF”键,液晶屏进入全显示态;(4)这时再按“ON/OFF’键,液晶屏进入预热状态,有绿色指示灯显示。

植物组织培养实验指导一、材料与设备准备1.植物材料:选择符合实验要求的植物组织,如茎段、叶片等。
2.吐温20:用于表面消毒材料。
3.植物生长调节剂:包括激素和营养成分等。
4.植物培养基:选择适合所培养植物组织的培养基。
5.培养器具:试管、蒸馏水瓶、烧杯等。
6.其他辅助材料:包括消毒用酒精、无菌操作需要的洁净衣和手套等。
二、无菌操作准备1.操作台面准备:清洁操作台面,并用75%酒精消毒,然后用紫外线灯照射30分钟。
2.实验者准备:穿戴洁净衣、口罩和手套,洗手并用75%酒精消毒双手。
3.工具准备:将试管、蒸馏水瓶等器具洗净,并用高温高压消毒或用离子蒸汽灭菌器进行灭菌。
三、无菌茎段培养实验步骤1.材料准备:选择健康的植物茎段,将其切成1-2厘米长的小段,洗净并去除表皮。
2.表面消毒:将茎段放入含有0.1%吐温20的蒸馏水中浸泡15-30分钟,再用无菌蒸馏水冲洗3-4次。
3.培养基制备:按照特定比例和配方制备适合茎段培养的培养基。
4.培养基固化:将培养基倒入试管中,约3/4满,然后用高温高压或离子蒸汽灭菌器进行灭菌,同时密封试管。
5.培养基接种:将消毒后的茎段放入培养基中,约每个试管放入1-2个茎段。
6.培养条件设置:将培养瓶在适宜的光照和温度条件下培养,通常为25摄氏度,光照强度为3000-5000勒克斯,光周期为16小时光照和8小时黑暗。
四、观察和记录1.培养基观察:每隔一段时间,观察培养基的颜色变化、植物组织的生长情况等,并记录下来。
2.茎段生长观察:观察茎段的生长情况,包括根的生长情况、叶片形态等,并记录下来。
五、结果分析与总结根据观察和记录的数据,分析植株生长的情况、比较不同处理之间的差异等,并对实验的结果进行总结和讨论。
六、安全注意事项1.在操作过程中要严格遵守无菌操作要求,避免细菌、霉菌等的污染。
2.注意使用化学试剂时的安全操作,避免直接接触皮肤和吸入有害气体。
3.实验完成后,洗手消毒,清洁操作台面,并关闭紫外线灯。

实验一培养基母液的配制一、目的要求通过对MS培养基母液的配制,学习掌握培养基母液配制方法。
二、说明在配制培养基时,为了取用方便和提高各种药品称量的准确性,往往先把各组成成分按其需用量配成扩大一定倍数的浓缩液,即母液贮存备用,用时稀释。
配制母液时,一般按药品的种类和性质分别配制,单独保存或几种混合保存。
如把所有大量元素配在一起,配成大量元素母液,把微量元素放在一起配成微量元素母液,以及单一的维生素、铁盐、植物激素等母液。
母液扩大的倍数主要取决于用量的多少,用量大的扩大的倍数宜低,反之则高,但要注意过高浓度和不恰当的混合会引起沉淀,影响培养效果。
三、仪器和药品电子天平1/1000、1/10000。
药品按MS培养基配方准备。
激素按需要准备。
四、方法和步骤一)、大量元素母液:因大量元素用量大,为避免过高浓度的混合液会发生沉淀,一般配成10倍的母液。
根据所选培养基配方,按大量元素在表中排列顺序,以其10倍用量用1/1000天平逐个称出,按次序加入盛有蒸馏水的烧杯中,并搅拌。
注意每种溶解后,再加下一种。
原则上应注意把Ca2+与SO4-PO4错开,以免产生沉淀,最后加蒸馏水定容至刻度,此即大量元素母液。
配培养基时,每配一升,取母液100ml。
二)、微量元素母液:微量元素因用量小,为称量方便及精确,常配成100倍或1000倍的母液,即将每一种微量元素化合物的量扩大100倍或1000倍,分别称量、溶解、定容,方法向上。
配1升培养基取母液10ml或1ml。
本实验配成100倍。
三)、铁盐铁盐不是都需要单独配成母液,如柠檬酸铁,只需和大量元素一起配成母液即可。
目前常用的铁盐为FeSO4· 7H20,由于在使用过程中容宜产生Fe(OH)3沉淀,一般先将其配成螯合物。
常配成100倍称取FeSO4· 7H2O,Na2-EDTA,分别加热溶解,然后混合、定容,或混合后加热,至呈黄色,定容。
每配制1升用10ml。

药用植物组织培养1.药用植物组织培养的定义及组培中所涉及的主要概念。
定义:是指在无菌条件下,将离体的药用植物器官、组织、细胞及原生质体,培养在人工培养上和人工控制的环境中,使其生长、分化、形成新的植株的过程和技术。
(又称植物离体培养、植物克隆)组培中所涉及的主要概念:培养基:指根据植物营养原理和植物组织离体培养的要求而人工配制的营养基质。
初代培养:也叫第一代培养,指将从植物体上分离下来的材料进行的一次培养。
继代培养:将初代培养的培养物转移到新的培养基上继续培养。
固体培养基:指把加入琼脂或结冷胶使培养基呈固体状态的培养。
外植体:由植物体上切取下来用于组织培养的离体材料。
(泛指第一次接种所用的植物组织、器官等一切离体材料。
)愈伤组织:指外植体因受伤或离体培养时,其未分化的细胞和已分化的细胞进行活跃的分裂,形成的一种无特定结构和功能的薄壁细胞。
5.植物组织培养的特点?特点: (1 )、培养条件可以人为控制;(2)、生长周期短,繁殖率高;(3)、管理方便,利于工厂化生产和自动化控制。
1.一般药用植物组织培养实验室由那些分室所组成?各分室的作用及所需仪器设备等。
一般药用植物组织培养实验室由准备室(条件许可的情况下,可细分为储存室、洗涤室、配制室)、无菌操作室、培养室和温室。
(1)准备室:①作用:主要进行一些常规的试验操作,如所需器皿的洗涤、干燥和保存,培养基的配制和灭菌,蒸馏水的生产,常规的生理生化分析,以及组织培养中常用的化学试剂、玻璃器皿的存放。
②所需仪器设备:普通天平(1/10)。
分析天平(1/10000)、冰箱、高压蒸汽灭菌锅、蒸馏水制造装置、干燥箱或烘箱、酸度计(或PH 试纸5.0-7.0)、微波炉或电炉、药品柜及培养容器、分注器等。
(2)无菌操作室①作用:主要进行植物材料的表面灭菌、接种及培养物的继代转接等。
②所需仪器设备:超净工作台、周转小推车、紫外灯、(显微镜、显微摄影装置)、酒精灯、镊子剪刀类、细菌过滤器。

百合的组织培养姓名:XXX学号:学院:农学院专业:中草药栽培与鉴定百合简要概述百合是百合科百合属,多年生草本球根植物。
是著名的观赏花卉,可食用,有很高的利用价值。
利用组织培养进行繁育是百合无毒化和商品化的必要途径。
由于百合的常规繁殖率低,易感染病毒,所以对繁殖技术提出了更高的要求,人工繁殖技术对百合具有重要的意义。
本实验主要通过植物组织培养手段,以MS为基本培养基,以百合鳞茎为外植体,对其进行灭菌消毒,并置于温箱中进行培养。
随后观察其生长情况,并拍照记录。
植物组织培养概述植物组织培养是一种将植物体的部分细胞或组织与母体分离,在适当的条件下加以培养,使它们能够生长、发育、分化与增殖的技术。
原理是来自植物细胞的全能性分化能力,也就是植物体内的某一类细胞,能够独立发育并且分化成为完整的植物成体。
植物组织培养是根据植物细胞具有全能性的理论,利用植物体离体的器官、组织或细胞以及原生质体,在无菌和适宜的人工培养基及温度等人工条件下,能诱导出愈伤组织、不定芽、不定根,最后形成完整的植株。
培养选用的基础培养基一般较多采用的是MS。
采用固体培养基较多,因为相比液体培养基,固体培养基在操作上更方便,被广泛使用。
在基础培养基里添加一定的外源激素,可以诱导出愈伤组织、胚状体、不定芽、根等器官,最终可获得再生植株或者次生产物。
常用的激素类型有生长素类、细胞分裂素类、赤霉素等。
百合植物组织培养实验试剂烟酸,甘氨酸,盐酸硫胺素,肌醇,盐酸吡哆醇;琼脂,蔗糖,蒸馏水,NAA,6-BA,1mol/LHCl,1mol/L NaOH;75%酒精。
仪器冰箱、天平、pH试纸、电炉、高压灭菌锅、超净工作台、光照培养箱、三角瓶、容量瓶、量筒、移液管、烧杯、培养皿、滤纸、报纸、绳、玻璃棒、镊子、刀等。
生物材料:百合实验步骤1、配制培养基母液的配制方法a)大量元素的配制:依次称取KNO319g、NH4NO316.5g、MgSO4•7H2O3.7g、KH2PO40.17g、CaCl2•2H2O4.4g,分别用少量的蒸馏水彻底溶解,然后再将它们混溶,以防互相发生反应,最后用容量瓶定容至1L,转入试剂瓶中,贴上标签,置冰箱冷藏保存。
药用植物组织培养实验指导药用植物组织培养是一种通过组织培养技术繁殖和培育药用植物,得到高品质的药用植物及其次生代谢产物的方法。
其主要适用于稀有药材、难以繁殖和响应慢的植物种类。
药用植物组织培养技术已成为现代生物技术和药学研究领域中的重要一环,对于药用植物资源的保护和开发利用具有广泛的应用价值。
一、实验材料和方法(一)实验材料药用植物:如丹参、黄芪、当归、川芎等。
生长介质:以MS为基本配方加入不同的生长调节剂和其他必需物质。
生长调节剂:如BA、KT、IBA、NAA、GA3等。
其他必需物质:如蔗糖、琼脂、植物营养物、维生素、酪朊、提取液等。
实验器材:量筒、移液吸管、显微镜、培养室、灭菌器、无菌操作台等。
(二)实验方法1.准备组培外植体:将新鲜的植物叶片,茎尖或子实体等外植体按特定的要求分离,清除植物表面的杂质,并切割成一定大小的切片或组织块。
2.预处理外植体:将清洗好的外植体放入含有适当浓度的消毒液中浸泡消毒,消毒后用蒸馏水冲洗干净备用。
3.生长介质配制:根据外植体的特征和培养要求将适量的生长介质和生长调节剂、蔗糖、琼脂等必需物质按比例配制好,并调节酸碱度等参数。
4.外植体接种:无菌条件下将预处理好的外植体移植到含有生长介质的培养瓶中,密封,然后将其置于适宜的培养条件下进行培养。
5.组织培养条件:组织培养的条件主要包括光照、温度、空气等条件的控制。
合适的光照和温度可以促进组织的生长和发育,而适度的通气可以增加培养瓶内的氧气含量,促进外植体的组织培养和生长。
二、实验结果与分析药用植物组织培养实验是一项需要持续观察和分析的过程。
在实验过程中,可以通过比较不同生长介质中的组织生长情况和代谢产物含量,以及观察外植体的形态和组织构造,来分析生长介质和生长调节剂对药用植物的影响。
实验结果显示,不同的生长介质配方和生长调节剂的添加量可以影响到组织的生长和分化。
在以NAA、IBA为生长调节剂的生长介质中,当归外植体的愈伤组织生长情况最佳,而添加GA3和KT可以进一步增加愈伤组织的分化和代谢产物的合成。
植物组织培养实验(一)实验名称:参观植物组织培养实验室实验时间:第二周(分组进行)实验地点:植物组织培养实验室专业:生物技术及应用一、实验目的熟悉实验室的构建和掌握各种常用仪器设备的操作方法和使用注意事项。
二、实验仪器设备、药品及试剂高压蒸汽灭菌锅、培养架、超净工作台、1/100电子天平、1/10000电子天平、蒸馏水器、IAA、6-BA、NAA、KT,各种无机盐,有机化合物等。
三、实验内容方法及步骤参观准备室、无菌操作室和培养室,学习使用各种常用仪器。
四、分析与讨论1. 基本的实验室至少要包括准备室、无菌操作室和培养室,另外根据实验的需要可以设立辅助实验室,如细胞学实验室和生化实验室等。
2. 准备室要求宽敞明亮、便于放置多个实验台和相关设备,方便多人同时工作;同时要求通风条件好,便于气体交换;实验室地面应便于清洁,并应进行防滑处理;无菌操作室也叫接种室,进行材料的离体无菌操作,是植物组织培养研究或生产中最关键的一步,要求房间一般不宜过大,封闭性好,干燥清洁,能较长时间保持无菌;培养室要求能够控制光照、温度,并保持相对的无菌环境.因此,培养室应保持清洁和适度干燥。
植物组织培养实验(二)实验名称:母液的配制实验时间:第五、六周(分组进行)实验地点:植物组织培养实验室专业:生物技术及应用一、实验目的。
掌握各种营养元素和激素母液的配制方法,二、实验仪器设备、药品及试剂(1)实验仪器设备及用具1/100电子天平、1/10000电子天平、蒸馏水器、烧杯、棕色细口瓶、量筒、移液枪、各种规格的定容瓶、100ml、500ml烧杯、标签纸、记号笔等(2)实验药品及试剂IAA、6-BA、NAA、KT,各种无机盐,0.1mol /LNaOH溶液,0.1mol/L HCl溶液。
三、实验方法及步骤1. 20倍大量元素母液的配制。
在电子天平上按MS基本培养基配方扩大20倍分别称取所需要的5钟大量元素药品,分别置于500ml的烧杯中中,加蒸馏水100ml左右,搅拌溶解,然后一一倒入1000ml的容量瓶中(注意CaCl2要后加),最后加蒸馏水定容至刻度,此为20倍液的大量元素母液。
甘肃农业大学农学院药用植物组织培养实验指导柳福智编农学院中草药栽培与鉴定教研室2007年8月前言药用植物组织培养实验是根据中草药栽培与鉴定专业的培养要求,为学生开设的一门实验课程。
药用植物组织培养实验的任务是使学生加深对药用植物组织培养基本理论的理解,掌握药用植物组织培养实验的基本操作技能,学习药用植物组织培养实验的基本知识,养成严格、认真和实事求是的科学态度,提高观察、分析和解决问题的能力,为将来参加工作打下良好的基础。
编者2007年8月学生实验守则1、实验前认真预习,领会实验原理,明确本次实验的目的和要求,了解实验步骤和注意事项。
2、实验时要严格按照规范操作进行,仔细观察实验现象,认真记录有关数据。
3、要认真写好实验报告,实验报告要清楚、简练、整洁。
4、学生进入实验室必须严格遵守实验室规则,服从带教老师的指导。
5、爱护实验室的仪器设备,不准将实验室的仪器设备私自带出室外。
6、严格遵守操作规程及实验时应注意的事项,在使用不熟悉其性能的仪器和药品之前,应查阅有关资料或请教指导教师,不要随意进行实验,以免损坏仪器,浪费试剂,使实验失败,更重要的是预防发生意外事故。
7、实验过程中应注意防火灾、防爆炸、防腐蚀、防污染工作,牢固树立“安全第一”意识。
8、实验结束后,一切仪器试剂应放回原处,玻璃仪器要清洗干净,一些有毒、有腐蚀性的废液应倒入废液缸内。
9、实验台面要擦试干净,由值日生负责安全卫生工作,包括清理实验室,检查水、电的开关,清除垃圾和污物,关好门窗后方可离开实验室。
药用植物组织培养实验报告一般包括以下内容和要求:(1)实验名称、实验日期。
(2)实验目的写明通过本实验要达到的训练目的。
(3)实验原理用文字表述本实验的基本原理。
(4)操作步骤简明扼要叙述实验的操作步骤。
(5)实验数据的处理及结果。
(6)问题及讨论应对实验中观察到的现象及实验结果进行分析和讨论,如果实验失败,要寻找失败原因,总结经验教训,以提高自己的基本操作技能。
《植物组织培养实验指导》《植物组织培养实验指导》的相关说明一、本指导用于《植物组织培养概论》课程的实验教学。
二、各专业班级根据实际情况做相应调整,调整情况详见各专业班级的授课计划。
其中15个课时的内容调整如下:实验一、二、五 3学时实验六 3学时实验七 3学时实验九、实验十二 3学时实验十三 3学时实验一实验室基本设备及其用途的识别一、目的认识植物组织培养实验室的基本结构,必须的基本设备及其用途与作用方法。
二、实验室的基本结构(一)化学实验室(工作室)培养基药品称量、配制、分装、灭菌;材料预处理;培养材料的观察分析;制蒸馏水。
设备、药柜、工作台、蒸馏水器、天平、冰箱,手提高压消毒锅、显微镜、解剖镜、各种玻璃仪器、金属仪器等。
安装水、电、排气等装置。
(二)接种室①无菌操作室②接种箱③超净工作台(三)培养室(四)洗涤、消毒室;卧式高压消毒锅。
(五)温室(培养大棚)。
实验二常用仪器、必要器皿、几种主要设备的使用方法、常用几种药剂的配制一、目的认识植物组织培养必需的仪器、器皿,几种主要设备的使用方法、常用几种药剂的配制。
二、常用仪器1.蒸馏水器(学习操作)2.手提式高压消毒锅、卧式高压消毒锅(学习使用、操作)3.天平⑴药物天平(工业天平)、粗天平、(精密度1/10)⑵扭力天平(精密度1/100)⑶分析天平(精密度1/10000)4.超净工作台(学习、使用、操作)5.电热干燥箱(烘箱)6.恒温光照培养箱(学习、操作)7.电冰箱8.显微镜和解剖镜①手提式解剖镜(学习、使用、操作)②立体解剖镜③普通显微镜9.旋转培养机10.离心机(学习、使用、操作)11.酸度测定仪:⑴精密PH4-7试纸;⑵笔型袖珍酸度计。
三、必要的器皿(一)玻璃器皿1.培养器皿①试管②三角烧瓶(锥形瓶)③圆形高形培养瓶(罐头瓶)④培养皿⑤扁身培养瓶⑥L型和T型管⑦凹面载玻片2.盛装器皿①试剂瓶②烧杯3.计量器皿①量筒②容量瓶③吸管4.其它器皿滴瓶、称量瓶、漏斗、玻璃管、注射器等实验室常用器皿。
实验一培养器皿的洗涤与环境的消毒及培养基母液的配制实验二植物组织培养的培养基配制、分装与灭菌实验三番茄子叶愈伤组织诱导培养阿实验四马铃薯茎段的扩繁培养实验五海棠叶片的离体培养实验六胡萝卜离体根的培养实验七组织培养物的继代培养实验八马铃薯脱毒与组培快繁实验九沙棘组织培养实验方案设计及实施实验一培养器皿的洗涤与环境的消毒及培养基母液的配制常用组织培养的玻璃容器及接种用的玻璃器皿如锥形瓶、培养皿、试管、配置培养基用的试剂瓶、烧杯等以及金属的镊子、剪刀、接种铲等,用前必须经过洗涤,有的还要消毒。
一器皿的洗涤方法1.一般玻璃器皿,特别是第一次使用的新的玻璃器皿,首先用清水充分浸泡后用碱水刷洗,然后用清水充分除去碱液,再用无离子水或蒸馏水刷洗干净后烘干或晾干,待用。
检查玻璃器皿是否洗刷干净的标准是:洗后的玻璃器皿沾水后,布满于整个玻璃表面并形成完整的水膜,而不会有不均匀的水珠出现。
当玻璃器皿十分肮脏,带有不同的污渍时,则需要特殊的洗涤液浸泡4-12小时,然后再用清水漂洗干净,较常用的是铬酸洗液,它是用重铬酸钾加入浓硫酸配制而成,其腐蚀性极强,对衣物、皮肤等均十分有害,一般尽量避免使用。
目前生产有各种合成的化学洗涤剂,可清除各种污物,使用方便,是实验室内常用的。
2.金属用具在第一次使用前必需先用四氯化碳或乙醚等有机溶剂将其表面的防锈油擦洗干净,用布擦干方可使用,每次使用后需用水清洗并保持干燥。
二器皿及环境的消毒方法器皿的消毒方法分为:1.物理方法又可细分为:(1)干热消毒法(Dry heat sterilization):适用于玻璃器皿、金属和一些不怕高温的物品,如培养皿、锥形瓶、各种试剂瓶、刀、剪、镊子等。
一般在150℃烘箱内烤2-3小时,在消毒灭菌前将所要消毒的物品包装于固定容器或耐热的包装材料内(如饭盒、培养皿灭菌筒、铝箔纸等),防止在使用前的再次污染。
(2)湿热消毒法(Wet heat sterilization):不能用干热消毒的物品,如配置好的培养基、易燃的棉花、工作服、口罩等,要使用高压灭菌锅,通过水蒸气压达到灭菌消毒的目的,常用气压为15磅或1.2kg/cm2,温度为121-124℃,灭菌20分钟即可达到杀灭细菌、消毒的目的。
实训一MS固体培养基的配制、灭菌及保存一、实训目的掌握MS固体培养基的配制方法。
二、设备仪器电子分析天平、托盘天平、灭菌器、电炉等。
以下按小组为单位,烧杯、棕色细口瓶(1000ml 1个、500ml 1个、100ml 1个)、量筒100ml1个、移液管0.1、0.5、2、10ml各1支、吸气球1个、定容瓶1000ml 1支、小烧杯1支、培养瓶及瓶盖10个、精密pH试纸等。
三、药品试剂MS培养基所需各种物质(见配方),琼脂,蔗糖(或绵白糖),0.1M NaOH溶液,0.1M HCl 溶液。
1mol/L NaOH的配制方法是称4gNaOH,溶解后加入蒸馏水,定容到100ml即可。
1mol HCl的配制方法是量取,12mol HCl 8.4ml,加水定容至100m1。
四、母液的配制1.大量元素母液在分析天平上按下表分别称取大量元素药品,置于三角瓶中,分别加蒸馏水100ml左右于三角瓶中,再放到磁力搅拌器(或电炉)搅拌溶解,然后一一倒入1000ml 的容量瓶中(注意CaCl2要后加,最后加蒸馏水定容至刻度,此为10倍液的大量元素母液)。
2.微量元素母液在分析天平上按表分别称取微量元素药品,按大量元素母液配制方法,配成100倍液的微量元素母液。
3.铁盐母液在分析天平上按表称取FeSO4.7H2 O和Na2 -EDTA 药品,配成100倍液的铁盐母液。
4.有机物母液:用分析天平按表分别称取甘氨酸、VB1 、Vpp、VB6、肌醇,配成100倍有机物质母液。
表1 MS培养基母液的配制实验三还需要 NAA和6-BA,请准备!!!五、MS培养基的合成1. 加热溶解先在1L的烧杯中加500ml蒸馏水,然后加入琼脂丝8g,加热并不断搅拌,直至琼脂完全溶化,透澈见底为止;再放入蔗糖22g,容解后,用量筒取大量元素母液100ml、用专用的移液管分别移取微量元素母液10ml ,铁盐母液10ml ,有机物母液10ml 入烧杯中。
甘肃农业大学农学院药用植物组织培养实验指导柳福智编农学院中草药栽培与鉴定教研室2007年8月前言药用植物组织培养实验是根据中草药栽培与鉴定专业的培养要求,为学生开设的一门实验课程。
药用植物组织培养实验的任务是使学生加深对药用植物组织培养基本理论的理解,掌握药用植物组织培养实验的基本操作技能,学习药用植物组织培养实验的基本知识,养成严格、认真和实事求是的科学态度,提高观察、分析和解决问题的能力,为将来参加工作打下良好的基础。
编者2007年8月学生实验守则1、实验前认真预习,领会实验原理,明确本次实验的目的和要求,了解实验步骤和注意事项。
2、实验时要严格按照规范操作进行,仔细观察实验现象,认真记录有关数据。
3、要认真写好实验报告,实验报告要清楚、简练、整洁。
4、学生进入实验室必须严格遵守实验室规则,服从带教老师的指导。
5、爱护实验室的仪器设备,不准将实验室的仪器设备私自带出室外。
6、严格遵守操作规程及实验时应注意的事项,在使用不熟悉其性能的仪器和药品之前,应查阅有关资料或请教指导教师,不要随意进行实验,以免损坏仪器,浪费试剂,使实验失败,更重要的是预防发生意外事故。
7、实验过程中应注意防火灾、防爆炸、防腐蚀、防污染工作,牢固树立“安全第一”意识。
8、实验结束后,一切仪器试剂应放回原处,玻璃仪器要清洗干净,一些有毒、有腐蚀性的废液应倒入废液缸内。
9、实验台面要擦试干净,由值日生负责安全卫生工作,包括清理实验室,检查水、电的开关,清除垃圾和污物,关好门窗后方可离开实验室。
药用植物组织培养实验报告一般包括以下内容和要求:(1)实验名称、实验日期。
(2)实验目的写明通过本实验要达到的训练目的。
(3)实验原理用文字表述本实验的基本原理。
(4)操作步骤简明扼要叙述实验的操作步骤。
(5)实验数据的处理及结果。
(6)问题及讨论应对实验中观察到的现象及实验结果进行分析和讨论,如果实验失败,要寻找失败原因,总结经验教训,以提高自己的基本操作技能。
目录实验一组培室设备参观及器皿的洗涤和灭菌.............实验二母液的制备及培养基的配制、灭菌...............实验三药用植物茎尖培养............................实验四药用植物的花药培养.........................实验五试管苗的移栽...............................实验一组培室设备参观及器皿的洗涤和灭菌一、目的要求:1.通过参观,了解组织培养室的几个主要组成部分和各部分应有的基本设备以及有关仪器的用途与功能。
2.通过实际操作,学会洗涤剂的配制和各种器皿的清洗和灭菌方法。
二、实验内容了解组培室的结构及主要设备的用途和性能是十分必要的,总体上的了解有利于以后各实验的进行以及正确的使用各种仪器和设备。
植物组织培养是一项十分细致的工作,为了保证植物外植体不受污染,第一关就是要对各种器皿进行清洗和消毒,使它们保持无菌状态,做这些工作同样有一套科学的方法和需要熟练的技巧,因此每个学生必须学好这套基本功。
三、实验原理实验仪器的清洗、消毒和灭菌是组织培养成功的关键所在,是外植体免受污染的前提。
由于灭菌剂的种类不同,所以选择消毒剂既要考虑良好的消毒、杀菌作用,同时易被蒸馏水冲洗掉。
四、实验仪器与材料:高压灭菌锅、烘箱、超净工作台、双筒解剖镜、酸度测定仪、空调机、控温仪、百分之一与万分之一天平、电炉、玻璃器皿(试管、三角瓶、移液管、漏斗、烧杯、容量瓶、试剂瓶、量筒酒精灯),以及镊子、解剖刀、解剖针、手术剪,肥皂、洗衣粉、重铬酸钾、浓硫酸等。
五、方法和步骤:首先在老师带领下参观组培室,并听取讲解,然后配制洗液,称取工业用重铬酸钾40克,溶解在500ml在水中,然后徐徐加入450ml粗制浓硫酸(或废硫酸)配好的溶液呈红色,铬酸洗液是一种强氧化剂,去污能力强,但玻璃器皿上沾有油脂、凡士林、石蜡等则用此液无效,铬酸洗液可反复使用,直到溶液呈青褐色为止。
此溶液腐蚀性强,洗涤时需注意。
每人清洗部分玻璃器皿,方法:清水洗净→泡入洗衣粉水溶液中进行洗刷→清水反复冲洗→蒸馏水淋一遍→烘干备用。
然后清洗部分较脏的玻璃器皿,方法:采用先碱后酸,即用洗衣粉洗刷后冲洗干净→晾干→侵入酪酸洗液,浸泡时间视器皿的肮脏程度而定→清水反复冲洗干净→蒸馏水淋洗一遍→烘干备用。
带有石蜡或胶布的器皿:先将其除去,再用常规洗涤,石蜡用水煮沸数次即可去掉,胶布粘着物则需用洗衣粉液煮沸数小时,再用水冲洗,凉干后浸入洗液,以后的步骤同前。
对器皿和用具进行高压灭菌,即用手提式高压灭菌锅,在1.2个大气压下保持15~20分钟。
解剖刀、手术剪、解剖针、镊子等用具在接种前还要用百分之七十的酒精棉球擦一下,再用酒精灯的火焰灭菌,冷却后即可应用。
六、作业:试阐述为什么要对器皿和用具进行严格的洗涤和灭菌?实验二母液的制备及培养基的配制、灭菌一、目的要求:通过掌握培养基对母液制备及常用培养基的配制和灭菌方法,为植物组织培养准备合适的营养条件。
二、实验内容学习母液和培养基的配制,灭菌的方法。
三、实验原理植物材料培养要获得成功,并正常生长,培养基的组成成分是一个决定性因素,不同植物要求不同的培养基,因此,在进行大量工作之前,对不同培养基应进行分析、比较、试验,选择一个符合试验材料需要的适宜培养基。
大多数植物组织培养所用的培养基由无机营养物、碳源、维生素、生长调节物质和有机附加物等五类物质组成。
四、实验仪器与材料高压灭菌锅、冰箱、普通及精密天平、电炉、铝锅、玻璃器皿(烧杯、量微、容量瓶、移液管、试剂瓶、三角瓶、漏斗),化学试剂(CaCl2·2H2O,KNO3,MgSO4·7H2O,NH4NO3,KH2PO4,Na2—EDTA,FeSO4·7H2O,MgSO4·4H2O,ZnSO4·7H2O,H3BO3,KI,NaMoO4·2H2O,CuSO4·5H2O,CoCl2·6H2O,甘氨酸,盐酸硫胺素,盐酸吡哆醇,烟酸,肌醇,蔗糖,琼脂,若干种生长调节物质及天然复合物,HCL,NaOH,酒精),以及称量纸、药匙、玻璃棒、精密度纸,瓶盖用纸,线绳或橡皮筋、铅笔、标签纸。
五、方法和步骤1、母液的配制母液的配制是按所使用药品的类别,而分别配成大量元素、微量元素、维生素和铁盐等。
配制母液时特别要注意无机盐成分在一起,可能产生的化学反应,如Ca2+和SO2-4,Ca2+,Mg2+和PO3-4一起溶解后,会产生硫酸钙或磷酸钙的不溶物沉淀,因此不能配在一起作母液贮存,应分别配制和保存。
配制母液时要用双重蒸馏水等纯度较高的水,药品应采用化学纯或分析纯级,药品的称量及定容都要准确,各种药品先以少量蒸馏水使其充分溶解,然后按培养基上的排列顺序混合。
现以Murashige和Skoog(1962)培养基为例叙述如下:根据各种药品的特点,母液可配成4种。
母液Ⅰ:把大量元素按培养基配方的20倍浓度混合在一起。
KNO338克NH4NO333克MgSO4/7H2O7.4克KH2PO43.4克CaCl2/2H2O8.8克加水定容至1000毫升,配1升培养基时,吸收50毫升,注意CaCl2应待其它度剂彻底溶解后再加入,否则易出现沉淀。
母液Ⅱ:把硼、锌、锰、铜、钴、钼等微量元素,接培养基配方浓度的1000倍浓缩配制在一起。
MnSO4*4H2O22.3gZnSO4*7H2O8.6gH3BO36.2g中心简介师资队伍规章制度实验教学实验指导书教学大纲教学情况信息平台视频教学中心视频介绍设为首页没有推荐文章野生药用植物驯化实验指导甘肃农业大学农学院野生药用植物驯化实验指导陈垣编农学院中草药系2007年8月前言本实验指导是《野生药用植物驯化》课程的配套实验教材,根据本系驯化经验经反复修改、充实编撰而成,其内容包括:野生药用植物种子休药用植物资源调查、野生药用植物种子采集、田间覆盖试验、营养繁殖试物引种观察等,除常规驯化栽培实验外还注意结合高难度名贵稀缺药用植学生实际应用技能,注意突出对学生独立工作能力的训练和培养。
本实验培与鉴定专业本科生实验教学,亦可作为农林等其他有关专业学生及教师编者2007年8月学生实习守则一、学生实验期间不得准无故缺席、迟到、早退。
二、完成每次实验任务后,及时认真撰写实验报告。
三、严禁实验报告相互抄袭,一经发现按当次实验成绩为零计算,并从新四、按各次实验成绩和综合实验成绩计算实验成绩,实验成绩占综合考评五、实验操作要认真细致、数据真实。
六、防止实验设备损坏、因粗心或操作不当造成设备损坏要赔偿。
七、每次实验结束,检查实验室设备关闭,整理放归原处,清洁实验室,离开。
实验报告的基本内容和要求实验报告的基本内容按照实验指导书各次实验作业内容撰写实验报告。
实验报告格式:实验题目实验小组学生姓名(空格间隔)(班级)(甘肃农业大学农学院)一、目的意义二、材料与方法包括材料与资料数据来源、试验方法。
三、结果四、讨论与结论参考文献作者姓名,论文题目,期刊,卷(期),年份:页码目录实验一野生药用植物种子休眠特性的测定...............................................实验二野生药用植物资源调查..................................................................实验三野生药用植物种子采集及贮藏......................................................实验四田间覆盖试验...............................................................................实验五营养繁殖试验...............................................................................实验六高原野生药用植物引种观察........................................................实验一野生药用植物种子休眠特性的测定一、实验目的了解植物种子的休眠特性。
掌握打破种子休眠的方法。
二、实验内容测量植物种子的休眠特性、打破种子的休眠。
三、实验原理(一)休眠机理种子休眠是种子的一种生理现象,是植物长期适应气候变化的结果。
繁衍后代具有深远意义,但对于种子繁殖栽培来说,它无疑给我们造成了子休眠的原因主要有以下几种。
1复被结构的限制复被结构是指胚的外围结构,包括果皮、外果皮、外稃、内稃、颖片乳等。