苯胺的制备
- 格式:doc
- 大小:119.50 KB
- 文档页数:2

实验苯胺的制备
一、实验目的
本实验旨在熟悉苯胺的制备方法,了解苯胺的制备步骤,掌握相关操
作步骤。
二、原理
苯胺是一种由苯和氨结合而成的有机化合物,具有典型的胺类气味,
分子式为C_6H_7N,是苯的加成聚合产物,具有重要的应用价值。
苯胺的
制备是以三苯甲基铵为原料,进行铵的加成聚合,将三苯甲铵经降解以及
脱水形成苯胺的一个过程。
在反应发生之前,原料需要经过混合、烘干、
研磨以及均质等步骤,确保原料的品质以及反应的质量。
三、试剂
实验中需要准备溶剂、去离子水、三苯甲基铵,以及活性炭。
四、实验步骤
1.将三苯甲基铵放入烧瓶中,加入足量的溶剂(乙醚或乙醇),混合
均匀,烘干混合物,放入干燥瓶中,在旋转烘干器中烘干,烘至气干,取出;
2.将烘干的混合物放入研磨机中,加入若干量的活性炭,研磨为细粉,放入烧瓶中,加入足够量的去离子水,在恒温恒温水浴中加热,加热至反
应趋于平稳,控制在70-80℃;
3.将反应液浓缩至1/4,加入足够量的乙醇(乙醚),放入旋转搅拌
器中,搅拌至反应液透明,取出;。
苯胺的用途苯胺是重要的化工原料,主要用于医药和橡胶硫化促进剂,也是制造树脂和涂料的原料。
苯胺对血液和神经的毒性非常强烈,可经皮肤吸收或经呼吸道引起中毒。
一、一、硝基苯铁粉还原法。
该方法是生产苯胺的经典方法。
但是因为设备腐蚀严重,环境污染严重,产品分离困难等缺点,目前正逐渐被其他方法所取代二、硝基苯催化加氢法。
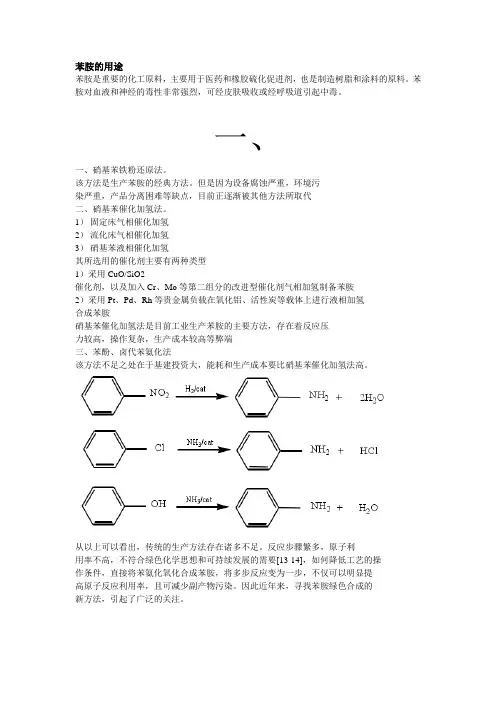
1)固定床气相催化加氢2)流化床气相催化加氢3)硝基苯液相催化加氢其所选用的催化剂主要有两种类型1)采用CuO/SiO2催化剂,以及加入Cr、Mo等第二组分的改进型催化剂气相加氢制备苯胺2)采用Pt、Pd、Rh等贵金属负载在氧化铝、活性炭等载体上进行液相加氢合成苯胺硝基苯催化加氢法是目前工业生产苯胺的主要方法,存在着反应压力较高,操作复杂,生产成本较高等弊端三、苯酚、卤代苯氨化法该方法不足之处在于基建投资大,能耗和生产成本要比硝基苯催化加氢法高。
从以上可以看出,传统的生产方法存在诸多不足。
反应步骤繁多,原子利用率不高,不符合绿色化学思想和可持续发展的需要[13-14],如何降低工艺的操作条件,直接将苯氨化氧化合成苯胺,将多步反应变为一步,不仅可以明显提高原子反应利用率,且可减少副产物污染。
因此近年来,寻找苯胺绿色合成的新方法,引起了广泛的关注。
二、1.1苯胺的生产和需求苯胺是一种重要的有机化工原料、化工产品和精细化工中间体,以苯胺为原料可以制成300多种产品和中间体,具有技术含量高、附加值高、经济效益好等特点,因此广泛应用于染料、农药、医药、橡胶助剂和异氰酸酯(MDI)的生产上,其开发利用前景十分广阔[22]。
近年来,随着MDI、橡胶助剂等行业的发展,苯胺的下游产品需求增长较快,相应带动了苯胺需求和生产的强劲增长,世界苯胺需求大约以年均5%的速度增长。
1.1.1世界苯胺的供需情况苯胺是生产MDI的重要原料,今后对苯胺的需求仍将取决于MDI的需求增长。
上世纪八十年代末,随着西方经济复苏,对MDI需求的不断增加,苯胺生产能力和产量增长很快,从2003年开始,全球MDI的产量以年均约6%的速度增长,其中亚洲的速度增长最快;因此世界各大公司纷纷新建或扩建MDI 生成装置,MDI已经进入了新一轮的快速增长期,MDI产业将随着聚氨酯(PU) 产品的多样化、广泛性以及快速增长的需求而得到快速发展。

苯胺的合成
苯胺(Aniline)是一种重要的有机化合物,通常用于制备各种化学品和材料。
它的合成可以通过多种方法,以下是其中一种常见的方法,即氨化还原苯乙酮的方法:
合成苯胺的步骤如下:
1.氨化苯乙酮(C6H5C(O)CH3):首先,苯乙酮(也称为乙酰苯)与氨气反应,通常在催化剂的存在下。
这个反应通常在高温和高压下进行,通常使用铁或镍作为催化剂。
反应方程式如下:
C6H5C(O)CH3 + NH3 → C6H5NH2 + CH3C(O)NH2
在这个步骤中,苯乙酮中的羰基(C=O)被氨气还原为氨基
(NH2),形成苯胺。
2.分离和提纯:得到的混合物中含有苯胺和未反应的材料。
需
要对混合物进行分离和提纯,通常通过蒸馏或结晶来纯化苯胺。
这是制备苯胺的一种方法,但还有其他方法,如芬顿反应和尼特克反应等。
在实验室或工业生产中,可以根据需要选择最合适的合成方法。
需要注意的是,处理氨气和苯乙酮等化学物质需要谨慎,最好在合适的实验室条件下进行,遵循安全操作规程,以确保安全。


苯胺的制备范文引言:苯胺,又称为苯胺,是一种重要的有机化学物质,广泛应用于医药、染料、橡胶、塑料等工业领域。
苯胺的制备方法有多种,包括氢化还原法、氨解法、氰化物法等。
本文将重点介绍苯胺的制备方法及相关反应机理。
一、氢化还原法制备苯胺氢化还原是常用的一种制备苯胺的方法,反应的主要原料是硝基苯。
其具体反应过程如下:1.氨气与硝基苯反应生成亚硝基苯:C6H5NO2+3H2->C6H5NHNO2+2H2O2.亚硝基苯与二氧化硫反应生成亚硝基苯磺酸酯:C6H5NHNO2+SO2->C6H5NHSO2NO23.亚硝基苯磺酸酯与氢化铝锂(LiAlH4)反应生成苯胺:C6H5NHSO2NO2+4LiAlH4->C6H5NH2+Al2O3+4LiHSO3+4H2这种方法制备的苯胺纯度较高,且反应产物得率高,但反应条件较为复杂。
二、氨解法制备苯胺氨解法是另一种制备苯胺的方法,其步骤如下:1.硝基苯与浓氨水反应生成对硝基苯胺:C6H5NO2+NH3->C6H4NH2NO2+H2O2.对硝基苯胺与氨水和金属为催化剂反应生成苯胺和水:C6H4NH2NO2+2NH3->C6H5NH2+H2O+NH4NO2该方法制备的苯胺纯度较高,但对硝基苯的选择性较差。
三、氰化物法制备苯胺氰化物法也是一种制备苯胺的方法,其步骤如下:1.溴苯与三氯硫脲反应生成苯氨基异硫氰酸叔丁酯:C6H5Br+Cl3SCSNH4->C6H5NCSNHCSNB(C4H9)2+NH4Br+Cl2S2.苯氨基异硫氰酸叔丁酯与氢氰酸反应生成苯胺:C6H5NCSNHCSNB(C4H9)2+HCN->C6H5NH2这种方法制备的苯胺产率较高,但反应条件较为严格,且反应产物纯度较低。
结论:苯胺是一种广泛应用的有机化学物质,其制备方法有氢化还原法、氨解法和氰化物法等多种。
本文重点介绍了这三种方法的步骤和反应机理。
氢化还原法在制备苯胺方面具有高纯度和高产率的优势,但反应条件较为复杂。



苯合成苯胺的合成路线
苯合成苯胺的合成路线如下:
1. 硝化反应:将苯与浓硝酸和浓硫酸的混合物在50-60°C 下反应,得到硝基苯。
2. 还原反应:将硝基苯与铁粉和盐酸的混合物在回流条件下反应,得到苯胺。
总反应式为:
C6H6 + HNO3 → C6H5NO2 + H2O
C6H5NO2 + 3Fe + 6HCl → C6H5NH2 + 3FeCl2 + 2H2O
这个合成路线涉及到两个主要的化学反应:硝化反应和还原反应。
硝化反应将苯转化为硝基苯,而还原反应将硝基苯还原为苯胺。
需要注意的是,这个合成路线中涉及到有毒的浓硝酸和浓硫酸,以及强腐蚀性的盐酸,因此需要在通风良好的实验室中进行操作,并遵循安全操作规程。
此外,还原反应需要在回流条件下进行,需要使用回流装置来控制反应温度和防止反应物的挥发。


苯胺制备原理
苯胺是一种芳香胺,其制备可以通过苯与氨之间的格氏反应来实现。
反应原理如下:
苯胺的制备反应方程式为:
C6H6 + NH3 → C6H5NH2 + H2O
苯和氨在酸性条件下进行反应,生成苯胺和水。
这个反应通常在加热条件下进行,可以使用催化剂来促进反应的进行。
常用的催化剂包括氯化亚铜、氯化铁等。
实际制备过程中,首先将苯和氨加入反应容器中,然后加入酸性催化剂,通常使用浓磷酸。
随后反应混合物进行加热,一般在反应温度为120-150摄氏度范围内进行。
反应进行一段时间后,反应完成,得到苯胺。
最后通过蒸馏、结晶等方法对产物进行纯化。
苯胺是一种重要的有机化工原料,在药物合成、染料合成及橡胶制品等领域有广泛的应用。
其制备过程相对简单,但需要注意操作过程中的安全问题,防止氨气对人体的损害。

苯胺的制备实验报告实验目的:本实验通过亚硝酸钠和苯胺的反应制备苯胺。
实验原理:苯胺分子中含有一个氨基和一个苯环,属于螺旋形分子,其化学式为C6H5NH2。
苯胺的制备是通过亚硝酸钠和苯胺的反应进行的。
亚硝酸钠与醛类或酚类发生反应后生成相应的亚硝基化合物,然后亚硝基化合物再与苯胺反应生成苯胺。
反应的化学式为:NaNO2+HCl→HNO2+NaCl苯胺在自然条件下分子构型为平面构型,其N-C6键的键长为1.415A,N-H键的键长为1.010A,C-C键的键长为1.395A。
实验仪器:亚硝酸钠,苯胺,氢氧化钠,氢氯酸,滴定管,分液漏斗,洗涤瓶,容量瓶,试管等。
实验步骤:1. 在实验开始前,先将实验器材全部清洗干净。
2. 在试管中加入苯胺(4.0g),加入氢氧化钠溶液(5ml),在加热条件下搅拌,使苯胺溶解。
3. 在另一个试管中加入亚硝酸钠(3.0g),加入1ml的水,加热至溶解。
加入冷水稀释至10ml,搅拌均匀。
4. 将1中的溶液滴加入3中的溶液,同时加入一些盐酸调节pH值,搅拌均匀。
5. 将混合物在有冰水的大容量瓶中冷却,搅拌1小时。
在反应过程中,可以看到混合物变为红色,说明生成了亚硝基化合物。
6. 将已经冷却的混合液倒入滴定管中,滴加去离子水至终点,用0.1mol/L的氢氯酸滴定到淡粉色为止。
7. 用洗涤瓶洗净产生的苯胺,进行过滤和蒸馏,得到苯胺作为产物。
实验结果:在对苯胺进行滴定的过程中,所滴加的氢氧化钠消耗了0.8ml,说明亚硝酸钠与苯胺反应得到的亚硝基化合物的生成量为0.8ml。
在将产生的苯胺进行蒸馏过程中,产生了30.5g的苯胺,理论产量为33.8g,实际收率为90.2%,颜色为淡黄色,符合苯胺的颜色特点。
结论:本实验通过亚硝酸钠和苯胺的反应制备了苯胺,成功地完成的实验过程,并得到了符合要求的产物。
同时,本实验的实验过程简单,实验步骤清晰,可作为学生进行实验教学的素材。
苯胺的生产工艺
苯胺的生产工艺主要有两种:氨气萃取法和还原法。
氨气萃取法:此法以苯和氨水为原料,通过氨气溶解苯,再进行加压萃取,重复操作后分离得到苯胺。
该方法的优点在于反应产率高,纯度较高,但需要大量氨水和能耗较高。
还原法:此法以氨水、铁为还原剂,苯作为原料反应产生苯胺。
反应过程需在高温高压下进行,工艺简单,但反应得到的苯胺的纯度和产率较低,且有污染物排放的问题。
通常的生产工艺会结合这两种方法来进行,以达到经济效益和环保标准。
例如,可先用氨气萃取法得到初级苯胺,再经过还原法进一步提高产率和纯度。
甲苯制备苯胺的反应方程式甲苯制备苯胺的反应方程式苯胺是有机合成的重要中间体之一,广泛应用于生产染料、药品、塑料、橡胶等方面。
由于苯胺通常是通过苯或甲苯作为起始原料进行制备的,因此,研究甲苯制备苯胺的反应方程式,对于提高苯胺的产率和质量至关重要。
本文将介绍甲苯制备苯胺的反应方程式以及该反应过程的机理。
甲苯制备苯胺反应方程式甲苯制备苯胺通常采用的方法是甲苯氧化脱氢制备甲苯酐,然后将甲苯酐还原成甲苯,最后将甲苯和氨气反应生成苯胺。
具体反应方程式如下:甲苯氧化脱氢反应:C6H5CH3 + 1/2O2 → C6H5COCH3 + H2O甲苯酐还原反应:C6H5COCH3 + H2 → C6H5CH3 + H2O甲苯和氨气反应生成苯胺:C6H5CH3 + NH3 → C6H5NH2 + H2通过上述三个反应的组合,甲苯可以制备出苯胺。
该反应过程的整体方程式如下:C6H5CH3 + 1/2O2 + NH3 + H2 → C6H5NH2 + H2O甲苯制备苯胺的反应机理甲苯氧化脱氢甲苯氧化脱氢是甲苯制备苯胺反应的第一步,该反应是由催化剂催化下的氧化脱氢反应。
该反应在高温下进行,通常需要将甲苯和氧气送入催化剂床,通过在催化剂表面进行反应,使其转化为甲苯酐。
该反应主要有以下两种机理:第一种机理是在催化剂表面产生活性中间体CH3C6H4OOH,然后发生羟基自由基氧化脱氢,最终生成甲苯酐。
CH3C6H5 + O2 → CH3C6H4OOHCH3C6H4OOH → CH3C6H4O + OHCH3C6H4O → CH3CO + C6H4第二种机理是通过羟基自由基氧化脱氢生成甲苯酐。
在这种机理下,甲苯中的羟基受到氧气的氧化作用,产生自由基羟基,然后自由基羟基进行氧化脱氢,生成甲苯酐。
CH3C6H5 + O2 → CH3C6H4OHCH3C6H4OH → CH3C6H4O + HCH3C6H4O → CH3CO + C6H4甲苯酐还原在甲苯制备苯胺的反应中,还原甲苯酐生成甲苯的反应是一个还原作用。
制备苯胺实验报告制备苯胺实验报告引言:苯胺(Aniline)是一种重要的有机化合物,具有广泛的应用领域,如染料、医药和农药等。
本实验旨在通过还原苯胺硝化物的方法,制备苯胺,并对实验过程和结果进行分析和讨论。
实验方法:1. 实验材料和仪器:- 苯胺硝化物- 还原剂:亚硫酸钠- 碱性溶液:氢氧化钠- 蒸馏水- 烧杯、试管、滴管等实验器材2. 实验步骤:a. 将苯胺硝化物加入烧杯中,加入适量的蒸馏水进行溶解,得到苯胺硝酸盐溶液。
b. 在滴加管中加入亚硫酸钠溶液,缓慢滴加到苯胺硝酸盐溶液中,同时用滴管加入氢氧化钠溶液调节溶液的pH值。
c. 将反应混合物进行搅拌,反应完全后,用蒸馏水洗涤沉淀。
d. 将沉淀过滤,并用蒸馏水洗涤几次,得到苯胺产物。
e. 对苯胺产物进行干燥,称重并记录质量。
实验结果与分析:经过实验,我们成功制备了苯胺,并得到了苯胺产物。
根据实验记录,苯胺的质量为X克。
通过计算,我们可以得到苯胺的产率,即苯胺的实际得率与理论得率之间的比值。
产率计算公式为:产率 = 实际得率 / 理论得率× 100%其中,理论得率是根据反应物的摩尔比例和理论摩尔质量计算得出的,实际得率则是实验中制备的苯胺的质量。
通过比较实际得率和理论得率,我们可以评估实验的成功程度和反应的效率。
若实际得率接近理论得率,说明实验操作正确、反应条件适宜;若实际得率较低,可能存在操作失误或反应条件不理想。
此外,还可以通过物质的纯度来评估实验结果的好坏。
苯胺的纯度可以通过测定其熔点或进行红外光谱分析等方法来确定。
高纯度的苯胺通常具有较高的熔点和特征性的红外吸收峰。
实验中可能存在的误差和改进:在实验过程中,可能会存在一些误差,如溶液的挥发损失、反应不完全等。
这些误差会对实验结果产生一定的影响。
为了减小误差,可以采取以下改进措施:1. 控制反应条件:调节反应温度、反应时间等,以提高反应的完整性。
2. 使用纯度较高的原料:苯胺硝化物的纯度对实验结果的影响较大,选择纯度较高的原料可以提高实验的成功率。
苯胺的制备
一、实验目的
1、1、掌握硝基苯还原为苯胺的原理和实验室法。
2、2、巩固水蒸汽蒸馏和简单蒸馏的基本操作,熟悉萃取分离技能。
二、实验原理
苯胺的制取不可能用任何直接的方法将氨基(-NH2)导入苯环上。
而是经过间接的方法来制取,芳香硝基化合物还原是制备芳胺的主要方法。
实验室常用的方法,是在酸性溶液中用金属进行化学还原。
常用锡-盐酸来还原简单的硝基化合物,也可以用铁-盐酸锡-盐酸法。
NO2
NH2
Sn/HCl
还原
三、实验仪器与药品
三颈烧瓶,回流冷凝管、恒压滴液漏斗、机械搅拌器,Y型管,温度计,分液装漏斗,水蒸气蒸馏装置,油浴加热;硝基苯、还原铁粉、冰醋酸、乙醚、氢氧化钠、精盐等。
四、实验步骤
a、a、安装反应装置,检查装置的气密性;【注意安装装置的先后顺序】
b、b、按实验前预习时自己拟定的方案进行加料,反应,跟踪反应;
c、c、结束反应,进行反应后处理(水蒸汽蒸馏);
d、d、萃取分液溜出液,用蒸馏方法纯化目标产物。
五、操作重点及注意事项
1、本实验是一个放热反应,当每次滴加硝基苯时均有一阵猛烈的反应发生,故要慢慢加入与充分搅拌。
2、硝基苯为黄色油状物,如果回流液中,黄色油状物消失,而转变成乳白色油珠,表示反应已完全。
3、反应完后,圆底烧瓶上粘附的黑褐色物质,用1:1盐酸水溶液温热除去。
4、在20℃时每100gH2O中可溶解3.4g苯胺加粗盐为盐析。
5、本实验用粒状NaOH,干燥,原因是CaCl2与苯胺形成的分子化合物。
6、反应物内的硝基苯与盐酸互不相溶,而这两种液体与固体铁粉接触机会很少,因此充分振摇反应物,是使还原作用顺利进行的操作关键。
六、思考题
1、1、根据什么原理,选择水蒸汽蒸馏把苯胺的反应混合物中分离出来。
2、2、如果最后制得的苯胺中混有硝基苯该怎样提纯?
3、3、反应物变黑时,即表明反应基本完成,欲检验,可吸入反应液滴入盐酸中摇振,
若完全溶解表示反应已完成,为什么?。