(人教版九上)化学课题2氧气(28张)
- 格式:ppt
- 大小:1.38 MB
- 文档页数:29
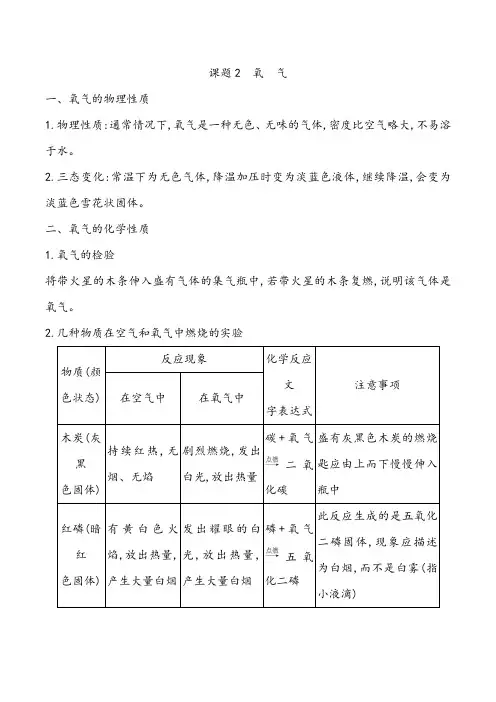
课题2 氧气一、氧气的物理性质1.物理性质:通常情况下,氧气是一种无色、无味的气体,密度比空气略大,不易溶于水。
2.三态变化:常温下为无色气体,降温加压时变为淡蓝色液体,继续降温,会变为淡蓝色雪花状固体。
二、氧气的化学性质1.氧气的检验将带火星的木条伸入盛有气体的集气瓶中,若带火星的木条复燃,说明该气体是氧气。
2.几种物质在空气和氧气中燃烧的实验发出碳+氧气二氧化碳盛有灰黑色木炭的燃烧匙应由上而下慢慢伸入瓶中白,磷+氧气五氧化二磷此反应生成的是五氧化二磷固体为白烟小液滴发出色热生成一种无有刺激性气硫+氧气二氧化硫①硫的用量不能过多防止对空气造成污染②实验前在集气瓶底放少量水的有毒气体火星放出大量生成黑色铁+氧气四氧化三铁①用砂纸打磨过的细铁丝柴②预先放少量水或细沙于瓶底温熔融物使瓶炸裂特别提醒:描述物质在氧气中燃烧的现象时,一般考虑四个方面:(1)物质原来的颜色;(2)对产生的光(火焰或火星)加以描述;(3)放出热量;(4)对生成物的颜色、状态、气味及其他性质加以描述。
三、化合反应与氧化反应1.化合反应化合反应2.氧化反应概念:物质与氧发生的反应叫做氧化反应。
氧气在氧化反应中提供氧,具有氧化性。
注意:氧化反应概念中的“氧”不仅仅是指氧气,也可以是含氧物质中的氧,即氧化反应不一定是物质和氧气的反应,但物质和氧气发生的反应一定属于氧化反应。
3.缓慢氧化有些氧化反应进行得很慢,甚至不容易被察觉,这种氧化叫做缓慢氧化。
如动植物的呼吸、食物的腐烂等。
氧化反应包括剧烈氧化和缓慢氧化两种。



课题二——氧气【知识要点】1. 氧气的物理性质(1)在通常情况下,氧气是一种、的气体;(2)在标准状况下,氧气(4)液态与固态的氧气颜色均为。
的密度比空气略;(3)溶于水;2.氧气的化学性质氧气是一种化学性质比较活泼的气体,在点燃或加热等条件下,能跟多种物质发生化学反应,并放出热量。
(提示:氧气可以帮助其他可燃物质燃烧,具有助燃性,但本身却不能燃烧,即不具有可燃性。
)氧气与一些物质的反应现象如下表:提示:碳、硫、磷、铁在氧气中燃烧的现象总结;红热木炭,复燃燃烧,发出白光,温度很高。
燃硫入氧,燃烧更旺,火焰蓝紫,美丽漂亮,生成气体,气味够呛。
燃磷入氧,现象难忘,浓厚白烟,冷却粉状。
铁丝燃烧,火星四射,生成熔物,固态黑色。
3.化合反应与氧化反应(1)化合反应:由或以上物质生成物质的反应叫做化合反应。
可以表示为:A+B→AB 。
即“多”变“一”。
(2)氧化反应:物质与发生的化学反应。
(3)缓慢氧化:有的氧化反应进行得很缓慢,甚至不易被察觉。
比如动植物的作用,食物的,酒和醋的酿造等。
【要点分析】1.实验过程中盛有硫(或碳)的燃烧匙应该自上而下缓慢伸入集气瓶中,这是因为如果盛有硫(或碳)的燃烧匙伸入集气瓶中的速度过快,则硫(或碳)燃烧放出的热量会使氧气受热,体积迅速膨胀而排出;生成的二氧化硫(或二氧化碳)也会把中部及上部的尚未起反应的氧气排出,导致反应时间缩短,现象不明显,不利于观察,甚至硫(或碳)会因为缺养而熄灭。
2.在做铁丝燃烧实验时,要注意注意以下操作:(1)预先在集气瓶里装少量水或铺一层细沙(防止熔化物溅落下来炸裂瓶底);(2)待火柴即将燃尽时再将铁丝伸入盛氧气的集气瓶中(以免火柴梗的燃烧消耗过多的氧气,而影响铁丝燃烧);(3)把光亮的细铁丝绕成螺旋状(为了增大铁丝与氧气的接触面积,集中吸收火柴燃烧放出的热量);(4)绕成螺旋状的铁丝一端系上一根火柴(目的是以火柴梗燃烧放出的热量给铁丝加热,达到铁丝在氧气中燃烧时所需的最低温度,使反应能够持续进行直至反应完全。


人教版化学九年级上册《第二单元课题2氧气》教案一. 教材分析氧气是人教版化学九年级上册第二单元的重要课题,主要介绍了氧气的性质、制法、用途以及与人类生活的关系。
通过学习本课题,学生能够掌握氧气的化学性质,了解氧气的制法,认识氧气在生产、生活中的重要作用,从而提高学生的科学素养。
二. 学情分析九年级的学生已具备一定的化学基础知识,对实验现象有一定的观察和分析能力。
但部分学生对氧气的性质和制法理解不深,难以将理论知识与实际应用联系起来。
因此,在教学过程中,要关注学生的个体差异,引导学生通过实验、讨论等方式,深入理解氧气的性质和用途。
三. 教学目标1.知识与技能:了解氧气的性质、制法,掌握氧气的用途;2.过程与方法:通过实验、讨论等途径,培养学生的观察能力、分析能力及实践能力;3.情感态度与价值观:激发学生对化学学科的兴趣,认识氧气在生产、生活中的重要性,提高学生的科学素养。
四. 教学重难点1.氧气性质的理解和应用;2.氧气的制法及实验操作。
五. 教学方法1.采用实验法、讨论法、讲授法等,以实验为主线,引导学生探究氧气的性质;2.通过案例分析、小组讨论等方式,使学生了解氧气在生产、生活中的应用;3.利用多媒体辅助教学,增强学生对氧气性质和制法的直观理解。
六. 教学准备1.实验室用具:氧气制取装置、实验药品、实验仪器等;2.多媒体课件:介绍氧气性质、制法及应用的图片、视频等;3.教学素材:相关案例、讨论题目等。
七. 教学过程1.导入(5分钟)利用多媒体展示氧气的自然现象,如闪电、呼吸等,引导学生思考:这些现象与氧气有什么关系?从而激发学生的学习兴趣。
2.呈现(10分钟)介绍氧气的化学性质,如支持燃烧、供给呼吸等,并通过实验现象展示氧气的性质。
同时,讲解氧气的制法,如分解过氧化氢、加热高锰酸钾等。
3.操练(15分钟)学生分组进行实验,亲身体验氧气的制法和性质。
教师巡回指导,解答学生疑问。
4.巩固(10分钟)学生通过填空、问答等形式,巩固所学知识。



第二单元 课题2氧气初中化学九年级上册 RJ学习目标1.认识氧气能与许多物质发生化学反应,氧气的化学性质比较活泼;2.认识化合反应、氧化反应;3.学会描述化学反应中的一些反应现象。
新知导入水中溶解了氧气让鱼儿能在水中生存,而氧气的这个用途是由它的性质来决定的。
你能说出氧气的一些性质吗?知识点1 氧气的性质新知探究通常状况下,氧气是无色、无味的气体,密度比空气略大,不易溶于水。
无色气体淡蓝色液体101kPa -183℃三态变化:淡蓝色固体(雪花状)物理性质101kPa -218℃加压贮存在蓝色钢瓶中。
氧气的检验方法:将带火星的木条伸入集气瓶内。
现象:木条复燃。
各种物质在空气中和氧气中燃烧的现象一样吗?硫在空气中与氧气中燃烧发出微弱的淡蓝色火焰,放出热量,生成有刺激性气味的气体。
表达式:硫 + 氧气 二氧化硫点燃氧气中发出明亮的蓝紫色火焰,放出热量,生成有刺激性气味的气体。
空气中硫在空气与氧气中燃烧的实验现象实验时集气瓶中为什么要放少量水资料提示:二氧化硫是一种无色、有刺激性气味的有毒气体,易溶于水且与水反应,与水蒸气结合会产生酸雨,是大气污染物之一。
实验时集气瓶中水的作用:吸收二氧化硫,减少空气污染。
木炭在空气中与氧气中燃烧持续红热,放出热量,生成能使澄清石灰水变浑浊的气体。
表达式:碳 + 氧气 二氧化碳点燃氧气中剧烈燃烧,发出白光,放出热量,生成能使澄清石灰水变浑浊的气体。
空气中木炭在空气与氧气中燃烧的实验现象中,确保木炭与氧气充分反应,现象明显。
铁丝在氧气中燃烧红热,不能燃烧。
表达式:铁 + 氧气 四氧化三铁点燃铁丝在氧气中燃烧的实验现象:剧烈燃烧,火星四射,放出热量,生成黑色固体。
铁丝在空气中燃烧的实验现象:回顾实验,思考以下操作的原因①实验前铁丝需打磨:除去铁丝表面的铁锈,有利于铁丝和氧气反应。
②将铁丝绕成螺旋状:增大铁丝的受热面积,有利于铁丝持续燃烧。
③铁丝下端系一根火柴:引燃铁丝。
④待火柴即将燃尽时再将铁丝伸入集气瓶中:防止火柴燃烧消耗集气瓶中过多的氧气而使铁丝燃烧现象不明显。


人教版(2024)初中化学九年级上册《课题2 氧气》教学设计一、教材分析《课题2 氧气》是人教版初中化学九年级上册的重要内容,主要介绍了氧气的性质、制备以及氧气在生活和工业中的应用。
这一章节是学生初次系统接触非金属元素,对于理解和掌握化学元素的性质和变化规律具有基础性作用。
二、教学目标1. 知识与技能:-学生能掌握氧气的基本性质,如物理性质、化学性质等。
-学生能理解并掌握氧气的实验室制备方法。
-学生能应用氧气的性质解释一些生活现象。
2. 过程与方法:-通过实验观察,培养学生的观察、分析和归纳能力。
-通过小组讨论,提高学生的合作学习和问题解决能力。
3. 情感态度与价值观:-培养学生对化学实验的兴趣和好奇心。
-增强学生对科学探究的尊重和科学精神的理解。
三、教学重难点教学重点:氧气的性质(包括物理性质和化学性质)及其应用。
教学难点:理解并解释氧气在化学反应中的作用,以及实验室制备氧气的原理和步骤。
四、教学过程(一)、导入新课1. 情境引入:展示一段关于太空探索的视频,如宇航员在太空中如何呼吸的片段,然后提问:“宇航员在没有空气的太空中如何生存?”引导学生思考氧气的重要性。
2. 回顾旧知:回顾八年级下册学习的空气成分,特别是氧气的占比,引出氧气在我们生活中的无处不在。
(二)、新知探究1. 氧气的性质:通过PPT展示氧气的物理性质和化学性质,如无色无味、不易溶于水、支持燃烧等,同时结合实验视频加深理解。
2. 氧气的制取:介绍实验室制取氧气的反应原理,如加热高锰酸钾或分解过氧化氢等方法,解释其背后的化学反应。
3. 氧气的应用:讨论氧气在医疗、工业、科研等领域的应用,让学生理解化学知识的实际价值。
(三)、实践操作1. 安全提示:讲解实验安全知识,如正确佩戴实验服和护目镜,正确操作实验器材等。
2. 实验操作:指导学生进行氧气的实验室制取实验,观察并记录实验现象,如氧气的收集、颜色变化等。
3. 实验讨论:让学生分享实验过程中的观察结果,讨论为什么会有这些现象,进一步理解氧气的性质。
课题2 氧气【夯实基础】一、氧气的性质(一)氧气物理性质:1、无色、无味的气体,不易溶于水;密度比空气大。
2、氧气的液体状态是蓝色液体。
固体状态是淡蓝色雪花。
3、工业生产的氧气,一般加压贮存在蓝色钢瓶中。
(二)氧气化学性质1、氧气可以使带火星的木条复燃。
2、硫与氧气反应(1)、现象:空气中:发出淡蓝色火焰,生产刺激性气味的气体,放热。
氧气中:明亮蓝紫色火焰,生产刺激性气味的气体,放热。
(2)原理:硫+氧气二氧化硫(3)主要事项:在瓶底加少量水,吸收二氧化硫,防止污染。
(二氧化硫有毒且易溶于水)3、木炭与氧气反应(1)、现象:空气中:发红光,放热,生成使澄清石灰水变浑浊的气体;氧气中:发白光,放热,生成使澄清石灰水变浑浊的气体。
(2)原理:碳+氧气二氧化碳4、铁丝与氧气反应(1)、现象:空气中:变红热,不燃烧;氧气中:剧烈燃烧,火星四射,放热,生产黑色物质。
(2)原理:铁+氧气四氧化三铁(3)主要事项:铁丝用砂纸打磨(除去表面的氧化物);在铁丝一端系一根火柴棒(引燃);铁丝绕成螺旋状(增大受热面积,预热未燃烧的的铁丝);在瓶底加少量水或铺一层细沙(防止高温生成物使集气瓶炸裂);燃着的铁丝不能接触瓶壁(防止炸裂瓶壁);分析:铁丝不燃烧的原因:氧气不纯净;铁丝未打磨表面的氧化物;5、木炭和硫在空气中反应与在氧气中反应剧烈程度明显不同,为什么?物质燃烧的剧烈程度与氧气的浓度有关,氧气的含量越高,燃烧就越剧烈。
二、化合反应与氧化反应1、化合反应是指由两种或两种以上物质生成另一种物质的反应。
例如:硫、铁、和木炭的燃烧都是化合反应。
2、氧化反应是指物质与氧气发生的反应。
例如:硫、铁、和木炭的燃烧都是化合反应。
3、缓慢氧化是指进行的很慢,不易被察觉的氧化反应。
例如:动植物呼吸、食物腐烂、酒和醋的酿造和钢铁生锈等。
【典型考题】2020四川广安】“新冠”重症患者需要使用呼吸机来为其提供氧气,下列关于氧气的描述错误的是( )A.在通常状况下,氧气是一种无色、无味的气体B.氧气在低温、高压时能变为液体或固体C.氧气极易溶于水D.隔绝氧气能达到灭火的目的【答案】C【解析】A、在通常状况下,氧气是一种无色、无味的气体,说法正确,不符合题意;B、在压强为101kPa时(即一个标准大气压),氧气在-183时时变为蓝色液体,在-218时时会变成淡蓝色雪花状的固体,说法正确,不符合题意;C、氧气不易溶于水,符合题意;D、燃烧的条件是:可燃物、空气(或氧气)、达到燃烧所需的着火点,故隔绝氧气可以达到灭火的目的,不符合题意。