人教版九年级化学氧气的制取
- 格式:doc
- 大小:354.93 KB
- 文档页数:5






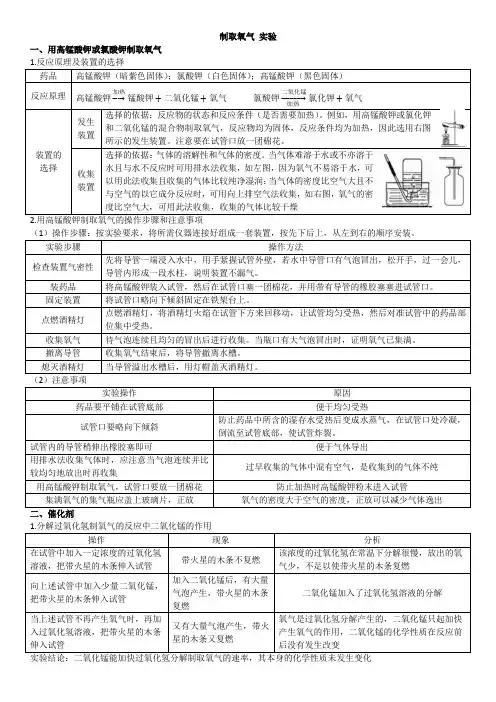
制取氧气实验一、用高锰酸钾或氯酸钾制取氧气药品高锰酸钾(暗紫色固体);氯酸钾(白色固体);高锰酸钾(黑色固体)反应原理高锰酸钾加热→锰酸钾+二氧化锰+氧气氯酸钾二氧化锰→氯化钾+氧气装置的选择发生装置选择的依据:反应物的状态和反应条件(是否需要加热)。
例如,用高锰酸钾或氯化钾和二氧化锰的混合物制取氧气,反应物均为固体,反应条件均为加热,因此选用右图所示的发生装置。
注意要在试管口放一团棉花。
收集装置选择的依据:气体的溶解性和气体的密度。
当气体难溶于水或不亦溶于水且与水不反应时可用排水法收集,如左图,因为氧气不易溶于水,可以用此法收集且收集的气体比较纯净湿润;当气体的密度比空气大且不与空气的以它成分反应时,可用向上排空气法收集,如右图,氧气的密度比空气大,可用此法收集,收集的气体比较干燥2.用高锰酸钾制取氧气的操作步骤和注意事项实验步骤操作方法检查装置气密性先将导管一端浸入水中,用手紧握试管外壁,若水中导管口有气泡冒出,松开手,过一会儿,导管内形成一段水柱,说明装置不漏气。
装药品将高锰酸钾装入试管,然后在试管口塞一团棉花,并用带有导管的橡胶塞塞进试管口。
固定装置将试管口略向下倾斜固定在铁架台上。
点燃酒精灯点燃酒精灯,将酒精灯火焰在试管下方来回移动,让试管均匀受热,然后对准试管中的药品部位集中受热。
收集氧气待气泡连续且均匀的冒出后进行收集。
当瓶口有大气泡冒出时,证明氧气已集满。
撤离导管收集氧气结束后,将导管撤离水槽。
熄灭酒精灯当导管溢出水槽后,用灯帽盖灭酒精灯。
(2)注意事项实验操作原因药品要平铺在试管底部便于均匀受热试管口要略向下倾斜防止药品中所含的湿存水受热后变成水蒸气,在试管口处冷凝,倒流至试管底部,使试管炸裂。
试管内的导管稍伸出橡胶塞即可便于气体导出用排水法收集气体时,应注意当气泡连续并比较均匀地放出时再收集过早收集的气体中混有空气,是收集到的气体不纯用高锰酸钾制取氧气,试管口要放一团棉花防止加热时高锰酸钾粉末进入试管集满氧气的集气瓶应盖上玻璃片,正放氧气的密度大于空气的密度,正放可以减少气体逸出操作现象分析在试管中加入一定浓度的过氧化氢溶液,把带火星的木条伸入试管带火星的木条不复燃该浓度的过氧化氢在常温下分解很慢,放出的氧气少,不足以使带火星的木条复燃向上述试管中加入少量二氧化锰,把带火星的木条伸入试管加入二氧化锰后,有大量气泡产生,带火星的木条复燃二氧化锰加入了过氧化氢溶液的分解当上述试管不再产生氧气时,再加入过氧化氢溶液,把带火星的木条伸入试管又有大量气泡产生,带火星的木条又复燃氧气是过氧化氢分解产生的,二氧化锰只起加快产生氧气的作用,二氧化锰的化学性质在反应前后没有发生改变加热2.验证某物质可做某反应催化剂的方法(1)称取一定量的某物质,记录质量m1。


收集装置发生装置第7讲氧气的制取考点一、实验室制取氧气【知识梳理】1.过氧化氢(双氧水)制取氧气【实验原理】常温下,过氧化氢缓慢分解,在加入二氧化锰(MnO 2)时,加速分解。
【化学反应文字表达式】过氧化氢二氧化锰水+氧气H 2O 2MnO 2H 2O +O 2【实验设计】实验①:在试管中加入5mL ,5%的过氧化氢溶液,把带火星的木条伸入试管,观察木条是否复燃。
实验②:向上述试管中加入少量二氧化锰,把带火星的木条伸入试管,观察木条是否复燃。
【实验现象及分析】实验编号现象原因①带火星的木条不能复燃放出的氧气量太少②带火星的木条复燃过氧化氢溶液中加少量二氧化锰后分解速率加快2.加热氯酸钾分解制取氧气【实验原理】加热情况下,氯酸钾能缓慢分解出氧气,在加入二氧化锰(MnO 2)时,加速分解。
【实验仪器】如图所示:试管、酒精灯、铁架台、单孔塞、玻璃导管、塑胶管、水槽、集气瓶。
【实验药品】氯酸钾(KClO 3)和二氧化锰(MnO 2)粉末。
【化学反应文字表达式】氯酸钾氯化钾+氧气KClO 3KCl+O 2↑实验①实验②白色固体白色固体加热二氧化锰−−−→−∆−−→−2O n M棉花3.加热高锰酸钾分解制取氧气【实验原理】加热情况下,高锰酸钾能较快地分解出氧气。
【实验仪器】如图所示:同氯酸钾的分解实验。
【实验药品】高锰酸钾(KMnO 4)粉末。
【化学反应文字表达式】高锰酸钾锰酸钾+二氧化锰+氧气KMnO 4K 2MnO 4+MnO 2+O 2↑【例题精讲】1.某学生在实验室设计了五种制取氧气时使用药品的方案,其中可行的是()①用氯酸钾和二氧化锰混合加热②将氯酸钾加热③将高锰酸钾加热④将高锰酸钾和氯酸钾混合加热⑤将二氧化锰加热A .①②③B .③④⑤C .①③④D .②③⑤答案:C2.用过氧化氢溶液制取氧气时,常常加入二氧化锰,下列叙述正确的是()A .放出的氧气更多B .放出氧气更快C .放出的氧气更纯D .反应后二氧化锰的质量变小答案:B3.下列物质中含有氧气的是()A .二氧化锰B .氯酸钾C .空气D .氧化镁答案:C4.请写出实验室制取氧气的三个反应原理的文字表达式①_______________________________________________②③。


第二单元我们周围的空气课题3 制取氧气(讲学)课标定位1.了解实验室制取氧气的主要方法和原理2.练习连接仪器的基本操作,动手制取氧气,并试验氧气的化学性质3.认识分解反应、催化剂和催化作用4.通过制取氧气并试验氧气的化学性质的实验,初步了解通过化学实验制取新物质的方法,体验实验过程及实验成功的快乐,并学习分析实验中出现的问题。
知识梳理知识点一、制取氧气知识在线实验室制氧气:1.实验药品:过氧化氢溶液、高锰酸钾、氯酸钾和二氧化锰。
2.实验原理:(1)过氧化氢水+氧气。
(2)高锰酸钾锰酸钾+二氧化锰+氧气。
(3)氯酸钾氯化钾+氧气。
3.实验装置:(1)用过氧化氢溶液和二氧化锰制氧气时:固-液不加热型(如下图)。
用过氧化氢制取氧气(2)用高锰酸钾或氯酸钾和二氧化锰制氧气时:固-固加热型(如下图)。
说明:用高锰酸钾制氧气的装置中应在试管口放一团棉花,目的是防止加热时高锰酸钾粉末进入导管。
4.收集方法:(1)由于氧气不易溶于水,可用排水法收集。
(2)由于氧气的密度比空气的大,可用向上排空气法收集。
5.检验方法:将带火星的木条伸入集气瓶内,如果木条复燃,证明该瓶内的气体是氧气。
6.验满方法:(1)用向上排空气法收集时,将带火星的木条放在集气瓶口,如果木条复燃,说明该瓶内的氧气已满。
(2)用排水法收集时,当有大气泡从瓶口冒出时,说明该瓶内的氧气已满。
7.操作步骤:用高锰酸钾制取氧气并用排水集气法收集气体的一般步骤为:a.组装好仪器并检查装置的气密性;b.将药品装入试管并在试管口堵上一团棉花,用带导管的单孔橡皮塞塞紧试管;c.将试管固定在铁架台上;d.集气瓶里装满水并倒放在水槽中;e.点燃酒精灯,先预热试管,再对准药品处加热;f.用排水法收集氧气;g.收集完毕,将导管撤管撤离水槽;h.熄灭酒精灯。
工业制氧气:1.方法:分离液态空气法。
2.原理:利用液态空气中液氮和液氧的沸点不同,采用低温蒸发的方法,使氮气先分离出来,剩余的主要是液态氧。
哪里不会,记哪里 把每一份努力都用在刀刃上!第二单元 我们周围的空气 课题3 制取氧气基础知识清一、实验室制取氧气的方法1实验室加热高锰酸钾(暗紫色固体)或加热氯酸钾(白色固体)和二氧化锰(黑色粉末状固体)混合物制取氧气1、 反应原理高锰酸钾 →锰酸钾 + 二氧化锰 + 氧气 KMnO 4 →K 2MnO 4 + MnO 2 + O 2氯酸钾 → 氯化钾 +氧气 KClO 3→ KCl + + O 2 2、 实验装置 实验装置分为发生装置和收集装置(1)发生装置——)固体和固体之间需要加热的反应采用如图所示的发生装置。
高锰酸钾、氯酸钾和二氧化锰都是固体;反应需要加热,故采用此种装置。
加热高锰酸钾制氧气 加热氯酸钾和二氧化锰制氧气特别提醒:加热高锰酸钾制氧气时,要在试管口放一小团棉花,防止加热时高锰酸钾粉末进入导管。
试管口略向下,防止冷凝水倒流至试管底部使试管炸裂。
(2)收集装置——①排水法——凡是难溶或微溶于水且不与水发生反应的气体都可以用此法收集操作时注意事项:集气瓶中要预先装满水,用玻璃片盖住瓶口,倒立于水槽中,注意集气瓶内不要留有空气。
排水法收集气体时,实验刚开始产生气泡不能立即收集(最先排放出来的是空气),当集气瓶中的水排完, ②排空气法向上排空气法 向下排空气法加热加热(3)多功能瓶的使用 ②)如图①:密度大于空气的气体从)先将瓶内装满水,气体从)如果要测定某气体的体积,特别提醒:①仪器的组装要按先下后上、从左到右的顺序进行;②药品平铺在试管底部的目的是增大受热面积,便于均匀受热;③试管口放一团棉花是为了防止加热时高锰酸钾粉末进入导管;④试管内的导管略露出橡胶塞即可,便于气体导出;⑤试管口略向下倾斜是为了防止冷凝水回流使试管炸裂;⑥集气瓶充满水后盖上毛玻璃片,倒放在水槽中;⑦应注意当导管口有气泡连续并比较均匀冒出时,才能收集氧气,否则收集的氧气中混有空气;⑧集满氧气的集气瓶应盖上玻璃片,正放,因为氧气的密度比空气的略大,正放可减少氧气逸散;⑨停止加热时,应先将导管从水槽中撤出,再熄灭酒精灯,以防止水槽中的水倒吸,炸裂试管。
第二章我们周围的空气第三节制取氧气学习目标1、理解并掌握实验室制取氧气的原理2、理解并掌握制取气体的装置选择3、催化剂的概念和特点4、掌握气体的收集方法知识集结知识元实验室制取氧气的反应原理知识讲解1.用高锰酸钾、氯酸钾制取氧气(1)药品:高锰酸钾(暗紫色固体)、氯酸钾(白色固体)与二氧化锰(黑色粉末)(2)原理:①加热氯酸钾(有少量的二氧化锰):表达式:氯酸钾(KClO3)氯化钾(KCl)+ 氧气(O2)注意:MnO2在该反应中是催化剂,起催化作用②加热高锰酸钾:表达式:高锰酸钾(KMnO4)锰酸钾(K2MnO4)+ 二氧化锰(MnO2)+ 氧气(O2)(3)装置:加热固体制气体(加热氯酸钾的为一类)(4)操作步骤:(连)查、装、定、点、收、离、熄。
①连接装置:先下后上,从左到右的顺序。
②检查装置的气密性:将导管的一端浸入水槽中,用手紧握试管外壁,若水中导管口有气泡冒出,证明装置不漏气。
松开手后,导管口出现一段水柱。
③装入药品:按粉末状固体取用的方法(药匙或纸槽)④固定装置:固定试管时,试管口应略向下倾斜;铁夹应夹在试管的中上部⑤加热药品:先使试管均匀受热,后在反应物部位用酒精灯外焰由前向后加热。
⑥收集气体:a.若用排水集气法收集气体,当气泡均匀冒出时再收集,刚排出的是空气;水排完后,应用玻璃片盖住瓶口,小心地移出水槽,正放在桌面上(密度比空气大)(防止气体逸出)b.用向上排空法。
收集时导管应伸入集气瓶底部(为了排尽瓶内空气)用排水法收集时,导管放在集气瓶口⑦先将导管移出水面⑧再停止加热(5)易错事项:a)试管口要略微向下倾斜:防止生成的水回流,使试管底部破裂。
药品应平铺在试管底部b)导气管伸入发生装置内要稍露出橡皮塞:有利于产生的气体排出。
c)用高锰酸钾制取氧气时,试管口塞一团棉花:防止高锰酸钾粉末进入导气管,污染制取的气体和水槽中的水。
d)排气法收集气体时,导气管要伸入接近集气瓶底部:有利于集气瓶内空气排出,使收集的气体更纯。
−→−∆氧气的制取
【一】作业评讲,上节课内容回顾。
【二】教学内容
教学目标:
1、实验室制取氧气的原理
2、催化剂
3、分解反应
4、实验室制取氧气的方法
重难点分析:
催化剂及氧气制取原理
【知识梳理】
知识点一 实验室制取氧气的原理
实验室制取氧气的常用方法:
1.分解过氧化氢(H 2O 2)溶液
2.加热氯酸钾(KClO 3)和二氧化锰(MnO 2)的混合物
3.加热高锰酸钾(KMnO 4)
【思考】用哪一种药品制取氧气最好?
【例题】实验室制取氧气,不宜选用的药品是( )
A .高锰酸钾
B .氯酸钾
C .过氧化氢
D .氧化汞
【例题】从安全、环保、节能、简便等方面考虑,实验室制取
氧气的最佳方法是( )
A .通电使水分解:水−→−通电氢气+氧气
B .过氧化氢催化分解:过氧化氢 −−→−2
MnO 水+氧气 C .高锰酸钾加热分解:高锰酸钾 锰酸钾+二氧化锰+氧气
D .氯酸钾加热分解:氯酸钾
氯化钾+氧气
【练习1】实验室制取氧气可以选用的方法是()
①加热高锰酸钾制取氧气②加热氧化汞制取氧气③用过氧化氢溶液与二氧化锰混合制取氧气
④分离液态空气制取氧气⑤加热氯酸钾和二氧化锰的混合物制取氧气⑥电解水制取氧气
A.①②③⑤B.①③⑤⑥
C.①③⑤D.②④⑥
【练习2】实验室制取氧气的化学反应原理:
(1)实验室在常温下可以用________________________________制取氧气,
该反应的文字表达式是:____________________________________;
(2)实验室也可以用加热纯净物的方法制取氧气,该反应的文字表达式是:
_______________________________________________________________________
_;
(3)实验室还可以用加热______________固体混合物的方法制取氧气,
该反应的文字表达式是:_________________________ ;
(4)上述三个反应的基本反应类型是______________,三个反应中都涉及二氧化锰,
其分别为:________、________、________,从安全、环保、节能、简便等角度考虑,
实验室制取氧气的最佳方法是_____________________________.
知识点二催化剂
【例题】有关催化剂的说法无错误的是( )
A.反应前后本身质量不变
B.反应前后性质不变
C.一定加快化学反应速率
D.使用催化剂可以得到更多的生成物
【练习1】下列对催化剂描述正确的是( )
A.任何化学反应都需要催化剂
B.催化剂在反应前后本身的质量发生了变化
C.只有分解反应才需要催化剂
D.某些化学反应可以有多种催化剂
【练习2】小斌用加热氯酸钾的方法制取氧气时,错把高锰酸钾当作二氧化锰放入试管内,与加热纯净的氯酸钾相比,其结果是( )
A.反应速率不变,生成氧气的质量不变
B.反应速率不变,生成氧气的质量增加
C.反应速率加快,生成氧气的质量不变
D.反应速率加快,生成氧气的质量增加
知识点3 分解反应
分解反应:由一种反应物生成两种或两种以上其他物质的反应。
温馨提示:化合反应与分解反应的特点可以表示如下:
化合反应:A+B AB
分解反应;AB A+B
【例题】下列反应中,属于分解反应的是()
A.汞+氧气加热氧化汞
B.碳酸钙高温氧化钙+二氧化碳
C.石蜡+氧气点燃二氧化碳+水
D.碳酸钙+盐酸氯化钙+水+二氧化碳
【练习1】下列方法都可用于制取氧气,但其中不属于分解反应的是()
A.通过分离液态空气制取氧气
B.用过氧化氢溶液和二氧化锰制取氧气
C.加热高锰酸钾制取氧气
D.用氯酸钾与二氧化锰制取氧气
【练习2】下列反应中,既不是化合反应,又不是分解反应的是()
A.氧化钙+水氢氧化钙
B.碳酸水+二氧化碳
C.酒精+氧气点燃水+二氧化碳
D.铁+氧气点燃四氧化三铁
知识点4 实验室制取氧气的方法
高锰酸钾制取氧气
1.制取装置
2.收集装置
排水法(氧气不易溶于水)向上排空气法(氧气不与空
气中的成分反应,且密度比空
气大)
3.实验步骤
(1)连接装置,检查装置气密性
(2)装药品
(3)固定装置
(4)点燃酒精灯加热
(5)收集气体
(6)把导管移出水面
(7)熄灭酒精灯
4.验满方法
(1)用排水法收集:当集气瓶的一侧有气泡放出时,证明已收集满
(2)用向上排空气法收集:将带火星的木条放在集气瓶口,若木条复燃,证明已收集满5.放置方法
正放在桌子上,并盖上毛玻璃片
【例题】下图是有关氧气的收集和检验的实验操作,其中正确的是( )
【练习1】根据下列装置图,回答有关问题:
(1)写出装置图中标号仪器的名称:a__________; b__________。
(2)写出实验室用过氧化氢制取氧气的文字表达式,可选用的发生装置是________(填字母)。
(3)若使用高锰酸钾制取氧气,可选用的发生装置是________(填字母)。
(4)选用D装置收集氧气的原因是
________________________________________________________________________。