化学溶液的酸碱性
- 格式:docx
- 大小:14.94 KB
- 文档页数:1


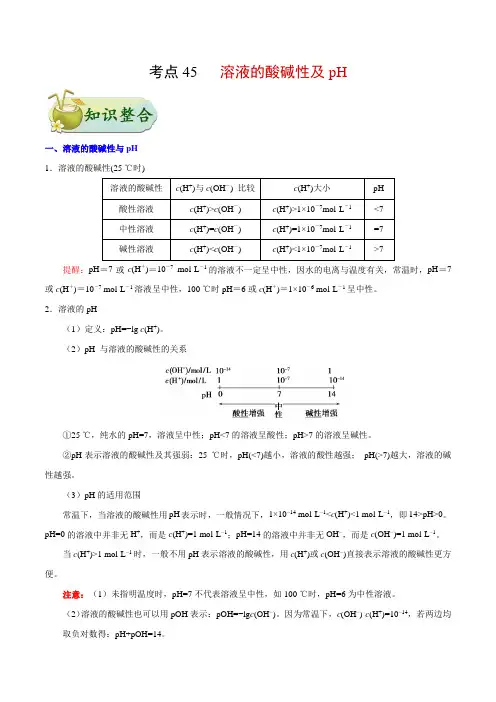
考点45 溶液的酸碱性及pH一、溶液的酸碱性与pH1.溶液的酸碱性(25 ℃时)溶液的酸碱性c(H+)与c(OH-) 比较c(H+)大小pH酸性溶液c(H+)>c(OH-) c(H+)>1×10-7mol·L-1<7中性溶液c(H+)=c(OH-) c(H+)=1×10-7mol·L-1=7碱性溶液c(H+)<c(OH-) c(H+)<1×10-7mol·L-1>7 提醒:pH=7或c(H+)=10-7mol·L-1的溶液不一定呈中性,因水的电离与温度有关,常温时,pH=7或c(H+)=10-7 mol·L-1溶液呈中性,100 ℃时pH=6或c(H+)=1×10-6 mol·L-1呈中性。
2.溶液的pH(1)定义:pH=−lg c(H+)。
(2)pH 与溶液的酸碱性的关系①25 ℃,纯水的pH=7,溶液呈中性;pH<7的溶液呈酸性;pH>7的溶液呈碱性。
②pH表示溶液的酸碱性及其强弱:25 ℃时,pH(<7)越小,溶液的酸性越强;pH(>7)越大,溶液的碱性越强。
(3)pH的适用范围常温下,当溶液的酸碱性用pH表示时,一般情况下,1×10−14 mol·L−1<c(H+)<1 mol·L−1,即14>pH>0。
pH=0的溶液中并非无H+,而是c(H+)=1 mol·L−1;pH=14的溶液中并非无OH−,而是c(OH−)=1 mol·L−1。
当c(H+)>1 mol·L−1时,一般不用pH表示溶液的酸碱性,用c(H+)或c(OH−)直接表示溶液的酸碱性更方便。
注意:(1)未指明温度时,pH=7不代表溶液呈中性,如100 ℃时,pH=6为中性溶液。
(2)溶液的酸碱性也可以用pOH表示:pOH=−lg c(OH−)。


初中化学《溶液的酸碱性》教案一、教学目标:1. 让学生了解溶液的酸碱性的概念及其相关知识。
2. 培养学生通过实验观察和分析问题的能力。
3. 培养学生运用化学知识解决实际问题的能力。
二、教学内容:1. 溶液的酸碱性的定义2. 酸碱度的表示方法——pH值3. 酸碱指示剂及其作用4. 溶液的酸碱性与生活、生产的关系三、教学重点与难点:重点:溶液的酸碱性的概念及其判断方法。
难点:pH值的计算及溶液的酸碱性与生活、生产的关系。
四、教学方法:采用实验观察、讨论分析、讲解示范等教学方法,引导学生主动探究、积极思考,提高学生的实践能力和创新能力。
五、教学准备:1. 实验室用具:烧杯、试管、滴定管、pH试纸等。
2. 实验试剂:盐酸、氢氧化钠、醋酸、硫酸铜等。
3. 课件及教学素材。
一、溶液的酸碱性概念:1. 通过实验引入溶液的酸碱性概念,让学生观察不同酸碱性溶液对酸碱指示剂的影响。
2. 讲解溶液的酸碱性的定义,解释酸碱指示剂的作用。
二、pH值的表示方法:1. 讲解pH值的含义及其表示方法。
2. 演示如何使用pH试纸测定溶液的pH值。
3. 引导学生通过实验探究不同酸碱性溶液的pH值。
三、酸碱指示剂及其作用:1. 介绍常用的酸碱指示剂及其性质。
2. 讲解酸碱指示剂在不同酸碱性溶液中的变色情况。
3. 引导学生通过实验观察酸碱指示剂的变色现象。
四、溶液的酸碱性与生活、生产的关系:1. 通过实例讲解溶液的酸碱性在生活、生产中的应用。
2. 引导学生思考溶液的酸碱性对环境、健康的影响。
五、溶液的酸碱性判断与实验:1. 引导学生运用所学知识,通过实验判断溶液的酸碱性。
2. 讲解实验操作步骤,引导学生注意实验安全。
3. 分析实验结果,总结溶液的酸碱性判断方法。
六、教学过程:1. 引入新课:通过回顾上一节课的内容,引导学生思考溶液的酸碱性在日常生活中的应用。
2. 讲解新课:讲解溶液的酸碱性的概念、pH值的表示方法以及酸碱指示剂的作用。

初中化学《溶液的酸碱性》教案一、教学目标:1. 让学生了解溶液的酸碱性的基本概念。
2. 让学生掌握溶液的酸碱性测定方法。
3. 培养学生运用化学知识解决实际问题的能力。
二、教学内容:1. 溶液的酸碱性的概念。
2. 溶液的酸碱性测定方法:pH试纸、pH计。
3. 常见酸碱性溶液的例子。
三、教学重点与难点:1. 教学重点:溶液的酸碱性的概念,溶液的酸碱性测定方法。
2. 教学难点:溶液的酸碱性测定方法的运用。
四、教学方法:1. 采用讲授法,讲解溶液的酸碱性的基本概念和测定方法。
2. 采用实验法,让学生动手操作,掌握溶液的酸碱性测定方法。
3. 采用案例分析法,分析生活中常见的酸碱性溶液。
五、教学过程:1. 导入:通过生活中的实例,如食醋、柠檬等,引入溶液的酸碱性概念。
2. 新课:讲解溶液的酸碱性的基本概念,介绍pH试纸和pH计的使用方法。
3. 实验:让学生动手操作,用pH试纸和pH计测定不同溶液的酸碱性。
4. 案例分析:分析生活中常见的酸碱性溶液,如土壤、自来水、饮料等。
5. 总结:对本节课的内容进行总结,强调溶液的酸碱性在实际生活中的应用。
6. 作业:布置相关练习题,巩固所学知识。
六、教学策略:1. 利用多媒体课件,生动展示溶液的酸碱性概念和实验过程。
2. 设置疑问,引导学生思考,提高课堂互动性。
3. 结合生活实际,激发学生的学习兴趣和积极性。
七、教学准备:1. 准备实验器材:pH试纸、pH计、各种溶液(如食醋、柠檬、肥皂水等)。
2. 准备多媒体课件。
3. 准备练习题和案例分析材料。
八、教学评价:1. 课堂表现:观察学生在课堂上的参与程度、提问回答等情况,了解学生的学习状态。
2. 作业完成情况:检查学生作业的完成质量,巩固所学知识。
3. 实验报告:评估学生在实验过程中的操作能力和对实验结果的分析和总结。
九、教学拓展:1. 酸碱中和反应:介绍酸碱中和反应的概念和原理。
2. 酸碱平衡:简要介绍人体内酸碱平衡的重要性。

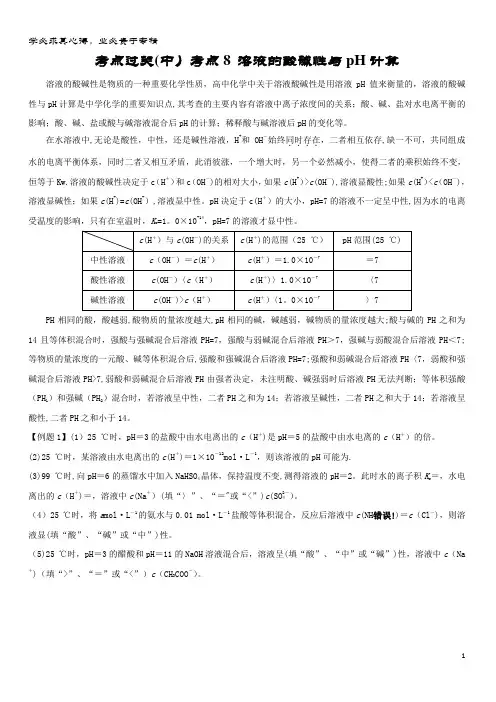
考点过关(中)考点8 溶液的酸碱性与pH计算溶液的酸碱性是物质的一种重要化学性质,高中化学中关于溶液酸碱性是用溶液pH值来衡量的,溶液的酸碱性与pH计算是中学化学的重要知识点,其考查的主要内容有溶液中离子浓度间的关系;酸、碱、盐对水电离平衡的影响;酸、碱、盐或酸与碱溶液混合后pH的计算;稀释酸与碱溶液后pH的变化等。
在水溶液中,无论是酸性,中性,还是碱性溶液,H+和OH-始终同时存在....,二者相互依存,缺一不可,共同组成水的电离平衡体系,同时二者又相互矛盾,此消彼涨,一个增大时,另一个必然减小,使得二者的乘积始终不变,恒等于Kw.溶液的酸碱性决定于c(H+)和c(OH-)的相对大小,如果c(H+)>c(OH—),溶液显酸性;如果c(H+)<c(OH—),溶液显碱性;如果c(H+)=c(OH-),溶液显中性。
pH决定于c(H+)的大小,pH=7的溶液不一定呈中性,因为水的电离受温度的影响,只有在室温时,K w=1。
0×10-14,pH=7的溶液才显中性。
PH相同的酸,酸越弱,酸物质的量浓度越大,pH相同的碱,碱越弱,碱物质的量浓度越大;酸与碱的PH之和为14且等体积混合时,强酸与强碱混合后溶液PH=7,强酸与弱碱混合后溶液PH>7,强碱与弱酸混合后溶液PH<7;等物质的量浓度的一元酸、碱等体积混合后,强酸和强碱混合后溶液PH=7;强酸和弱碱混合后溶液PH〈7,弱酸和强碱混合后溶液PH>7,弱酸和弱碱混合后溶液PH由强者决定,未注明酸、碱强弱时后溶液PH无法判断;等体积强酸(PH1)和强碱(PH2)混合时,若溶液呈中性,二者PH之和为14;若溶液呈碱性,二者PH之和大于14;若溶液呈酸性,二者PH之和小于14。
【例题1】(1)25 ℃时,pH=3的盐酸中由水电离出的c(H+)是pH=5的盐酸中由水电离的c(H+)的倍。
(2)25 ℃时,某溶液由水电离出的c(H+)=1×10-12mol·L-1,则该溶液的pH可能为.(3)99 ℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。

化学实验设计溶液的酸碱性实验在化学实验中,了解物质的酸碱性是非常重要的。
为了更好地了解溶液的酸碱性,我们可以设计一系列的实验来研究和测量。
本文将介绍一种化学实验设计,用于测试溶液的酸碱性。
通过这个实验,我们可以学习如何使用指示剂和pH计来确定溶液的酸碱性。
实验材料:1. 酸性溶液:例如盐酸溶液2. 碱性溶液:例如氢氧化钠溶液3. 中性溶液:例如纯净水4. 指示剂:例如苏丹红、酚酞5. pH计实验步骤:1. 将三个试管准备好,并编号为试管A、B、C。
2. 分别向试管A、B、C中滴入适量的酸性溶液。
3. 向试管A中加入几滴酚酞指示剂,并观察颜色变化。
4. 使用pH计测量试管A中溶液的pH值,并记录下来。
5. 将溶液A倒掉,并用清水冲洗试管。
6. 重复步骤2-5,使用碱性溶液和中性溶液分别代替酸性溶液。
7. 将实验数据整理到表格中。
实验结果和分析:根据实验数据和观察结果,我们可以得出以下结论:1. 酸性溶液的酸碱性:- 对于酸性溶液,酚酞指示剂会变成红色。
- pH计的读数将显示较低的值,通常在1-6的范围内。
2. 碱性溶液的酸碱性:- 对于碱性溶液,酚酞指示剂不会发生颜色变化。
- pH计的读数将显示较高的值,通常在8-14的范围内。
3. 中性溶液的酸碱性:- 对于中性溶液,酚酞指示剂不会发生颜色变化。
- pH计的读数将显示接近7的值。
通过这个实验,我们可以清楚地看到不同溶液的酸碱性差异。
同时,我们也学会了使用指示剂和pH计来快速确定溶液的酸碱性。
实验注意事项:1. 在进行实验前,要确保实验器材干净,并正确校准pH计。
2. 在滴加指示剂时要小心,避免滴多或滴少。
3. 酸碱性溶液具有腐蚀性,所以在操作时要戴上实验手套和护目镜,避免直接接触皮肤或眼睛。
结论:通过这个实验,我们了解了如何设计一个简单的化学实验来测试溶液的酸碱性。
通过观察颜色变化和使用pH计测量,我们可以准确地判断一个溶液是酸性、碱性还是中性。

一、溶液酸碱性的判断(一)、从题给的数据判断溶液的酸碱性1.从溶液中c(H+)和c(OH-)的大小关系比较来判断溶液的酸碱性当c(H+)>c(OH-)时,其水溶液呈酸性;当c(H+)=c(OH-)时,其水溶液呈中性;当c(H+)<c(OH-)时,其水溶液呈碱性。
2.从溶液中c(H+)的范围判断溶液的酸碱性没有明确指出溶液所处温度时,通常就认为是25℃,此时如果溶液中c(H+)>10-7mol/L表明溶液呈酸性;此时如果溶液中c(H+)=10-7mol/L表明溶液呈中性;此时溶液中c(H+)<10-7mol/L表明溶液呈碱性。
3.从溶液中c(OH-)的范围判断溶液的酸碱性没有明确指出溶液所处温度时,通常就认为是25℃,此时如果溶液中c(OH-)>10-7mol/L表明溶液呈碱性;此时如果溶液中c(OH-)=10-7mol/L表明溶液呈中性;此时溶液中c(OH-)<10-7mol/L表明溶液呈酸性。
4.从溶液的pH范围来判断溶液的酸碱性没有明确指出溶液所处温度时,通常就认为是25℃,此时如果溶液的pH>7表明溶液呈碱性;此时如果溶液的pH=7表明溶液呈中性;此时溶液的pH<7表明溶液呈酸性。
如果题中明确指出溶液所处温度是100℃,此时水的离子积常数为1*10-12,中性溶液的pH=6,此时如果溶液的pH>6表明溶液呈碱性;此时如果溶液的pH=6表明溶液呈中性;此时溶液的pH<6表明溶液呈酸性。
5.从正盐溶液中的阴阳离子浓度的倍数关系判断溶液酸碱性组成为M a Y b(该盐的电离方程式为M a Y b=a M b+ + bY a- )的盐溶液,当阴阳离子浓度的倍数关系为: b * c(M b+)= a *c(Y a-) ,溶液呈中性;当阴阳离子浓度的倍数关系为: b * c(M b+)> a *c(Y a-) ,溶液呈碱性;当阴阳离子浓度的倍数关系为: b * c(M b+)< a *c(Y a-) ,溶液呈酸性。

初中化学《溶液的酸碱性》教案一、教学目标:1. 让学生理解溶液的酸碱性的概念,掌握溶液的酸碱性与pH值的关系。
2. 培养学生运用化学知识解决实际问题的能力。
3. 培养学生的实验操作能力和观察能力。
二、教学内容:1. 溶液的酸碱性的概念。
2. pH值的定义及其与溶液的酸碱性的关系。
3. 酸碱指示剂及其在检测溶液酸碱性中的应用。
三、教学重点与难点:1. 教学重点:溶液的酸碱性的概念,pH值的定义及其与溶液的酸碱性的关系。
2. 教学难点:pH值的计算及酸碱指示剂的使用。
四、教学方法:1. 采用实验演示法,让学生直观地了解溶液的酸碱性。
2. 采用讲授法,讲解溶液的酸碱性的概念,pH值的定义及其与溶液的酸碱性的关系。
3. 采用小组讨论法,让学生探讨酸碱指示剂在检测溶液酸碱性中的应用。
五、教学步骤:1. 引入新课:通过实验演示,让学生观察不同溶液的酸碱性现象,引发学生对溶液的酸碱性的好奇心。
2. 讲解溶液的酸碱性的概念,解释pH值的定义及其与溶液的酸碱性的关系。
3. 学生分组实验:用酸碱指示剂检测不同溶液的酸碱性,观察并记录实验现象。
5. 课堂小结:回顾本节课所学内容,强调溶液的酸碱性的概念,pH值的定义及其与溶液的酸碱性的关系。
6. 布置作业:让学生运用所学知识,解决实际问题,如家庭常用物品的酸碱性测试。
六、教学评估:1. 课堂问答:通过提问学生,检查他们对溶液的酸碱性概念和pH值的理解程度。
2. 实验报告:评估学生在实验中的操作技能和对实验结果的记录能力。
3. 课后作业:检查学生对课堂所学知识的应用能力,以及对家庭常用物品酸碱性的测试结果。
七、教学拓展:1. 酸碱平衡:介绍酸碱平衡的概念,让学生了解人体内酸碱平衡的重要性。
2. 生活中的酸碱应用:探讨酸碱知识在生活中的应用,如食品加工、清洁剂的选择等。
八、教学资源:1. 实验器材:烧杯、试管、滴定管、pH试纸、指示剂等。
2. 教学课件:用于展示溶液的酸碱性实验过程和相关的概念图解。
初中化学溶液的酸碱性
1、显酸性的溶液:酸溶液和某些盐溶液(硫酸氢钠、硫酸氢钾等)
2、显碱性的溶液:碱溶液和某些盐溶液(碳酸钠、碳酸氢钠等)
3、显中性的溶液:水和大多数的盐溶液
(一)质量增加的
1、由于吸水而增加的:氢氧化钠固体,氯化钙,氯化镁,浓硫酸;
2、由于跟水反应而增加的:氧化钙、氧化钡、氧化钾、氧化钠,硫酸铜;
3、由于跟二氧化碳反应而增加的:氢氧化钠,氢氧化钾,氢氧化钡,氢氧化钙;
(二)质量减少的
1、由于挥发而减少的:浓盐酸,浓硝酸,酒精,汽油,浓氨水;
2、由于风化而减少的:碳酸钠晶体。
初中化学溶液酸碱性的教案
主题:溶液酸碱性
目标:让学生了解溶液的酸碱性质,能够准确判断溶液的酸碱性并进行简单的酸碱中和反应。
一、导入(5分钟)
1.通过实验演示,让学生观察一些物质在水中溶解时产生的变化,引导他们探讨溶液的性质。
2.提问:你知道什么是溶液的酸碱性吗?溶液的酸碱性如何表示?
二、学习(15分钟)
1.教师讲解:介绍溶液酸碱性的概念,以及酸碱指示剂的使用方法和原理。
2.学生讨论:讨论不同溶液的酸碱性质,如醋、苏打水、盐水等。
3.实验操作:让学生通过酸碱中和实验,探究酸碱中和反应的特点。
三、实践(20分钟)
1.小组讨论:学生分组进行实验操作,确定不同溶液的酸碱性质。
2.实验报告:每组学生根据实验结果撰写实验报告,总结溶液酸碱性的特点和判断方法。
四、总结(5分钟)
1.学生总结:通过实验和讨论,学生总结溶液的酸碱性如何判断以及酸碱中和反应的特点。
2.提问:什么是酸碱中和反应?怎样判断一个溶液是酸性、碱性还是中性的?
五、作业(10分钟)
1.布置作业:要求学生回答几个与溶液酸碱性相关的问题,并完成一份实验报告。
2.作业检查:下节课之前,教师对学生的作业进行检查,并给予反馈。
六、延伸(5分钟)
1.延伸讨论:引导学生思考溶液酸碱性在日常生活中的应用,如饮食、药品等方面。
2.课堂小结:回顾本节课的重点内容,并提醒学生课下继续加强对溶液酸碱性的理解。
化学初中溶液的酸碱性教案
一、教学目标:
1. 理解酸碱的定义,掌握酸碱的性质。
2. 能够根据颜色变化判断酸碱溶液的性质。
3. 能够用试纸检测溶液的酸碱性。
4. 能够根据酸碱溶液的性质进行简单的实验操作。
二、教学重点和难点:
重点:酸碱的定义、性质及检测方法。
难点:根据实验数据判断溶液的酸碱性。
三、教学内容:
1. 酸碱的定义
2. 酸碱的性质
3. 酸碱溶液的检测方法
四、教学过程:
1. 导入:通过展示一些常见的酸碱物质,引导学生了解酸碱的定义,并提出问题引起学生
思考。
2. 教学内容:首先讲解酸碱的定义和性质,然后介绍酸碱溶液的检测方法,包括使用试纸
和进行简单的实验操作。
3. 实验操作:让学生通过实验操作,根据实验结果判断溶液的酸碱性,并进行简单的分析。
4. 练习:让学生进行练习,加深对酸碱的理解。
5. 总结:根据教学内容进行总结,强化学生的记忆和理解。
6. 布置作业:布置相关练习题,巩固学生的学习成果。
五、教学资源:
1. 实验器材:试管、试纸、酸碱溶液等。
2. 教学辅助资料:PPT、教案、练习题等。
六、教学评价:
1. 学生的课堂表现。
2. 学生的作业完成情况。
3. 学生对酸碱的理解和掌握程度。
七、教学反思:
1. 教学目标是否达到。
2. 学生的学习情况如何。
3. 教学方法是否有效。
注:以上为化学初中溶液的酸碱性教案范本,希朥教师根据实际情况进行调整和完善。
煌敦市安放阳光实验学校高二化学三第二单元溶液的酸碱性 4【本讲信息】一、教学内容专题三第二单元溶液的酸碱性二、考点清单1. 溶液酸碱性的本质2. 判断溶液酸碱性的方法3. 溶液的pH概念及计算公式4. pH计算方法5. 酸碱滴概念,原理6. 酸碱滴步骤7. 酸碱滴误差分析三、全面突破Ⅰ、溶液的酸碱性1. 溶液的酸碱性的实质任何水溶液中都存在水的电离,因此都含有H+和OH-. 一种溶液是显酸性、中性还是碱性,是由该溶液中的c(H+)与c(OH-)的相对大小来决的.酸性溶液:c(H+)>c(OH-)酸性越强,c(H+)越大,c(OH-)越小。
中性溶液:c(H+)=c(OH-)碱性溶液:c(H+)<c(OH-)碱性越强,c(OH-)越大,c(H+)越小。
2. 溶液的酸碱性与c(H+)、c(OH-)(1)25℃时,K W=1×10-14中性溶液:c(H+)=c(OH-)=1×10-7mol·L-1酸性溶液:c(H+)>1×10-7mol·L-1,c(OH-)<1×10-7mol·L-1碱性溶液:c(H+)<1×10-7mol·L-1,c(OH-)>1×10-7mol·L-1(2)100℃时,K W=1×10-12中性溶液:c(H+)=c(OH-)=1×10-6mol·L-1酸性溶液:c(H+)>1×10-6mol·L-1,c(OH-)<1×10-6mol·L-1碱性溶液:c(H+)<1×10-6mol·L-1,c(OH-)>1×10-6mol·L-13. 溶液的pH(1)溶液的pH的概念:在c(H+)≤1mol·L-1的水溶液中,采用c(H+)的负对数来表示溶液酸碱性的强弱.(2)数学表达式:pH=-1g[c(H+)]若c(H+)=10-n mol·L-1,则pH=n.若c(H+)=m×10-n mol·L-1,则pH=n-lgm.(3)溶液酸碱性的强弱与pH的关系.①常温25℃时:pH =7,溶液呈中性,c(H+)=c(OH-)=1×10-7mol·L-1.pH <7,溶液呈酸性,pH(H+强(弱).pH >7,溶液呈碱性,pH(OH-强(弱).②pH范围为0~14之间. pH=0的溶液中并非无H+,而是c(H+)=1mol·L -1;pH=14的溶液中并非没有OH-,而是c(OH-)=1 mol·L-1. pH减小(增大)n倍,则c(H+)增大为原来的10n倍(减小为原来的1/10n倍),相的c (OH-)减小为原来的1/10n倍(增大为原来的10n倍).③当溶液中的c(H+)>1mol·L-1时,pH<0;c(OH-)>1mol·L-1时,pH>14. 因此,当溶液中的c(H+)或c(OH-)大于1mol·L-1时,一般不用pH来表示溶液的酸碱性,而是直接用c(H+)或c(OH-)来表示. 所以,pH只适用于c(H+)或c(OH-)≤1mol·L-1的稀溶液.4. 溶液中pH的计算(1)基本关系式:①pH=-1g[c(H+)]②c(H+)=10-n mol·L-1③任何水溶液中,由水电离产生的c(H+)与c(OH-)总是相的,即:c水(H+)=c水(OH-).④常温25℃时,c(H+)·c(OH-)=1×10-14(2)强酸与弱酸、强碱与弱碱溶液加水稀释后pH的计算.①强酸与弱酸分别加水稀释相同倍数时,由于弱酸来未电离的弱酸分子进一步电离出离子,故弱酸的pH变化小. 设稀释10n倍,则:强酸:pH稀= pH原 + n弱酸:pH稀< pH原 + n当加水稀释至由溶质酸电离产生的c酸(H+)<10-6mol·L-1时,则必须考虑水的电离.如pH=5的盐酸稀释1000倍时,pH稀=6.98,而不是于8.②强碱与弱碱分别加水稀释相同倍数时,弱碱的pH变化小. 设均稀释10n 倍,则:强碱:pH稀= pH原- n弱碱:pH稀> pH原- n当加水稀释至由溶质碱电离产生的c(OH-)<10-6 mol · L-1时,则必须考虑水的电离. 如pH=9的NaOH溶液稀释1000倍时,pH稀≈7,而不是于6.(3)两强酸或两强碱溶液混合后pH的计算.①两强酸溶液混合. 先求出:212211VVV)H(cV)H(c)H(c++=+++混再求:pH混=-1g[c混(H+)]②两强碱溶液混合. 求算两强碱溶液混合后溶液的pH时,不能直接根据题中给出的碱的pH求算混合液的pH,而必须先分别求出两强碱溶液中的c(OH-),再依下式求算c混(OH-):212211VVVOHcVOHcOHc++=---)()()(混,然后求出c混(H+)、pH混.(4)强酸与强碱溶液混合后pH的计算.解题步骤:分别求出酸中的n(H+)、碱中的n(OH-)→依H++ OH-=H2O比较出n(H+)与n(OH-)的大小.①n(H+)=n(OH-)时,恰好,混合液显中性;pH=7. [若混合液的pH =7,则必有n(H+)=n(OH-)]②n(H+)>n(OH-)时,酸过量,则:碱酸余碱酸混VV)H(nVV)OH(n)H(n)H(c+=+-=+-++。
化学解题技巧如何正确判断溶液的酸碱性化学是一门理论性非常强的科学学科,而解题是学习化学过程中必不可少的一环。
在化学解题过程中,正确判断溶液的酸碱性是非常重要的一点。
本文将介绍几种化学解题技巧,帮助读者准确判断溶液的酸碱性。
一、酸碱指示剂法酸碱指示剂可以帮助我们判断溶液的酸碱性。
酸碱指示剂根据在不同pH值下颜色的变化来判断溶液的酸碱性。
常见的酸碱指示剂有酚酞、甲基橙、溴木脂素等。
通过加入适量的酸碱指示剂到待测溶液中,观察颜色的变化,可以初步判断溶液的酸碱性。
二、酸碱物质的性质和反应判断溶液的酸碱性还可以根据溶液中存在的酸碱物质的性质和反应来进行。
酸和碱在水溶液中的性质和反应有很多特点,其中一些特点可以帮助我们判断溶液的酸碱性。
1. 酸的特点:a) 酸溶液具有酸味,可以酸腐蚀金属。
b) 酸和碱发生中和反应,产生盐和水。
c) 酸和金属反应,产生对应的盐和氢气。
d) 酸和碳酸盐反应,产生对应的盐、水和二氧化碳。
2. 碱的特点:a) 碱溶液具有苦味,可以腐蚀皮肤。
b) 碱和酸发生中和反应,产生盐和水。
c) 碱和非金属氧化物反应,产生盐和水。
通过观察溶液中是否存在酸或碱的特点反应,我们可以初步判断溶液是酸性还是碱性。
三、pH值法pH是判断溶液酸碱性的常用指标,其值范围从0到14。
pH值小于7的溶液被认为是酸性溶液,pH值大于7的溶液被认为是碱性溶液,pH值为7的溶液被认为是中性溶液。
通过使用pH试纸、pH计或其它酸碱测定方法,我们可以测定溶液的pH值,从而准确判断溶液的酸碱性。
四、酸碱性化学方程式的计算酸碱性化学方程式的计算是化学解题过程中的一种重要技巧。
在酸碱中和反应中,酸和碱按化学方程式计算,可以帮助我们准确判断溶液的酸碱性。
例如,当酸和碱发生中和反应时,可以根据酸和碱的配比关系,计算出生成的盐的性质和在水中的溶解程度,从而判断溶液的酸碱性。
总结:在化学解题中,正确判断溶液的酸碱性是非常重要的一步。
通过酸碱指示剂法、酸碱物质的性质和反应、pH值法以及酸碱性化学方程式的计算,我们可以准确判断溶液的酸碱性质。