现代化学原理-12-a
- 格式:doc
- 大小:379.00 KB
- 文档页数:15

复旦大学现代化学原理答案1、关于黄酮类化合物,以下说法正确的是()[单选题] *A多为液态或呈挥发性B多为无色C因分子内多具有酚羟基,多呈酸性(正确答案)D易溶于水2、萃取时易发生乳化现象的是()[单选题] *A简单萃取法(正确答案)B逆流连续萃取法C二者均是D二者均不是3、可沉淀具有羧基或邻二酚羟基成分的沉淀法是()[单选题] * A溶剂沉淀法B醋酸铅沉淀法(正确答案)C酸碱沉淀法D水提醇沉法4、下列化合物中β位有-COOH取代的是()[单选题] *A大黄素B大黄酸(正确答案)C大黄素甲醚D芦荟大黄素5、四氢硼钠反应变红的是()[单选题] *A山柰酚B橙皮素(正确答案)C大豆素D红花苷6、薄层吸附色谱中的Rf的大小说明了吸附程度的大小,吸附力越大,则Rf()[单选题] * A越大B越小(正确答案)C越接近1D越接近07、E连续回流提取法(正确答案)从中药中水提取液中萃取偏于亲水性的成分的溶剂是()[单选题] *A正丁醇(正确答案)B乙醇C乙醚D三氯甲烷8、一般情况下,为无色的化合物是()[单选题] *A黄酮B花色素C二氢黄酮(正确答案)D查耳酮9、大黄素型蒽醌母核上的羟基分布情况是()[单选题] * A一个苯环的β位B苯环的β位C在两个苯环的α或β位(正确答案)D一个苯环的α或β位10、中药丹参中的主要有效成分属于()[单选题] *A苯醌类B萘醌类C蒽醌类D菲醌类(正确答案)11、南五味子保肝的主要效药效成分是()[单选题] *A蒽醌B香豆素C黄酮D木脂素(正确答案)12、当一种溶剂无法结晶时,常常使用混合溶剂,下列不是常用的混合溶剂是()[单选题] *A甲醇-水B乙酸-水C乙醚-丙酮D石油醚-水(正确答案)13、木脂素是苯丙素衍生聚合而成的天然化合物,多为()[单选题] *A二聚体(正确答案)B三聚体C四聚体D五聚体14、牛蒡子属于()[单选题] *A香豆素类B木脂内酯(正确答案)C苯丙酸类D15、具有挥发性的生物碱是()[单选题] *A吗啡碱B麻黄碱(正确答案)C苦参碱D小檗碱16、溶解范围广,提取较全面的是()[单选题] * A三氯甲烷B正丁醇C乙醇(正确答案)D水17、能溶于水的生物碱是()[单选题] *A莨菪碱B小檗碱(正确答案)C长春新碱D长春碱18、浓缩速度快,又能保护不耐热成分的是()[单选题] * A水蒸汽蒸馏法B常压蒸馏法C减压蒸馏法(正确答案)D连续回流法19、南五味子具有的主要化学成分是()[单选题] *A色原酮B胆汁酸C多糖D木脂素(正确答案)20、倍半萜和二萜在化学结构上的明显区别是()[单选题] * A氮原子数不同B碳原子数不同(正确答案)C碳环数不同D硫原子数不同21、阿托品的结构类型是()[单选题] *A喹啉类B异喹啉类C莨菪烷类(正确答案)D苄基异喹啉类22、在溶剂沉淀法中,主要是在溶液中加入另一种溶剂一改变混合溶剂的什么实现的()[单选题] *ApH值B溶解度C极性(正确答案)D体积23、连续回流提取法与回流提取法比较,其优越性是()[单选题] *A节省时间且效率高B节省溶剂且效率高(正确答案)C受热时间短D提取量较大24、属于倍半萜的化合物是()[单选题] *A龙脑B莪术醇C薄荷醇D青蒿素(正确答案)25、适用于队热及化学不稳定的成分、低极性成分的提取()[单选题] * A渗漉法B超声提取法C回流提取法D超临界流体提取法(正确答案)26、醇提醚沉法主要适用于以下的哪一类成分()[单选题] *A多糖B叶绿素C皂苷(正确答案)D黏液质27、香豆素衍生物最常见的羟基取代位置是()[单选题] *AC7位(正确答案)BC5位CC3位DC6位28、以杜鹃素为指标成分进行定性鉴别的中药是()[单选题] *A满山红(正确答案)B黄芩C槐花D陈皮29、除了能够沉淀有羧基或邻二酚羟基成分,还能沉淀一般酚羟基成分的是()[单选题] *A碱式醋酸铅(正确答案)B中性醋酸铅C酸碱沉淀法D以上都不对30、有机溶剂提取液的浓缩采用的装置是()[单选题] *A分馏装置B回流装置C蒸馏装置(正确答案)D索氏提取器。

2023届高考化学二轮复习化学反应原理综合练习1.综合利用2CO 、CO 对构建低碳社会有重要意义。
(1)利用2CO 与4CH 制备合成气CO 、2H ,可能的反应历程如图所示:说明:C(ads)为吸附性活性炭,E 表示方框中物质的总能量(单位:kJ ),TS 表示过渡态。
①制备合成气CO 、2H 总反应的热化学方程式为_______________________________。
②若4132E E E E +<+,则决定制备“合成气”反应速率的化学方程式________________________。
(2)工业上常采用2CO 和2H 为原料合成乙醇,反应方程式为:-1222522CO (g)+6H (g)C H OH(g)+3H O(g) ΔH=akJ mol 。
一定温度下,向容积均为2L 的恒容密闭容器中分别通入21.0mol CO (g)和23.0mol H (g),在不同催化剂X 、Y 的催化下发生反应.测得5min 时,2CO 转化率与温度的变化关系如图所示。
①该反应适宜选用的催化剂为_______(填“X”或“Y”)。
②1T K 时,a 点对应容器在0~5min 内的平均反应速率()2H v =__________;b 、c 点对应状态下反应物的有效碰撞几率b_______c(填“>”“<”或“=”),原因为_______________________________。
③2T K 时,保持温度不变向容器中再充入20.2mol CO 、250.6mol C H OH(g),平衡将_______移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(3)随着科学技术的发展,2CO 的捕集利用技术成为研究重点,2CO 可以被NaOH 溶液捕获,所得溶液()()233c HCO :c CO 1:5--=,该溶液的pH =___________。
[已知室温下,()7a123K H CO 410-=⨯,()11a 223 K H CO 510-=⨯]2.氯化法制备TiCl 4的工艺为:800℃时,向15L 容器中加入5mol TiO 2与15mol 碳粉,通入10mol Cl 2进行反应,生成TiCl 4气体,经过处理得到TiCl 4成品。

无机化学(原理篇)强化训练题-12级材化,高材,应化1《无机化学》(原理篇)强化练习题化学动力学基础一、是非题1、某反应,若反应物浓度的减少与时间成正比,则反应的级数为零级。
2、反应速度常数只于温度有关,因此,温度相同时各反应速度常数均相等。
3、反应的活化能越大,在一定的温度下,反应速度也越快。
4、反应物中,活化分子所具有的能量就是该反应的活化能。
5、正,逆反应的活化能,数值相等,符号相反。
6、活化能常为正值而不能为负值。
7、测定反应速率的主要问题是确定一定数量反应物消耗或产物生成所需时间。
8、温度升高,分子间的碰撞频率也增加,这是温度对反应速率影响的主要原因,9、活化能大小不一定表示一个反应的快慢,但可表示一个反应受温度的影响是显著还是不显著。
10、某反应体系的温度一定时,当反应物的一部分活化分子全部反应后,反应就停止。
11、在多步反应中,决定速率步骤基元反应的反应分子数几乎决定着整个反应的总级数;但这个反应的总级数与该基元反应的分子数不一定相同。
12、可逆反应中,正逆反应的活化能之差,即△E = Ea正- Ea逆。
它的数值与反应焓变是很相近的。
13、平衡控制反应通常指的是快速的可逆反应;动力控制反应则指反应速率常数比较小的那些反应。
14、若实验测得的反应速度方程式与质量作用定律给出的相一致,则该反应一定是基元反应。
二、选择题1、H2O2的分解反应为: H2O2(aq) →H2O(l) + 1/2O2(g),下列表示的瞬时速度中,正确的是A、dc(H2O2)/dtB、-dc(H2O)/dtC、-dc(O2)/(2dt)D、dc(O2)/(2dt)2、对于反应2NO + O2→2NO2,下列各速度常数之间的关系中,正确的是A.k NO=k O2=k NO2B.1/2k NO=k O2=1/2k NO2C.2k NO=k O2=2k NO2D.k NO=1/2k O2=k NO23、反应X + Y →Z,其速度方程式为:υ=k[X]2[Y]1/2,若X与Y 的浓度都增加4倍,则反应速度将增加多少倍A.4B.8C.16D.324、某化学反应速度常数的单位是mol-1·L·s-1,则该反应的级数为A.3B.1C.2D.1/25、已知某一反应A + B →C 的Ea正=50kJ/mol,则该反应的Ea 逆为A.-50KJ/molB.< 50KJ/molC.> 50KJ/molD.无法确定6、提高温度可增加反应速度的原因是A.增加了活化分子的百分数B.降低了反应的活化能C.增加了反应物分子间的碰撞频率D.使活化配合物的分解速度增加7、催化剂加快反应速度的原因是A.催化剂参与化学反应B.改变了化学反应的历程C.降低了活化能D.提高了活化分子百分数8、速率常数k是一个A.无量纲的参数B.量纲为mol·L-1·s-1C.量纲为mol2·L-2·s-1 的参数D.量纲不定的参数9、已知反应2NO(g) + Br2(l) →2NOBr(g) 的反应历程是(1). NO(g) + Br2(l) →NOBr2(g) 快(2). NOBr2(g) + NO(g) →2NOBr(g) 慢此反应的速率公式应该是A.υ=k[NO]B.υ=k[NO]2C.υ=k[NO]2[Br2]D.υ=k[NOBr2][NO]10、下列哪一种关于活化能的说法是正确是A.相当于打破反应物分子原有化学键所需的最低能量B.相当于打破旧化学键,建立新化学键总能量代数和C.相当于反应物的总键能D.等于活化分子的临近能11、A →B + C 是吸热的可逆基元反应,正反应的活化能为Ea正,逆反应的活化能为E逆A.Ea正< Ea逆B.Ea正> Ea逆C.Ea正= Ea逆D.三种都可能12、氨合成反应是在铁催化剂上进行的,在反应中如果加入少量某种物质如含硫物质可使反应明显减慢,这种物质称为:A.负催化剂B.催化剂毒物C.阻化剂D.三种名称同义三、填空题1、化学反应速度按其表示形式,可分为( )和( ),前者是指( ) 后者意为( ),对于一般反应,常用( )速度表示.2、速度常数表示了( ),而与反应物浓度( ).k的单位由( )而定.3、基元反应NO + O3━━NO2 + O2总的反应级数为( ),若NO 和O3的浓度均为5×10-8 mol /L 反应速度常数是1.2×107L/mol/s,则每秒生成NO2的浓度为( ).4、活化能是( ),Ea-Ea'是( )。

1. 近年来我国不少地区多次出现大雾天气,致使高速公路关闭,航班停飞.从物质分类角度来看,雾属于下列分散系中的(C)A.溶液B.悬浊液C.胶体D.乳浊液2. 下列说法正确的是(A)A.可用丁达尔效应区分溶液与胶体B.生石灰与水混合的过程只发生物理变化C.O3是由3个氧原子构成的化合物D.CuSO4·5H2O是一种混合物3. 下列物质中,不会出现丁达尔现象的是(A)①氢氧化铁胶体②水③豆浆④蔗糖溶液⑤FeCl3溶液⑥云、雾A.②④⑤ B.③④C.②④⑥D.①③④4. 下列实验装置或操作与粒子的大小无直接关系的是(C)5. 下列事实与胶体性质无关的是(C)A.在豆浆里加入盐卤做豆腐B.在河流入海处易形成沙洲C.三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀D.一束平行光线照射蛋白质溶液时,从侧面可以看到一束光亮的通路6. 下列关于胶体的叙述不正确的是(C)A.胶体区别于其他分散系的本质特征是分散质的粒子直径在10-9~10-7 m之间B.光束透过胶体时,胶体中可产生丁达尔效应C.用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同D.Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的7. 氯化铁溶液与氢氧化铁胶体具有的共同性质是(B)A.分散质颗粒直径都在1~100 nm之间B.能透过滤纸C.能透过半透膜(溶液可透过半透膜,胶体不能透过半透膜) D.呈红褐色8. 已知土壤胶体中的粒子带负电荷,又有很大的表面积,吸附某些离子的能力较强.在土壤里施用含氮量相同的下列肥料,肥效最差的是(B)A.(NH4)2SO4B.NH4HCO3C.NH4NO3D.NH4Cl9. 现有如下各实验:A.将1 g KCl加入10 g沸腾的水中;B.将1 g可溶性淀粉加入到100 g水中,搅拌均匀后煮沸;C.将1 g CaCO3粉末加入100 g水中,充分振荡;D.将0.1 g植物油加入到10 g水中,充分振荡混匀;E.将96 mL乙酸与5 mL水充分混合.上述实验中所得到的分散系,属于溶液的有A E,属于胶体的是B,属于浊液的是C D.10. 实验证明,聚沉能力主要取决于与胶粒带相反电荷的离子所带的电荷数,电荷数越大,聚沉能力越大(1)向Fe(OH)3胶体中加入下列电解质时,其聚沉能力最强的为④(填序号).①NaCl②FeCl3③K2SO4④Na3PO4(2)为了把黏土溶胶(黏土胶体粒子带负电荷)变成较洁净的水,加入下列电解质时,B (填序号)效果最明显,原因是Al3+所带正电荷数最多,使黏土溶胶聚沉效果最好.A.BaCl2B.Al2(SO4)3C.KCl D.CuSO311.达尔效应是区分胶体与溶液的一种最常用的方法.(1)如图是在实验室中进行氢氧化铁胶体丁达尔效应实验的示意图,该图中有一处明显错误是空气中也出现了光柱,原因是进入烧杯前,光穿过的空气不是胶体,不会产生丁达尔效应(试从分散系的分类进行讨论说明)欲在树林中观察到丁达尔效应,你认为一天中最有可能观察到该现象的时间是清晨,理由是清晨树林中存在水雾,雾是胶体,阳光透过树叶间隙形成光束,穿过这些水雾会产生丁达尔效应.(3)去树林观察丁达尔效应有诸多不便,聪明的你想出了许多在家里看到丁达尔效应的方法,其中最简单、最环保的方法是:打开暖瓶(加热水)让水汽升腾起来,用一束光照射即可12. 生活和生产中常用到胶体的性质,请看下述三例:(1)做实验时,手指不慎被玻璃划破,可从急救箱中取氯化铁溶液应急止血,其原理是血液的主要成分是蛋白质溶胶,其胶粒带有负电荷,加入的氯化铁为电解质,Fe3+使胶体聚沉,加快止血.(2)在陶瓷工业上常遇到因陶土里混有氧化铁而影响产品质量.解决方法之一是把这些陶土和水一起搅拌,使粒子直径为10-9~10-7 m之间,然后插入两根电极,再接通直流电源.这时,阳极聚集陶土胶粒,阴极聚集氧化铁胶粒,理由是前者胶粒带负电荷,向阳极移动;后者胶粒带正电荷,向阴极移动.(3)水泥和冶金工厂常用高压电对气溶胶作用,除去大量烟尘,以减少对空气的污染,这种做法运用了电泳原理.13. 已知半透膜有非常细小的孔,只允许较小的离子、分子通过,胶体粒子不能透过.(提示:碘遇淀粉显蓝色)把10 mL淀粉胶体和5 mL KCl溶液的混合液体加入到用半透膜制成的袋内,将此袋浸入盛蒸馏水的烧杯中.2 min后,用两支试管各取5 mL烧杯中的液体,并做如下实验:(1)向其中一支试管里滴加少量AgNO3溶液,其现象是出现白色沉淀.(2)向另一支试管里滴加少量碘水,其现象是无明显变化(3)由上述实验得出的结论是Cl-能透过半透膜,淀粉胶体粒子不能透过半透膜.14. 浊液区别于其他分散系最本质的特征是(D)A.外观混浊不清B.分散质粒子不能透过半透膜C.不稳定D.分散质粒子直径大于100 nm 15.“纳米材料”是粒子直径为1~100 nm(纳米)的材料,纳米碳就是其中的一种。
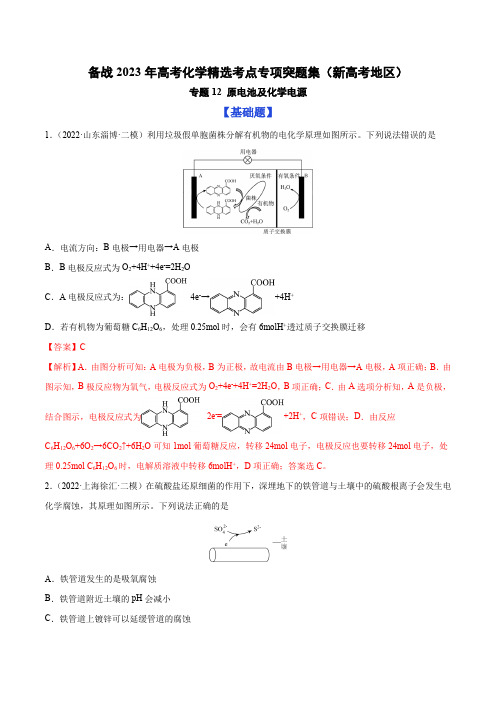
备战2023年高考化学精选考点专项突题集(新高考地区)专题12 原电池及化学电源【基础题】1.(2022·山东淄博·二模)利用垃圾假单胞菌株分解有机物的电化学原理如图所示。
下列说法错误的是A.电流方向:B电极→用电器→A电极B.B电极反应式为O2+4H++4e-=2H2OC.A电极反应式为:-4e-→+4H+D.若有机物为葡萄糖C6H12O6,处理0.25mol时,会有6molH+透过质子交换膜迁移【答案】C【解析】A.由图分析可知:A电极为负极,B为正极,故电流由B电极→用电器→A电极,A项正确;B.由图示知,B极反应物为氧气,电极反应式为O2+4e-+4H+=2H2O,B项正确;C.由A选项分析知,A是负极,结合图示,电极反应式为-2e-=+2H+,C项错误;D.由反应C6H12O6+6O2→6CO2↑+6H2O可知1mol葡萄糖反应,转移24mol电子,电极反应也要转移24mol电子,处理0.25mol C6H12O6时,电解质溶液中转移6molH+,D项正确;答案选C。
2.(2022·上海徐汇·二模)在硫酸盐还原细菌的作用下,深埋地下的铁管道与土壤中的硫酸根离子会发生电化学腐蚀,其原理如图所示。
下列说法正确的是A.铁管道发生的是吸氧腐蚀B.铁管道附近土壤的pH会减小C.铁管道上镀锌可以延缓管道的腐蚀D .输送高温水蒸汽的铁管道也会发生该类型腐蚀【答案】C【解析】根据图示可知该电化学腐蚀中,硫酸根离子得电子生成硫离子,电极反应式为:2--2--42SO +8e +4H O=S +8OH ,铁管道做负极,发生失电子的氧化反应生成亚铁离子,据此结合电化学腐蚀原理分析解答。
A .根据上述分析可知,铁管道正极不是氧气得电子,发生的不是吸氧腐蚀,A 错误;B .根据铁管道的正极反应:2--2--42SO +8e +4H O=S +8OH 可知,该腐蚀会使铁管道附近土壤的pH 会增大,B 错误;C .锌的金属活动性大于铁的,所以铁管道上镀锌,锌隔绝了铁与外界的接触,既使锌破损,锌做负极,铁做正极,被保护,可以延缓管道的腐蚀,C 正确;D .高温下,水蒸气与铁发生氧化还原反应生成四氧化三铁和氢气,与上述类型腐蚀不同,D 错误;答案选C 。
电化学原理练习题及答案1、在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是()A.原电池正极和电解池阳极所发生的反应B.原电池正极和电解池阴极所发生的反应C.原电池负极和电解池阳极所发生的反应D.原电池负极和电解池阴极所发生的反应2、下列关于铜电极的叙述正确的是()A.铜锌原电池中铜是正极B.用电解法精炼粗铜作阴极C.在镀件上电镀铜时可用金属铜作阳极D.电解稀硫酸制H2、O2时铜作阳极3.用惰性电极实现电解,下列说法正确的是( )A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶14.(2004年广东,11)pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是()A.NaOHB.H2SO4C.AgNO3D.Na2SO45.(2004年天津理综,12)图11-13为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正..确.的是图11-13A.a电极是负极B.b电极的电极反应为:4OH--4e-====2H2O+O2↑C.氢氧燃料电池是一种具有应用前景的绿色电源D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置6.用惰性电极实现电解,下列说法正确的是A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶17.(2004年江苏,16)碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。
锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)====Zn(OH)2(s)+Mn2O3(s)下列说法错误..的是( )A.电池工作时,锌失去电子B.电池正极的电极反应式为2MnO 2(s )+H 2O (l )+2e -====Mn 2O 3(s )+2OH -(aq )C.电池工作时,电子由正极通过外电路流向负极D.外电路中每通过0.2 mol 电子,锌的质量理论上减小6.5 g8.(2006江苏.14)锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。
现代化学原理答案1. 原子结构与元素周期表形成与稳定的物质由不可再分割的基本单元-原子组成。
原子由原子核和电子构成。
原子核包含质子和中子,电子围绕着原子核运动。
元素周期表是基于原子序数和电子排布规律所得到的一种表格,它将元素按照一定的规律排列,并揭示了元素间的周期性变化。
2. 化学键结合原子之间的相互作用力称为化学键。
化学键包括离子键、共价键和金属键。
离子键形成于电子的转移,共价键形成于电子的共享,而金属键则形成于自由电子的互相吸引。
3. 化学方程式化学方程式用化学符号和化学式表示化学反应的过程。
化学方程式包括反应物、生成物以及它们之间的反应体系。
化学方程式可以用来表示物质的转化过程和化学计量比。
4. 化学反应速率化学反应速率指的是反应物转化为生成物的速度。
反应速率可以通过消耗反应物或生成产物的摩尔数来确定。
它受到温度、浓度、催化剂和表面积等因素的影响。
5. 反应平衡化学反应达到一种动态的平衡状态,其中反应物和生成物的摩尔数在一段时间内保持不变。
化学平衡可以通过平衡常数来描述。
温度、浓度和压力的变化都会对化学平衡产生影响。
6. 酸碱理论酸碱理论是解释酸碱性质的一种基本理论。
其中有很多不同的酸碱定义,如布朗酸碱理论、阿伦尼乌斯酸碱理论等。
酸具有释放质子的能力,碱具有接受质子的能力。
7. 氧化还原反应氧化还原反应是一类广泛存在的化学反应,涉及到电子的转移过程。
在氧化还原反应中,氧化剂接受电子,称为氧化作用;还原剂失去电子,称为还原作用。
8. 化学热力学化学热力学是研究热现象和能量转化的科学。
它关注化学反应的热效应,包括焓变、熵变和自由能变化。
化学热力学理论可以用来预测和解释化学反应的发生性质和趋势。
9. 配位化学配位化学研究配位化合物和配合物之间的相互作用。
配位化合物通过配位键将中心金属离子与周围配体连接起来,形成配合物。
配位化学在催化、材料科学和生物无机化学领域具有重要应用。
10. 有机化学有机化学是研究碳元素化合物的化学,以及它们的结构、性质和反应的学科。
本周作业:P444 2;P454 3、4、7;P454 9、11、12;P464 5、21P406、2. 0.10 mol Cu(NO 3)2和1.50 mol NH 3溶解于水并稀释到总体积为1.00 L 。
计算平衡时溶液中,Cu 2+,[CuNH 3]2+,[Cu(NH 3)2]2+,[Cu(NH 3)3]2+,[Cu(NH 3)4]2+ 和NH 3的平衡浓度。
Cu 2+ (aq) + 4NH 3 (aq) = Cu(NH 3)42+ (aq) x 1.5-4(0.10-x) 0.10-x2133441234243[Cu(NH )]K K K K 2.110[Cu ][NH ]++β===⨯X = 3.25 × 10-15Cu 2+ (aq) + NH 3 (aq) = CuNH 32+ (aq)β113223=K [CuNH ][Cu ][NH ]=++Cu 2+ (aq) + 2NH 3 (aq) = Cu(NH 3)22+ (aq)β212322232K K [Cu(NH )][Cu ][NH ]==++Cu 2+ (aq) + 3NH 3 (aq) = Cu(NH 3)32+ (aq)β3123332233K K K [Cu(NH )][Cu ][NH ]==++元素锰有0, +2, +3, +4, +6, +7等六种不同的氧化态;在酸性水溶液中的元素电位图:若元素电势图和下面二个半反应的标准还原电势2H3O+ (aq) +2e = H2(g) +2H2O(l) ε︒= 0.0000VO2(g) + 4H3O+ (aq) + 4e = 6H2O(l) ε︒= 1.229V联用,便可以了解元素在水溶液中的许多性质:1)标准还原电势小于0的氧化-还原对的还原形式会和溶液中的H3O+离子反应放出氢气,因而都不能在酸性水溶液中稳定存在。
如Mn2+-Mn对的标准还原电势为-1.18,其还原形式金属锰就会和酸性溶液中的H3O+离子发生氧化还原反应而放出氢气:Mn(s) + 2H3O+ (aq) = Mn2+ (aq) + H2 (g)2)标准还原电势大于1.229V的氧化-还原对的氧化形式会把水氧化而放出氧气,也不能在酸性水溶液中稳定存在,如H2MnO4-MnO2,Mn3+-Mn2+和MnO4--MnO2三个氧化-还原对的还原电势都超出1.229V;它们的氧化形式都能与水发生如下的氧化还原反应而释放氧气:2H2MnO4 (aq) = 2MnO2 (s) + O2 (g) + 2H2O(l)4Mn3+ (aq) + 6H2O(l) = 4Mn2+ (aq) + 4H3O+ (aq) + O2 (g)4MnO4- (aq) + 4H3O+ (aq) = 4MnO2 (s) + 6H2O(l) + 3O2(g)其中MnO4-与H2O的反应速度较慢,在酸性水溶液中有一定动力学上的稳定性。
3)E E ∅∅右左>,处于中间氧化态的化学品种容易发生歧化反应而不能稳定存在。
如图中MnO 4- -H 2MnO 4 -MnO 2;MnO 2 -Mn 3+ -Mn 2+ 二处标准还原电势均呈递增趋势,所以H 2MnO 4和Mn 3+ 都容易在酸性水溶液中发生歧化反应:3H 2MnO 4 (aq) = 2MnO 4- (aq) + MnO 2(s) + 2H 3O + (aq) 2Mn 3+ (aq) + 6H 2O(l) = MnO 2 (s) + Mn 2+ (aq) + 4H 3O + (aq) 4)E <E ∅∅右左,各化学品种对歧化反应具有稳定性,都能在溶液中稳定存在。
如MnO 4-,MnO 2,Mn 2+,Mn 就不会在酸性水溶液中发生歧化反应而具有相对的稳定性。
结论:在酸性溶液中只有MnO 2和Mn 2+是热力学稳定的,MnO 4- 有一定的动力学稳定性。
其他所有氧化态的含锰化学品种都不能在酸性溶液中稳定存在,因而在酸性溶液中经常遇到的只有MnO 4-,MnO 2和Mn 2+ 三个化学品种的水溶液化学。
ⅲ)氧化态自由能图用下列锰的氧化-还原对的标准还原电势:n = 1 2 1 1 2 可以根据关系式h G ∆= -n FE ︒ 算出下列氧化半反应的h G ∆/ F = nE ︒值:Mn(s)→ Mn 2+ (aq) + 2e h G ∆/ F = - 2.36 VMn(s)→ Mn 3+ (aq) + 3eh G ∆/ F = - 0.86 VMn(s) + 6H 2O(l) → MnO 2 (s) + 4H 3O + (aq) + 4eh G ∆/ F = 0.09 V Mn(s) + 10H 2O(l) → H 2MnO 4 (aq) + 6H 3O + (aq)+ 6eh G ∆/ F = 4.27 V Mn(s) + 12H 2O(l) → MnO 4- (aq) + 8H 3O + (aq) + 7eh G ∆/ F = 5.17 V 然后以锰的氧化数对各化学品种的 h G ∆/F 作图(图中金属锰的∆G f= 0),得到锰的氧化态-自由能图。
Mn 的氧化态自由能图氧 化 数1). 在函数∆G F h /中F 是常数,图中每一点的高度表达了该化学品种的标准生成自由能的相对大小。
图中处于最低点的化学品种具有最小的标准生成自由能,是最稳定的;处于最高点的化学品种则是热力学上最不稳定的。
就锰而言:在酸性水溶液中最稳定的是Mn 2+ 离子;最不稳定的则是MnO 4-。
2). 图中任何二点之间的连线的斜率等于该氧化-还原对的标准还 /n= E︒。
任何二点间的连线的斜率愈大,意味着该原电势:∆G Fh氧化-还原对的标准还原电势愈高,其氧化形式的氧化能力就愈强;反之,二点间连线的斜率愈小,该氧化-还原对的还原形式的还原能力就愈强。
斜率最大的是连接H2MnO4和MnO2二点的连线,斜率最小(负值最大)的是连接Mn 和Mn2+的连线;所以在酸性水溶液中,氧化能力最强的是H2MnO4;还原能力最强的是金属锰。
3). 处在相邻二点连线的上方凸出来的点上的化学品种,其标准自由能比相邻二点的标准自由能的平均值高,该化学品种就容易发生歧化反应而转变为相邻二种氧化态的化学品种。
Mn3+ 和H2MnO4二个点都凸出在相邻二点连线的上方,这二个化学品种就都容易在酸性水溶液中发生歧化反应。
4). 处在相邻二点连线的下方凹下去的点上的化学品种,其标准自由能比相邻二点的标准自由能的平均值要低,那么相邻二种氧化态的化学品种就会通过氧化还原反应转变为处在该点上的化学品种。
Mn2+ 处在Mn和Mn3+ 二点连线的下方,所以在酸性溶液中Mn和Mn3+ 可以通过如下的反应转变为Mn2+:2Mn3+(aq) + Mn(s) = 3Mn2+(aq)。
MnO2也处在Mn2+ 和MnO4- 二点连线的下方,Mn2+ 和MnO4- 也能在酸性水溶液中反应变为MnO2:3Mn2+ (aq) + 2MnO4- (aq) + 6H2O(l) = 5MnO2 (s) + 4H3O+ (aq)。
这类反应也称为反歧化反应。
5). 若在氧化态自由能图的左上角附上 H 3O + -H 2 和O 2 -H 2O 二个氧化-还原对的斜率。
把它们和其它各条连线的斜率作比较。
还可以得知:还原能力比H 2 强的金属Mn 能和酸性水溶液中的H 3O + 离子反应产生氢气H 2;氧化能力比O 2 强的H 2MnO 4,Mn 3+,MnO 4- 都有可能和水反应放出氧气O 2。
iv )浓差电池()()()()2+42+Cu Cu 110M Cu 1M Cu ⨯--+电池反应:()()()()2+32+43Cu s Cu 1Cu 110Cu s mol dm mol dm +→⨯+- 其ε是因电解质溶液浓度差形成的,故称为浓差电池。
由于2Cu CuE E E +∅∅∅+-==,故εØ电池=0,则()()()()2+42+Cu 0.05910.0591110lg lg0.1182V 221Cu ε⨯+--+=-=-=由此可见,浓差电池的电动势与电极种类无关,只与浓度有关。
()()()()()()++22Pt,H 1H 0.01M H 1.0M H 1,Pt atm atm -+电池反应:()()()()++222H 1.0M H 12H 0.01M H 1atm atm +→+()()2420.010.05910.0591110lg lg 0.1182V 2211ε⨯+-=-=-= 0.1182pH 20.0591== 此例说明,电动势与电极反应有关,与pH 有关如氢电极的电解质溶液是弱酸溶液如0.1 mol/L 的HAc 溶液,K HAc=1.8×10-5计算:+H 1.310M ⎡⎤⨯⎣⎦-3pH =2.89 2++22H 2H H +H H 2+P 0.0591E E lg2H 0.0591lg H 0.1706V 2∅⎡⎤⎣⎦⎡⎤⎣⎦=-==-如与标准氢电极(正极)构成浓差电池,测量电池电动势:2+H 0.0591lg 0.0591pH 0.1706V 21ε⎡⎤⎣⎦+=-==,pH =2.89所以可以用电化学方法,即氢电极的浓差电池来测量溶液的pH ,也可求K HACv )由电池电动势测溶液的pH以金属电极如2+Cu Cu (+) 与+2H H (-)组成电池电极反应:()()()()2++2Cu1M H 1.0Cu 2H atm s XM +→+2+2H 0.0591E E lg 0.340.591pH 2Cu ε∅∅+⎡⎤⎣⎦+⎡⎤⎣⎦正负=--= 如25℃,测得ε=+0.48V ,则 0.480.34pH 2.360.0591-== 以上可见电池电动势,电极电势与酸碱平衡之间的关系。
再看一例: 例:试利用相关反应的标准电极电势求H 2O 的Kw 。
查表 ()+21 H e H E 0.000V 2∅+→=+(酸性) ()221H O + e H + OH E 0.82V 2-∅→=-- (碱性)电池反应 +2H OH H O V ε-∅+→=0.82 0.820.0591+1K 10H OH -⎡⎤⎡⎤⎣⎦⎣⎦== 0.82+13.875140.0591Kw H OH 1010 1.3310--⎡⎤⎡⎤⨯⎣⎦⎣⎦--====7. 沉淀平衡对电极电势的影响 ⅰ)AgAgCl 电极生成沉淀可以降低氧化型或还原型物质的浓度,从而改变电对的电势,如++Ag AgAg e Ag E +0.799V ∅+→== +++Ag Ag AgAg0.05911E E lg 1Ag ∅⎡⎤⎣⎦=- 当溶液中存在Cl -离子时,同时存在反应:+Ag Cl AgCl +→↓-Ag +浓度将降低,即 10+Ksp 1.810Ag Cl Cl -⨯⎡⎤⎣⎦⎡⎤⎡⎤⎣⎦⎣⎦--==代入Nernst 方程+++10Ag Ag Ag Ag10Ag AgCl 0.0591E E lg 1 1.810E0.0591lg1.8100.0591lg Cl ∅-∅-⎡⎤⎣⎦⨯⎡⎤+⨯⎣⎦--=-=-此时电极变成与[Cl -]相关,标准状态时,[Cl -] = 1 M+10AgAg AgClAgE E 0.0591lg1.8100.223V ∅∅-+⨯==即标准状态下()()Ag AgCl s Cl 1M -, 的电极电位非标准态时:AgAgAgClAgCl0.0591E E lg Cl 1∅⎡⎤⎣⎦-=-当(Cl -)= 0.1 M 时:()AgAgClE 0.2230.0591lg Cl 0.282V -=-=Ag/AgCl 电极可以代替标准氢电极,是一个很有用的二级参比电极。