第五章 现代化学学习理论
- 格式:ppt
- 大小:2.63 MB
- 文档页数:51

现代化学概述化学学科从近代化学算起已有两个世纪的历史,它与物理学和生物学都是自然科学中的基础学科,它们都有各自的使命和传统。
但由于其学科内容深处的盘根错结,随着发展,它们表现出相互之间越来越密切的关系。
化学学科之奠立和原子论近代化学源于1774 年拉瓦锡和1803年道尔顿分别提出的元素学说和原子学说。
元素和原子的假说应运而生,化学由此进入了持续至今以原子论为主线的现代化学时期。
现代化学的发展,从英国科学家汤姆生发现电子算起至今走过了一个世纪的历程,作为一门逐渐走向成熟的学科。
现代化学在理论、方法、应用和实验技术等方面,取得了巨大进步。
同时,作为现代科学体系的一个重要分支学科。
现代化学正随着现代科学的发展而不断发展。
并呈现出许多新的特征,因此,探讨现代化学的发展趋势揭示其新的发展特征,不仅可以帮助化学工作者深人了解现代化学发展的特点,而且对化学各专业的研究也具有理论指导意义。
借助于近代物理, 化学得以如虎添翼般地迅速发展 , 与物理成为能充分交流和合作的学科伙伴, 而进入分子水平前后的生物学也为化学提供了更多能充分发挥其作用的契机。
化学学科的核心任务仍然是在原子 - 分子水平上研究物质的组成、结构和性能以及相互转化的规律。
物质在分子水平上相互转化的过程称为化学过程。
生命过程以及极大部分制取物资和材料的过程都是化学过程。
在美国,对化学还有一种甚嚣尘上的提法,说化学是一门中心科学。
现代化学的发展,一方面作为经验方法基础的实验手段,发生了根本性的变化。
不仅传统的实验技术由于科学技术的进步得到进一步的改善,还出现了仪器现代化。
如微量分析和痕量杂质分析方面,出现了原子吸收光谱、极谱分析、库伦分析以及萃取、离子交换分离、色谱、电泳、层析等新的分析和分离方法。
另外,电子计算机的应用已经在图谱、数据储存和检索等方面发挥了越来越大的作用,有利地促进了化学操作的自动化过程。
现代化学研如果脱离了现代实验手段很难得到发展。

化学基本理论解读及学习方法指导化学基本理论解读及学习方法指导一、关于化学基本理论中学化学中的基础理论,是中学化学知识的重要组成部分,它对中学化学的学习起重要的指导作用。
学好中学化学基础理论,对提高中学化学学习效果具有重要的作用。
从中学化学体系来看,中学化学基础理论内容很广。
按照中学化学教学实际来分,中学化学基本理论包括以下四个部分的内容:1、物质结构理论。
该理论包含物质结构的四个方面知识——原子结构、分子结构、化学键和晶体结构。
2、元素周期律。
该部分包括元素周期律和元素周期表两个部分内容。
以上两个部分构成中学化学知识的主线,是研究元素及其化合物的重要依据。
3、化学反应速率和化学平衡。
它是研究可逆反应进行的规律,包含反应进程的快慢和完成程度以及影响反应速率和反应进行程度的影响因素等。
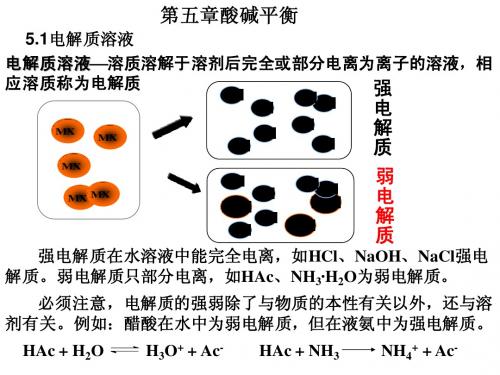
4、电解质溶液。
这部分内容着重研究电解质的强弱、弱电解质的电离平衡、盐类水解平衡以及影响平衡的规律,同时还设计电化学、中和滴定、胶体等部分的内容。
二、化学基础理论的学习根据现代学习理论,化学基础理论的学习也历经五个阶段:感知(准备)阶段——归纳(或演绎)推理阶段——验证阶段——联系整合阶段——运用阶段。
在五个阶段过程中,它们有具有不同的功能和任务。
1、感知(准备)阶段:感知(如观察)有关典型的化学事实,或者温习相关知识并感知要解决的问题,从而为归纳(或演绎推理)作出准备。
例如,在进行质量守恒定律的学习,学生在教师的提示下,明确“化学变化过程中反应物与生成物之间质量存在何种关系”的问题。
正确的感知是进行学习的前提。
2、归纳(或演绎)推理阶段。
在感知的基础上,通过对所感知的化学事实进行分析、归纳、综合,并应用能够化学概念概括化学事实,在假设并进行实验的基础上作出判断和推理,形成化学相关规律。
由于已经明确要研究的问题,于是不同的人可能作出各种假设,如生成物的质量可能大于、等于或小于反应物的质量。
在这一假设的知道下,学生进行相关实验的探究,并得到相应的实验结果。


读书笔记《<现代化新论>——中国的现代化之路》内容纲要(文字版)第一编大转变时代的新历史观第一章现代化理论与历史研究“现代化”还是“近代化”,应先正名时间尺度上,泛指从中世纪结束以来一直延续到今天的一个“长时程”价值尺度上,指区别于中世纪的新时代精神与特征现代化的含义是什么现代化是指近代资本主义兴起后的特定国际关系格局下,经济上落后国家通过大搞技术革命,在经济上和技术上赶上世界先进水平的历史过程。
现代化实质上就是工业化现代化是自科学革命以来人类急剧变动过程的统称现代化主要是一种心理态度、价值观和生活方式的改变过程,换句话说,现代化可以看作是代表我们这个历史时代的一种“文明的形式”。
现代化与马克思主义工业较发达的国家向工业较不发达的国家所显示的,只是后者未来的景象第二章西方的现代化思潮与现代化研究不断变化中的社会思潮现代化理论是第二次世界大战后的全球性工业化高潮阶段形成的关于社会变迁的新理论架构。
随着工业革命的兴起,西欧和北美在19世纪陆续进入了工业化时期,蒸汽机这个巨怪的出世塑造了一个新社会即工业社会的轮廓。
19世纪资本主义工业咄咄逼人的发展势头使乐观主义的论调占了优势。
第一次世界大战的炮声把社会进化的乐观主义思潮一下子轰得烟消云散。
现代工业文明走入歧途第二次世界大战后,特别是从20世纪50年代开始,西方的社会思潮开始出现新的转向从本质上说,是一种美国社会思潮20世纪60年代——“发展”与“现代化热”现代化研究是在20世纪50年代末和60年代中迅速兴起的一门社会科学的边缘学科。
首先由经济学家、政治学家、社会学家提出来。
最先开辟的新领域发展经济学现代化流派代表:著名经济史家华·惠·罗斯托其现代化论点也被称为“传播学派”(现代化问题的提出是密切为美国对外政策服务的)20世纪60年代对政治发展的研究中,至少有三大流派系统——结构功能研究法,主要受帕森斯的理论支配;社会过程研究法,主要是探讨政治行为过程与工业化、都市化等社会过程的关系;比较历史研究法,这是较为接近传统的一种方法现代化理论形成的历史特点1.从20世纪40年代后期到60年代,东西方处于尖锐对峙、国际关系很不正常的“冷战”时期。

《现代化学导论》教学大纲课程号:BB001012 学分:学时:36学时适用专业:应用化学,材料化学大纲执笔人:周杰、路福绥等大纲审定人:姜林一、说明1.课程的性质、地位和任务现代化学导论是应用化学专业的主要选修课之一,本课程是在必修课程学习的基础上,以双语教学的形式,根据各学科特点,培养学生自主学习能力、创造性思维能力、外语的实践能力和用英语表述学科内容和解决学科内容的能力。
同时了解化学各学科的最新发展。
2.课程教学的基本要求通过本课程的学习,要求学生掌握化学各学科的英语表达习惯和常用化学术语的表述方法,了解化学各学科的新理论、新技术和新方法。
3. 课程教学改革采用讲练结合的方式教学,以激发学生的学习兴趣,提高学习效率;通过让学生查阅化学期刊中各有关学科前沿性的论文,使学生了解化学各学科的发展方向,从而明确学生的学习目标。
二、教学大纲内容第一章流动注射分析和分子印迹聚合物电化学传感器(Flow Injection Analysis, FIA and Electrochemical Sensors Based on MolecularlyImprinted Polymers, MIPs(6学时)第一节 FIA原理(Principle of FIA)(1.5学时)1. 流动注射分析(FIA)2. 样品带的分散和FIA系统的设计(Dispersion of Sample Zoneand Design of FIA System)3. 样品带在试剂流中的分散(Dispersion of Sample Zone inReagent Current)4. FIA梯度技术(Gradient Technique of FIA)第二节 FIA实验技术(Experiment Techniques of FIA)(1.5学时)1. 单道FIA流路(Flow Way of Single Road FIA)2. 双道及多道FIA流路(Flow way of Double and MultipleRoad FIA)3. 停—流FIA(StopーFlow FIA )4. 其它实验技术(Other Experiment Techniques)第三节分子印迹聚合物的发展及其与传感器的一体化(Development ofMIPs and Their Integration with Transducers)(2学时)1. 传感器(Transducers)2. 分子印迹聚合物的设计(MIP Design)3. 聚合物与检测器的一体化(Polymer-Detector Integration)第四节分子印迹聚合物传感器及其市场趋势(MIP Sensors and Their Market Potential) (1学时)1. 分子印迹聚合物传感器(MIP Sensors)2. 分子印迹聚合物的市场趋势(Market Potential of MIP Sensors)本章教学方式和手段:汉、英双语讲授,多媒体教学。
第一章配位化学基础1、离子键:电负性相差较大的金属元素与非金属元素分别变成具稳定的八电子构型的正负离子后,通过离子间的经典引力而形成分子。
2、共价键:电负性相近的原子中的未成对电子,可通过共享的方式配对成键。
3、离域键:自由电子分布在多个原子周围形成的一种位置不定的键,既无方向性又无饱和性,键能适中。
金属键属于离域键。
4、配位键:若甲方具有已配对的孤对电子,乙方具有能量与之相近的空轨道,则成键的连个电子完全有甲方提供,如此所形成的化学键称为配位键。
配位键早期称络合物,中心离子或原子必须具有空的低能轨道,通常是金属(尤其是过渡金属)离子或原子。
5、配合物结构:M表示中心原子或离子,L表示配体,l表示配体数,X表示外界阴离子,K表示外界阳离子。
6、按配体种类,分为:卤合配合物、含氧配合物、含氮配合物、含碳配合物以及其它;按配体分子中的配原子数目,分为:单齿配合物、多齿配合物、螯合物;按核的数目,分为:单核配合物、多核配合物。
卤离子为弱配体,以O、S、N为配原子的配体是中强配体,以C原子为配位原子配体是强配体。
常见两可配体:N O2-(硝基)、O NO-(亚硝酸根)、S CN-(硫氰酸根)、SC N-(异硫氰酸根)、C N-、C N-;同时连接两个以上中心原子的配体称为侨联配体。
四齿以上的配位化合物常称为螯合物。
7、影响配位体大小的因素:中心原子、配体、环境。
8、配体相同时,中心原子的半径越大,可能的配位数越多;中心离子相同时,中心原子的半径越大,配位数越低;中心离子的电荷数越高,可能的配位数越多。
当中心离子的氧化数分别为+1,+2,+3时,可能的配位数通常为2,4或6,6;其它条件相同时,配体的浓度越高,越易形成高配位数的配合物;其它条件相同时,溶液的温度越高,越难形成高配位数的配合物。
9、配合物的命名:从后向前或从右向左;内外界之间加“酸”或“化”分开;外界卤素用“化”分开;配体与中心离子(原子)之间加“合”分开;中心离子氧化数可紧跟在工薪离子后用罗马字母表示,并加上小括号;配位体个数用中文一、二、三…表示(“一”可略);如果配合物中有多种配位体,则它们的排列次序为(金属离子)(无机阴离子)(无机分子)(有机分子);不同配位体的名称之间还要用中圆点“·”分开。