高等无机化学
- 格式:doc
- 大小:89.55 KB
- 文档页数:5



高等无机化学pdf
1 高等无机化学是一门重要学科
高等无机化学是一门研究无机物质的结构、性质以及生成机理的重要学科。
它研究分子结构、晶体结构、形成原理、反应动力学、分子模型、反应相位等,还开展研究元素本质和复杂分子的构筑、化学性质及反应机理的研究,研究多室温度下的无机化学反应的物质动力学,研究各种有机无机复合物的构筑机理和反应机理,以及开发新型功能材料的结构表征和产能增强等。
2 功能性的材料的研究
无机化学反应相关领域还有功能性材料的研究,这些材料能够嵌入系统中,承担不同的功能,广泛应用于新材料和新能源等领域,逐步达到节能减排、迎合持续可持续发展的目标。
例如,新型能源电池材料,金属基光催化及应用,有机硅材料及智能器件,以及能源转换化学等。
3 无机化学的应用领域
无机化学的应用非常广泛,几乎涵盖了所有的科学技术领域。
它的应用很广,从为制造工业提供原料到农业微量元素补充,从催化反应到能源材料开发等,无机化学都可以发挥重要作用。
在工业上,它是很关键的一门科学,因为它可以为制造基本原料提供帮助,也可用于检测材料的活性、合成新元素,以及制造能源技术等。
它可以为我们的社会发展提供支持。
总之,高等无机化学是一门重要学科,它已经广泛应用于各行各业,为人类的科技进步发挥着巨大作用。


高等无机化学书评价
高等无机化学是大学化学专业的重要课程之一,涉及到多种元素和化合物的性质、反应以及结构等内容。
在学习这门课程时,选择一本好的教材是至关重要的。
今天我将就高等无机化学教材的评价展开讨论,通过分析教材的内容、结构、示例和实践导向性,来评价一本好的高等无机化学教材应该具备的特点。
首先,一本优秀的高等无机化学教材应该具有清晰明了的内容结构。
教材应该按照元素周期表的排列顺序,系统地介绍各个元素的性质、反应以及化合物的结构和性质。
同时,教材还应该将各个章节之间的内容进行有机衔接,确保学生能够系统地理解和吸收知识。
其次,教材应该提供丰富多样的示例和实例,以帮助学生理解抽象的理论知识。
通过具体的化学实验、实际应用以及工业生产等例子,学生能够更好地将理论知识与实际应用相结合,深入理解高等无机化学的概念和原理。
第三,一本优秀的高等无机化学教材应该具有实践导向性。
教材不仅应该注重理论知识的传授,更要注重培养学生的实际动手能力和解决问题的能力。
通过设计实验、解决问题的案例,学生能够更好地掌握高等无机化学知识,并将其运用到实际生活和工作中。
综上所述,一本优秀的高等无机化学教材应该具备清晰的内容结构,丰富的示例和实例,以及实践导向性。
通过这些特点,学生能够更好地理解和掌握高等无机化学知识,提高学习效率和学习成果。
希望未来的高等无机化学教材能够不断完善和更新,为学生提供更好的学习体验和知识传授。




高等无机化学简明教程第一章:导论高等无机化学作为化学学科中的重要分支,主要研究无机物质的结构、性质以及其在化学反应中的应用。
与有机化学侧重于碳基化合物的特性和反应机理不同,无机化学涵盖了从单质到无机化合物的广泛领域,包括金属、非金属元素及其化合物的研究。
第二章:原子结构与周期表原子结构是理解无机化学基础的关键。
原子由质子、中子和电子组成,质子和中子位于原子核中,电子则围绕核外运动,形成电子壳层。
这些电子层次决定了原子的化学性质和反应能力。
周期表则将所有已知的元素按照原子序数和化学性质进行了分类,提供了对元素周期性性质的清晰理解。
第三章:化学键与晶体结构化学键的形成是无机化合物稳定性的基础。
离子键、共价键和金属键是常见的化学键类型,它们决定了化合物的结构和物理性质。
晶体结构描述了固体中原子或离子的排列方式,涉及晶格参数和晶胞结构的详细分析。
第四章:主要元素的化学特性无机化学研究的重要对象是各种主要元素及其化合物。
氢、氧、氮、碳、硫等元素在无机化学中具有关键作用,它们的化学性质和反应机制对于理解大自然中的化学过程至关重要。
第五章:过渡金属与配位化学过渡金属是无机化学中的核心研究对象之一,它们的特殊电子结构使得其在催化、电化学和生物化学领域中有重要应用。
配位化学研究则探索了配合物的结构、配位数及其在催化剂和材料科学中的应用。
第六章:固体与配位化合物的应用无机化学的应用涵盖了从催化剂到材料科学的广泛领域。
无机材料如半导体、陶瓷、磁性材料和超导体在现代技术和工业中发挥着重要作用。
配位化合物的设计与合成对新材料的开发具有深远的影响。
第七章:反应动力学与热力学理解化学反应的动力学和热力学条件对于优化反应条件和预测反应结果至关重要。
反应速率、活化能和反应平衡常数是评估化学反应过程中能量变化和速率的关键参数。
第八章:核化学与放射性核化学研究探索了放射性元素的性质及其在医学和工业中的应用。
核反应、核衰变和放射性同位素标记技术对于生物医学研究和核能应用具有重要意义。

第一章 对称性和群论对称性存在于一切事物之中,分子也不例外。
无机化学研究无机分子的电子组态、空间结构、化学键类型;阐明它们的光、电、磁等物理性质以及化学反应性。
现代量子理论及现代物理研究方法推动了无机化学的发展,但是目前还不可能得到描述在分子中的电子行为的精确波函数。
实验观察到许多分子具有一定的对称性,考虑分子的对称性或许能得到分子波函数的某些信息,事实上,利用对称性能将波函数分类,有助于解决化学键和分子结构的问题。
波函数与对称性是通过群论来联系的,本章要介绍对称性和群论的基本概念,如对称操作,对称点群,群的表示理论以及群论应用的实例。
§1.1 对称操作1.对称操作对称操作是使物体作一种运动,完成这种运动之后,物体的每一点都与物体原始取向时的等价点(或可能是同样的点)相重合。
例如在两维笛卡尔坐标轴上离原点±1单位有以下4个点(图1-1 a ),我们可以通过一定的动作,使这些点的位置改变,如(1)将它们绕着原点逆时针方向转90° ,这时点1到了点2,点2到了点3,点3到了点4的位置(如图1-1 b ),它们离开原点都有相同的距离,通过旋转一定的角度可以完全重合,因此这些点称为等价点 (Equivalent Point),这样的动作——绕原点的转动就称为对称操作 (Symmetry Operation)。
通过上面的例子看到,假如我们记下物体在完成一个运动前的位置取向以及在运动后的位置和取向,如果这两个位置和取向是不可区分的话,这种运动就是对称操作,而与原始构型不可区分的构型就称为等价构型 (Equivalent Configuration)。
对于分子来说,对称操作就是使分子中的原子改变位置的操作。
经过这种操作除了交换原子,分子的构型不变。
例如将 H 2O 分子放在yz 平面内,z 轴平分角HOH 。
作绕z 轴转动180° 的操作,结果氧原子不动,两个氢原子交换位置,因为氢原子完全是等同的,得到的构型与原来的构型没有区别,所以绕z 轴转动180° 的操作使H 2O 分子达到它的等价构型,该操作即称为对称操作。
高等学校教材·无机化学无机化学是化学的一个分支,研究有机物质中的无机元素的合成和性质。
这个领域的研究包括无机化合物的合成和构型,物质的结构,物理和化学性质,无机反应机理,以及无机物的晶体学。
无机化学作为一门基础学科,被广泛应用于材料科学和工业制造,其重要性不言而喻。
无机化学是一门老牌学科,许多无机化合物和反应机理都是历史悠久的发现,具有指导意义。
近年来,现代化学家不仅基于经典模式,而且根据实验特点开发出新的模型和理论,扩大了我们对无机物的认识。
例如,现代计算机技术将无机物的结构和性质模拟计算可能,使得新的发现得以展示。
无机化学主要研究包括金属和非金属元素及其合成物,还有络合物、水溶液、溶剂、气体以及一些其他复杂的有机无机混合物。
金属物质是无机化学的一个重要的研究内容,其特性决定了其在实际应用中的广泛性。
非金属元素包括氢、氧、氮和硫等元素,它们除了可以形成简单的化合物外,还可以分子的形式构成各种有机无机材料。
无机化学的研究通常包括化合物的构型研究、晶体学研究、表面和界面研究、薄膜研究以及各种金属、非金属元素及其合成物的研究。
无机化学的发展主要由它的理论和实验学研究相互促进,它们之间的协作促进了无机化学的发展。
在研究中,实验和计算机模拟在获取必要信息和解释实验结果上起到重要作用。
无机化学是一门涉及研究面广、应用领域广的学科,它的发展对材料科学、化工、石油化工、冶金、核能科学等领域都有重大的影响。
无机化学的发展可以大大提高人类的核能利用率,改善我们的生活、工作,推动社会的进步及可持续发展。
因此,无机化学的学习是必要的。
高等学校针对无机化学的学习,出版的教材不仅仅要详细介绍无机化学理论知识,而且要涵盖经典实验和计算机模拟实验,使学生掌握化学实验技能和分析技能,为他们进行无机化学实践和研究打下坚实的基础。
本书对这方面的内容也进行了深入的介绍,帮助学生更好地掌握无机化学的基本理论和实践,为他们未来的学习、实践和研究做好准备。
高等无机化学汇总一、引言高等无机化学是化学学科的一个重要分支,主要研究元素、化合物和配合物的性质、结构和反应。
它不仅拓宽了无机化学的知识领域,而且为其他化学分支提供了基础理论和研究方法。
本文将对高等无机化学的基本概念、重要理论和相关应用进行汇总。
二、基本概念1、原子结构:原子是由质子、中子和电子组成的。
元素的化学性质主要由其最外层的电子数决定。
2、分子结构:分子的结构与其性质密切相关。
通过了解分子的几何构型、键能、振动频率等,可以预测其物理和化学性质。
3、配合物:由中心原子或离子与配位体通过配位键结合形成的复杂化合物称为配合物。
配合物的稳定性取决于中心原子或离子的电荷和半径,以及配位体的性质。
三、重要理论1、酸碱理论:酸和碱的定义已经从简单的质子转移扩展到了更广泛的领域,包括软硬酸碱理论、电子酸碱理论等。
2、氧化还原理论:该理论主要解释了电子转移的过程以及由此产生的化学反应。
在无机化学中,这一理论对于理解元素和化合物的性质尤其重要。
3、配合物化学:配合物化学是研究配合物结构和性质的化学分支。
配合物的化学键理论、稳定性、配位场理论等都是配合物化学的重要内容。
四、应用领域1、材料科学:高等无机化学在材料科学中的应用广泛,如纳米材料、陶瓷、玻璃、半导体等都是通过高等无机化学的理论和技术制备的。
2、环境科学:在环境保护中,高等无机化学提供了诸多有效的解决方案,例如重金属的去除、污染水的处理等。
3、生物医学:在生物医学领域,高等无机化学的贡献包括药物设计、诊断试剂的开发以及生物材料的合成等。
五、结论高等无机化学作为化学的一个重要分支,不仅在理论层面上深化了我们对元素、化合物和配合物的认识,还在实践层面为材料科学、环境科学和生物医学等领域提供了强大的支持。
随着科技的发展,高等无机化学将在更多领域发挥其重要作用,为人类社会的发展做出贡献。
高等无机化学生物无机化学课件一、引言高等无机化学生物无机化学课件是一门重要的科学课程,它涵盖了无机化学、生物化学和物理化学等多个学科的知识。
参考书1 陈慧兰等编,《理论无机化学》,高等教育出版社,19892 项斯芬编著,《无机化学新兴领域导论》,北京大学出版社, 19883沈裴凤等编,《现代无机化学》,上海科学技术出版社,1985 4朱文祥等编,《中级无机化学》,北京师范大学大学出版社,19935唐宗薰,《无机化学热力学》,西北大学出版社,19906Cotton,F.A,and Wlkinson,G.,“Advanced Inorganic Chemistry”4th ed,Wiley,New York,19807 Huheey,J.E., “Inorganic Chemistry Principles of Structure and Reactivity”, 3rd ed., Harper & Row New York, 19838 Doug1as R.E., McDaniel D.H, and Alexander J., “Con-cepts and Models of inorganic Chemistry”,2rd ed., Wiley New York, 19839 Jolly,W.J.,“Modern Inorganic Chemistry”, McGrawHill New York, 1984..第一章原子、分子及元素周期性第一节原子结构理论概述第二节原子参数及元素周期性第三节共价键理论概述第四节键参数与分子构型第五节分子对称性与点群第六节单质的性质及其周期性递变规律第七节主族元素化合物的周期性性质以上七节主要自学,要求掌握:1 用徐光宪的改进的Slater规则计算电子的屏蔽常数2 了解电负性的几种标度,理解环境对电负性的影响和基团电负性的概念3 键参数价层电子对互斥理论分子对称性知识4 单质及其化合物的一些性质的周期性变化规律同时,还要特别注意5 掌握周期反常现象的几种表现形式及合理解释习题:1,2,3,4,6,7,8,10,11,12,13,15,17第一章原子、分子及元素周期性1 原子的性质(1) 屏蔽常数Slate屏蔽常数规则将原子中的电子分组(1s);(2s,2p);(3s,3p);(3d);(4s,4p);(4d);(4f);(5s,5p);(5d);(5f)等位于某小组电子后面的各组,对该组的屏蔽常数σ=0,近似地可以理解为外层电子对内存电子没有屏蔽作用;同组电子间的σ=0.35 (1s例外,1s的σ=0.30);对于ns或np上的电子,(n-1)电子层中的电子的屏蔽常数σ=0.85,小于(n-1)的各层中的电子的屏蔽常数σ=1.00;对于nd或nf上的电子,位于它左边的各组电子对他们的屏蔽常数σ=1.00。
名词解释1 钻穿效应:定电子避开其余电子的屏蔽,其电子云钻到近核区,受到较大的核电荷作用,使其能级降低的效应。
2 屏蔽效应:其他电子对某一电子的排斥作用而抵消了一部分核电荷,从而引起有效核电荷的降低,削弱了核电荷对该电子的吸引。
3 价态电离能:原子以杂化轨道参与成键时,移去电子所需能量4 价态电子亲和能:原子以杂化轨道参与成键时,接受电子时所放出的能量5 原子的电负性:一个分子中的原子对电子吸引力的能力6 电子亲和能:基态的气态原子获得一电子成为-1价气态离子时所放出的能量7 电离能:基态的气态原子或气态离子失去一个电子所需要的最小能量8 物质波:又称德布罗意波,是指空间中某点某时刻可能出现的几率,其中概率的大小受波动规律的支配9 几率密度:电子在核外空间某处单位体积内出现的几率10 等几率密度面:将核外空间电子出现的几率密度相当的点用曲面连接起来11 径向分布函数的物理意义:在半径为r处单位厚度球表层内找到电子的几率,反映了电子云的分布随半径r变化的情况12 有机金属化合物:至少还有一个金属-碳键的化合物13 ψ2的物理意义:原子核外空间某点电子出现的几率密度14 测不准原则:不可能同时准确地测定微观粒子的位置和动量15 原子簇:原子间相互成键形成笼状或者多面体结构的一类化合物16 金属原子簇:金属原子通过金属-金属键至少与两个同类原子直接键合形成多面体原子骨架的化合物17 溶剂的拉平效应:当一种酸溶于某种溶剂时,酸中的质子完全转到溶剂分子中,这种将酸(或碱)的强度拉平的作用称为溶剂的拉平效应18 硬碱:一些电负性大、半径较小、不易被氧化、不易变形的原子,以这类原子为配位原子的碱19 Lewis酸:凡能接受电子对的物质20 Lewis碱:凡能给出电子对的物质二、简答下列问题.1. 基态光谱项的确定原则.①同一组态(即n,l相同)的原子,S只最大者能级最低;②S值相同时,L值最大者,能级最低;③L和S值均相同时,半满前,J值越小,能级越低;半满后,J值越大,能级越低。
2. 电子光谱项的基本规律.a 同种轨道不同电子数的电子组态中,电子数互补的电子组态,具有相同的光谱项。
b 无论何种电子组态,只要是全充满(s2,d10,p6),它的光谱项为1s3.原子核外电子的排布的基本原则.①Pauling不相容原理;②洪特规则;③能量最低原理。
4. 为什么氧原子的电子亲和能比硫原子的电子亲和能小?第二周期原子半径比第三周期小得多,电子云密度大,电子间排斥力强,以致接受一个电子形成负离子时放出的能量少,而第三周期元素,原子体积较大,且同一价电子层中还有空的d轨道,可容纳电子,电子间斥力显著减小,因而接受一个电子形成负离子时放出的能量较前者有所增加。
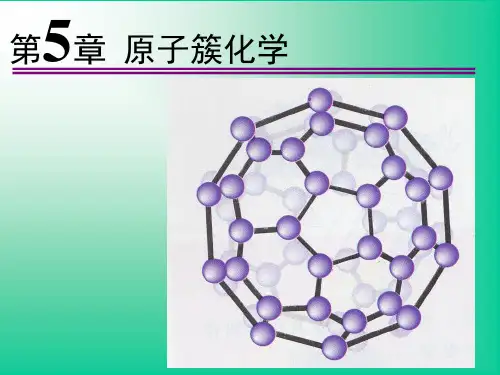
5原子簇主要包括哪几类?①P 4,P 4O 10,P 4O 6;②无配体原子簇;③硼烷及硼烷阴离子;④富勒烯及其衍生物;⑤金属原子簇。
6金属原子簇主要包括哪几类?①多核的金属羰基、亚硝酰配合物;②低价卤化物和羧酸配合物;③无配体原子簇。
7. 写出原子的电子光谱项和电子光谱支项的基本形式.电子光谱项的基本形式:2S+1L ; 电子光谱支项的基本形式:2S+1L J8元素K 和Cu 的最外层电子结构相同,均为4S 1,但第一电离能不同,I 1(K)=418.9kJ/mol ,I 1(Cu)=745.5kJ/mol ,解释此现象。
K :S 区元素,次外层的3s 23p 6电子云分布较密集于核附近,对最外层电子(4s 1)的屏蔽作用大,4s 1电子容易失去。
Cu :ds 区元素,次外层电子结构为3d 23p 63d 10,d 电子云伸展范围较大,对最外层电子的屏蔽作用较差,有效核电荷大,4s 1电子不易失去。
9SP3杂化轨道的电负性X(SP 3) 、SP2杂化轨道的电负性X(SP 2)和SP 杂化轨道的电负性 X(SP)之间大小关系是什么?X(SP)>X(SP2)>X(SP3)10 σ 轨道的电负性与п轨道的电负性之间的大小关系。
σ >п 11原子轨道的相对论性收缩.原子体系中,电子运动的速率极快,尤其是原子序数较大的原子,近核的S 和P 电子受核的引力较大,其运动速度可与光速相比,使得电子的相对论质量显著增加,导致近核的S 和P 轨道半径减小,即近核的S 和P 轨道半径发生了收缩,称为原子轨道的相对性收缩。
12在同类杂化轨道上,不含电子的电负性X(0)、含一个电子的电负性X(1)和含2个电子的电负性X(2)之间的大小关系。
X(0) > X(1) > X(2)13. 电子云的角度分布图与原子轨道的角度分布图的区别. 电子云角度分布图瘦,正值,原子轨道角度分布图有正负。
三计算Li 原子的第一电离能.Li(3) 1s 22s 1 I 1(Li)=E(Li +)-E(Li)=mol kJ ev /72.55576.5285.02-36.13-13.0-36.13-2-13.0-36.13-2222222==⎪⎭⎪⎬⎫⎪⎩⎪⎨⎧⎥⎦⎤⎢⎣⎡⨯⨯+⎥⎦⎤⎢⎣⎡⨯⨯⎥⎦⎤⎢⎣⎡⨯⨯)()()( 四、某原子外层的电子组态为d1,推定其电子光谱项,并讨论其简并度.2,1,0,2±±==l m l ,m s=+-1/2,则简并度为10;,光谱项为D 2。
五Ca(Z=20)原子核外电子的排列有以下两种可能的排列顺序:(1) 1S22S22P63S23P63d2 或 (2) 1S22S22P63S23P64S2 ;应用Slater 方法,通过计算Ca 原子中3d 、4S 电子的能量E 和E4S ,判断其核外电子合理的排列顺序.解:通过(1)排列,价层被屏蔽电子为3d 电子,求E3d 电子排列顺序 1s22s22p(不相邻内层) 3s23p6(相邻内层) 3d2(同层) 单电子屏蔽常数 1.0 1.0 0.35 产生屏蔽作用的电子数1081d 3σ:35.18135.080.1100.1=⨯+⨯+⨯65.135.1820)(33=-=-=*d d Ca Z Z σevn Z ev E d 1.4365.1ev 6.136.132223-=⨯-=⨯-=**)(按(2)排列,价层被屏蔽电子为4s 电子,求E4s 电子排列顺序 1s22s22p6 3s23p6 4s2 单电子屏蔽常数1.00.85 0.35 产生屏蔽作用的电子数 1081s 4σ:15.17135.0885.0100.1=⨯+⨯+⨯85.215.1720)(44=-=-=*s S Ca Z Z σevev n z ev E s 07.87.385.26.13)(6.132224-=⨯-=⨯-=**d 34E E s ,则(2)式排列合理六、已知氢原子基态的波函数为: Ψ1s = [1/(πa 03 )]1/2 exp[- r/a0] 式中, r 是电子离核的距离,a0的数值为52.9pm,是氢原子的第一个Bohr 轨道的半径。
计算在离核为52.9pm(即a0)的空间某一点上:(1) Ψ1s 的数值;由公式得到 (2) 电子出现的几率密度ρ;p=k(3) 在1pm3 体积中电子出现的几率P .P= 七、如何制备[Ln(C5H5)3]?LnCl3+3NaC5H5 THF Ln(C5H5)3+3NaCl 八、求2D 光谱项的光谱支项.2D :2,21,212===+L S S2325)1(),(,=--++=S L S L S L J232252D D ,九、如何制备William Zeise Salt ?画出Zeise Salt 阴离子的结构示意图,并说明其成键过程。
解;1 制备 K 2[Ptcl 4]+H 2C=CH 2 SnCl 2 K[PtCL 3(C 2H 4)]+KCl 成键过程 1.Pt :[Xe] 4f 145d 96s 1 Pt[Ⅱ]:[Xe]4f 145d 8 在配体的影响下,5d 轨道电子重新分配形成,dx2-y2空轨道,其与6s6p x 6p y 轨道形成四个dsp2杂化轨道 2 其中三个杂化dsp2轨道分别接受Cl -1的孤对电子形成3个σ键3 C2H4上的π电子进入剩余的dsp2空轨道,形成σ键,同时dsz 2上的电子进入π*轨道形成一个反馈π轨道。
在Pt[Ⅱ]和C2H4间形成了σ-π双键. 十、列举制备二茂铁的三种方法。
(1)C 5H 6+Fe300℃,K2O,N2 Fe(C 5H 5)2+H 2 (2)2NaC 5H 5+FeCl 2 THF Fe(C 5H 5)2+2NaCl(3)C 5H 6+FeCl 2+(C 5H 5)2NH THF Fe(C 5H 5)2+2(C 5H 5)2NH·HCl 十一如何制备二苯铬?3CrCl 3+2Al+6C 6H 6→3[Cr(C 6H 6)2](AlCl 4)[Cr(C 6H 6)2]++S 2O 42-+4OH -→Cr(C 6H 6)2+SO 32-+2H 2O十二、如何制备双核原子簇[Re 2C l8]2- ? 画出[Re 2C l8]2-的结构示意图,并说明其成键过程。
制备:(1)2KReO 4+2NaH 2PO 2+8HCl→K 2Re 2Cl 8+4H 2O+2NaH 2PO 4 (2)2KReO 4+4H 2+8HCl(浓)高压 K 2ReCl 8+8H 2O (3)2ReCl 9+EtNH 2Cl 熔融 3(Et 2NH 2)2Re 2Cl 8 (2)成键:a 、Re :[Xe]4f 145d 56S 2 Re( Ⅲ):[Xe]4f 145d 4b 、在配体的影响下,5d 轨道电子重新分配形成dx2-y2空轨道,其与6S6PxPy 轨道组成4个dsp2杂化空轨道,分别和cl-的3Px 上的孤对电子形成4个σ键C 、Re( Ⅲ)的5dz2轨道和6Pz 轨道杂化,形成2个dp 杂化轨道上下两个Re( Ⅲ)的成键轨道间形成σ键。
d 、两个Re 的 dxz-dxz 重叠在xz 平面和dyz-dyz 重叠在yz 平面形成两个π键(d-d π键)E 、两个Re 的dxy-dxy 面对面重叠形成 键十三、计算d 1 电子的总角量子数j 的值,并用矢量图表示其物理意义。
(1)已知d 1电子的轨道叫量子数l=2,自旋角量子数s=1/2根据s l J P P P +=23,25)1(),(j =--++=s l s l s l物理意义:1.轨道角量子数为l=2. 2.轨道角动量为Pl=[l(l+1)]1/2h=2.45h 3.自旋角量子数为s=1/24自旋角动量Ps=[s (s+1)]1/2h=0.87h 5总角动量Pj j=5/2,Pj=[j(j+1)]1/2=2.96h J=3/2, Pj=[j(j+1)]1/2=1.94h十四、完成下列反应方程式1. Fe(s) + 5 CO(g) 200ºC, 20MPa Fe(CO)5 (l)2.Ni(s) + 4 CO(g) 30ºC Ni(CO)4 (l)3.Re2O7 + 17 CO(g) 250ºC, 35MPa Re2(CO)10(s) + 7 CO24.Fe(CO)5 + 2 Na Na2[Fe(CO)4]+ CO5.Mn2(CO)10 + C l22Mn(CO)5Cl6.Fe(CO)5 + PPh3(Ph2P)Fe(CO)4 + CO7.Fe(CO)5 + 2NO Fe(CO)2(NO)2 + 3CO8.Fe(CO)5 + Br2Fe(CO)4Br2 + CO9.Fe(CO)5 + C4H6[Fe(CO)3(C4H6)] +2CO10.Fe(C5H5)2 + (CH3CO)2O H3PO3(CH3COC5H4)Fe(C5H5) + CH3COOH。