原子结构一轮复习
- 格式:ppt
- 大小:1.77 MB
- 文档页数:22

高考化学一轮复习讲义—原子结构、核外电子排布规律[复习目标]1、掌握原子结构中微粒数目的关系。
2、了解原子核外电子的运动状态、能级分布和排布原理。
3、能正确书写1~36号元素原子核外电子排布式、价层电子排布式和轨道表示式。
考点一原子结构、核素、同位素1.原子结构(1)构成微粒及作用(2)微粒间的数量关系①阳离子的核外电子数=质子数-所带电荷数。
②阴离子的核外电子数=质子数+所带电荷数。
(3)微粒符号周围数字代表的信息2.元素、核素、同位素(1)元素、核素、同位素的概念及相互关系(2)同位素的特征①同一元素的各种核素的中子数不同,质子数相同,化学性质几乎完全相同,物理性质差异较大。
②同一元素的各种稳定核素在自然界中所占的原子百分数(丰度)不变。
(3)氢元素的三种核素11H:名称为氕,不含中子;21H:用字母D表示,名称为氘或重氢;31H:用字母T表示,名称为氚或超重氢。
(4)几种重要核素的用途核素23592U146C21H31H188O用途核燃料用于考古断代制氢弹示踪原子1.一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原子()2.所有原子核内一定都有中子()3.质量数就是元素的相对原子质量()4.质子数相同的微粒一定属于同一种元素()5.核外电子数相同的微粒,其质子数一定相同()6.核聚变如21H+31H―→42He+10n,因为有新微粒生成,所以该变化是化学变化()7.氢的三种核素形成的单质有6种,它们物理性质有所不同,但化学性质几乎完全相同()答案 1.√ 2.× 3.× 4.× 5.× 6.×7.√一、微粒中“粒子数”的确定1.月球上的每百吨32He聚变所释放出的能量相当于目前人类一年消耗的能量,地球上氦元素主要以42He的形式存在。
已知一个12C原子的质量为a g,一个32He 原子的质量为b g,N A为阿伏加德罗常数。

原子结构1.人类认识原子的历史是漫长的。
下列与原子结构模型的演变无关的科学家是( ) A.玻尔B.道尔顿C.卢瑟福D.爱因斯坦【答案】D【解析】A项,玻尔在1913年提出轨道式原子模型,故不选A;B项,道尔顿在1803年提出实心球式原子模型,故不选B;C项,卢瑟福在1911年提出核式原子结构模型,故不选C;D项,爱因斯坦是一位物理学家,主要进行物理理论研究,与原子结构模型的演变无关,故选D;故选D。
2.首次将量子化概念运用到原子结构,并解释了原子稳定性的科学家是()A.玻尔B.爱因斯坦C.门捷列夫D.鲍林【答案】A【解析】A项,玻尔首次将量子化概念应用到原子结构,并解释了原子稳定性,故A 正确;B项,爱因斯坦创立了代表现代科学的相对论,故B错误;C项,门捷列夫提出元素周期律,故C错误;D项,.鲍林根据光谱实验的结果,总结出多电子原子中电子填充各原子轨道能级顺序,提出了多电子原子中原子轨道的近似能级图;故选A。
3.下列各电子层中不包含d能级的是()A.N电子层B.M电子层C.L电子层D.O电子层【答案】C【解析】第1电子层只有1个能级(1s),第2电子层有2个能级(2s和2p),第3电子层有3个能级(3s、3p和3d),依次类推。
前两个电子层没有d能级,从第3电子层才开始出现d能级。
4.下列原子轨道中,可容纳电子数最多的是()A.5d B.6p C.4f D.7s【答案】C【解析】能级中所含原子轨道的数目取决于能级种类,与电子层序数无关,s、p、d、f 能级分别含有1、3、5、7个原子轨道,每个原子轨道最多容纳2个电子,所以4f轨道容纳电子数最多。
5.原子结构模型的演变如图所示,下列符合历史演变顺序的一组排列是( )A.(1)(3)(2)(4)(5) B.(1)(2)(3)(4)(5) C.(1)(5)(3)(2)(4) D.(1)(3)(5)(4)(2)【答案】A【解析】1803年,英国化学家道尔顿提出原子论,他认为原子是微小的不可分割的实心球体,对应(1);1904年,汤姆孙在发现电子的基础上提出了原子结构的“葡萄干布丁”模型,对应(3);1911年,英国物理学家卢瑟福提出了原子结构的核式模型,对应(2);1913年,丹麦科学家玻尔在卢瑟福核式模型的基础上建立起核外电子分层排布的原子结构模型,对应(4);20世纪20年代中期建立量子力学理论,产生了原子结构的量子力学模型,对应(5);综上所述,正确的演变顺序为(1)(3)(2)(4)(5),故选A。


原子结构与元素的性质1.按电子排布,可以把周期表中的元素划分为5个区,以下元素属于p区的是() A.Fe B.Mg C.Br D.Cu【答案】C【解析】Fe的外围电子排布式为3d64s2,属于d区元素,A项错误;Mg的外围电子排布式为3s2,属于s区元素,B项错误;Br的外围电子排布式为4s24p5,属于p区元素,C 项正确;Cu的外围电子排布式为3d104s1,属于ds区元素,D项错误。
故选C。
2.下列关于原子结构与元素周期表的说法正确的是()A.电负性最大的元素位于周期表的左下角B.某基态原子的价电子排布式为4s24p1,该元素位于周期表第四周期IIIA族C.2s轨道在空间呈双球形分布D.基态原子3p能级电子半充满的原子第-电离能小于3p能级有两个未成对电子的原子【答案】B【解析】A项,非金属越强,则电负性越大,电负性最大的元素位于周期表的右上角,A项错误;B项,某基态原子的价电子排布式为4s24p1,可知最外层为第四层,且含有3个电子,该元素位于周期表第四周期IIIA族,B项正确;C项,s能级的轨道为球型,则2s轨道在空间呈球形分布,C项错误;D项,核外电子半充满为稳定结构,则基态原子3p能级电子半充满的原子第一电离能大于3p能级有两个未成对电子的原子,D项错误;故选B。
3.电子排布式为[Ar]3d54s2的元素是()A.稀有气体元素B.过渡元素C.主族元素D.卤族元素【答案】B【解析】在最外能层p轨道上填充有电子且未满时,一定为主族元素;最外能层p轨道上未填充电子,而在d(或f)轨道上填充有电子的元素,一定是过渡元素。
故电子排布为[Ar]3d54s2的元素为过渡元素。
故选B。
4.基态原子的核外电子排布式为[Kr]4d105s1的元素所属的区、周期和族为()A.p区、第五周期、第ⅠB族B.ds区、第五周期、第Ⅰ族C.d区、第四周期、第ⅠB族D.ds区、第五周期、第ⅠB族【答案】D【解析】依据Cu原子的核外电子排布[Ar]3d104s1进行迁移,则可推断出核外电子排布式为[Kr]4d105s1的元素属于第五周期第ⅠB族元素,位于ds区。

原子结构与性质1.在基态多电子原子中,关于核外电子能量的叙述错误的是( )A.最易失去的电子能量最高B.同一个电子层上的不同能级上的原子轨道,能量大小不同C.p轨道电子能量一定高于s轨道电子能量D.在离核最近区域内运动的电子能量最低【答案】C【解析】A项,能量越高的电子在离核越远的区域内运动,也就越容易失去,故A不符合题意;B项,在第n层中不同能级的能量大小顺序为E(ns)<E(np)<E(nd)<E(nf)……,同一个电子层上的不同能级上的原子轨道,能量大小不同,故B不符合题意;C项,同一能层中的p轨道电子能量一定比s轨道电子能量高,但外层s轨道电子能量则比内层p轨道电子能量高,故C符合题意;D项,电子首先进入能量最低、离核最近的轨道,在离核最近区域内运动的电子能量最低,故D不符合题意;故选C。
2.有关光谱的说法中不正确的是()A.原子中的电子在跃迁时能量的表现形式之一是光,这也是原子光谱产生的原因B.电子由低能级跃迁至较高能级时,可通过光谱仪直接摄取原子的发射光谱C.燃放的焰火在夜空中呈现五彩缤纷的礼花与原子核外电子的跃迁有关D.通过光谱分析可以鉴定某些元素【答案】B【解析】A 项,不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发生光谱,A项正确;B项,电子由低能级跃迁至较高能级时,要吸收能量,摄取到的是吸收光谱,B项错误;C项,燃放的焰火在夜空中呈现五彩缤纷的礼花与原子核外电子的跃迁有关,C项正确;D项,不同元素的原子发生跃迁时会吸收或释放不同的光。
在历史上,许多元素是通过原子光谱发现的,如铯和铷。
在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析,D项正确;故选B。
3.某种原子的电子排布式为1s22s22p63s23p1,有关该原子的下列说法中正确的是() A.该原子核内有13个中子B.该原子的简化电子排布式为[He]3s23p1C.该原子最外层有1个电子D.该原子第二能层上有8个电子【答案】D【解析】由电子排布式可以看出该原子核外共13个电子,故只能确定核内质子数为13,中子数无法确定,A项错误;该原子的简化电子排布式为[Ne]3s23p1,B项错误;该原子的最外层电子排布式为3s23p1,故最外层有3个电子,C项错误。
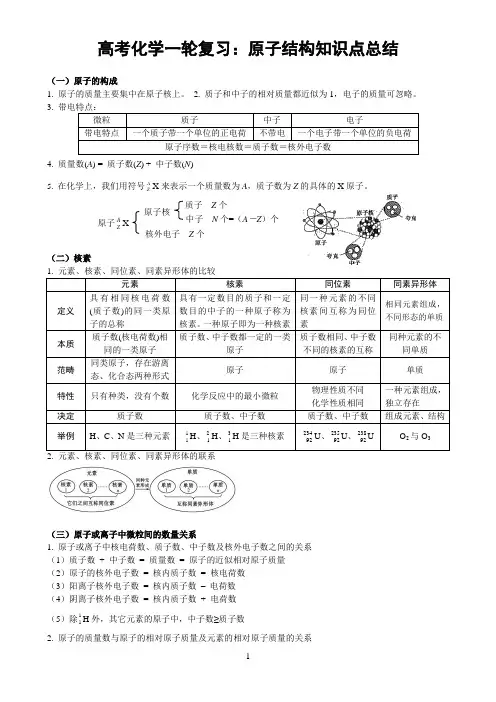
高考化学一轮复习:原子结构知识点总结(一)原子的构成1. 原子的质量主要集中在原子核上。
2. 质子和中子的相对质量都近似为1,电子的质量可忽略。
3. 带电特点:微粒 质子中子 电子带电特点一个质子带一个单位的正电荷不带电一个电子带一个单位的负电荷原子序数=核电核数=质子数=核外电子数4. 质量数(A ) = 质子数(Z ) + 中子数(N )5. 在化学上,我们用符号AZ X 来表示一个质量数为A ,质子数为Z 的具体的X 原子。
(二)核素1. 元素、核素、同位素、同素异形体的比较元素核素同位素同素异形体定义具有相同核电荷数(质子数)的同一类原子的总称具有一定数目的质子和一定数目的中子的一种原子称为核素。
一种原子即为一种核素 同一种元素的不同核素间互称为同位素 相同元素组成,不同形态的单质本质 质子数(核电荷数)相同的一类原子 质子数、中子数都一定的一类原子质子数相同、中子数不同的核素的互称同种元素的不同单质范畴 同类原子,存在游离态、化合态两种形式 原子原子 单质 特性 只有种类,没有个数化学反应中的最小微粒 物理性质不同 化学性质相同 一种元素组成,独立存在 决定 质子数质子数、中子数质子数、中子数组成元素、结构举例H 、C 、N 是三种元素11H 、21H 、31H 是三种核素23492U 、23592U 、23892UO 2与O 32. 元素、核素、同位素、同素异形体的联系(三)原子或离子中微粒间的数量关系1. 原子或离子中核电荷数、质子数、中子数及核外电子数之间的关系(1)质子数 + 中子数 = 质量数 = 原子的近似相对原子质量 (2)原子的核外电子数 = 核内质子数 = 核电荷数 (3)阳离子核外电子数 = 核内质子数 – 电荷数 (4)阴离子核外电子数 = 核内质子数 + 电荷数 (5)除11H 外,其它元素的原子中,中子数≥质子数2. 原子的质量数与原子的相对原子质量及元素的相对原子质量的关系原子AZ X原子核质子 Z 个中子 N 个=(A -Z )个核外电子 Z 个原子的质量数原子的相对原子质量元素的相对原子质量区别原子的质量数是该原子内所有质子和中子数的代数和,都是正整数原子的相对原子质量,是指该原子的真实质量与126C质量的121的比值,一般不是正整数元素的相对原子质量是由天然元素的各种同位素的相对原子质量与其在自然界中所占原子个数的百分比的积的加和得来。


高考物理一轮复习《原子结构》专题讲义[考点梳理]【考点一】阴极射线1.辉光放电现象(1)定义:放电管中若有气体,在放电管两级加上高电压可看到辉光放电现象。
但若管内气体非常稀薄即接近真空时,不能使气体,辉光放电现象消失。
(2)应用:如利用其发光效应制成的、,以及利用其正常辉光放电的电压稳定效应制成的。
2.阴极射线的产生如图所示,在研究0.1pa气压以下的气体导电的玻璃管内有阴、阳两级,当两级间加一定电压时,阴极便发出一种射线,这种射线能使玻璃管壁发出荧光,称为。
在稀薄气体的辉光放电实验中,若不断地抽出管中的气体,当管中的气压降到0.1pa的时候,管内已接近真空,不能使气体电离发光,这时对着阴极的玻璃管壁却发出荧光,如果在管中放一个十字形金属片,荧光中会出现十字阴影。
3.阴极射线的特点在真空中;碰到荧光物质能使其;本质上是。
4.判断阴极射线电性的方法阴极射线的本质是电子,在电场(或磁场)中所受电场力(或洛伦兹力)远大于所受重力,故研究电场力(或洛伦兹力)对电子运动的影响时,一般不考虑重力的影响。
(1)粒子在电场中运动如图1所示。
带电粒子受电场力作用运动方向发生改变(粒子质量忽略不计)。
带电粒子在不受其他力的作用时,若沿电场线方向偏转,则粒子带电;若逆着电场线方向偏转,则粒子带电。
(2)粒子在磁场中运动,如图2所示。
粒子将受到洛伦兹力作用F=qvB,洛伦兹力方向始终与速度方向垂直,利用左手定则即可判断粒子的电性。
不考虑其他力的作用,如果粒子按图示方向进入磁场,且做顺时针的圆周运动,则粒子带电;若做逆时针的圆周运动,则粒子带电。
5.电子的发现(1)实验:英国物理学家在研究阴极射线时的实验装置如图所示,从阴极K发射出的带电粒子通过阳极A和小孔A’形成一束细射线,它穿过两片平行的金属板,到达右端带有标尺的荧光屏上,通过射线产生的荧光屏位置断定,它的本质是。
(2)意义:拉开了人们研究的序幕。
[典例1]关于阴极射线的本质,下列说法正确的是( )A.阴极射线本质是氢原子B.阴极射线本质是电磁波C.阴极射线本质是电子D.阴极射线本质是X射线[典例2]如图所示,一玻璃管中有从左向右的阴极射线可能是电磁波或某种粒子流形成的射线,若在其下方放一通电直导线AB,射线发生如图所示的偏转,AB中的电流方向由B到A,则该射线的本质为( )A.电磁波B.带正电的高速粒子流C.带负电的高速粒子流D.不带电的高速中性粒子流【考点二】密里根“油滴实验”1.实验原理实验过程及原理:装置如图所示,两块平行放置的水平金属板A、B与电源相连接,使A板带正电,B板带负电,从喷雾器喷嘴喷出的小油滴经上面的金属板中间的小孔,落到两板之间的匀强电场E中。


高三一轮复习——原子结构①道尔顿实心球体模型 ②汤姆生“葡萄干面包式”模型 ③卢瑟福“行星系”模型 ④玻尔“轨道”模型●()()()()X : : AZ Z A Z Z ⎧⎧⎪⎪⎨⎪-⎨⎪⎩⎪⎪⎩质子: 带一个单位正电荷原子核原子中子不带电核外电子带一个单位负电荷●()()()A Z N =+质量数质子数中子数 ===质子数核电荷数核外电子数原子序数离子: 离子电荷 = 质子数 – 核外电子数质子数(Z )= 阳离子的核外电子数 + 阳离子的电荷数 质子数(Z )= 阴离子的核外电子数 – 阴离子的电荷数经典例题1.从而对人体产生伤害,该同位素原子的中子数和质子数之差为()A 、136B 、50C 、86D 、222。
同位素:质子数相同而中子数不同的同一种元素的不同原子互为同位素。
如右图为氢元素 的三种同位素质子数决定元素的种类,质子数和中子数决定原子的种类。
●()()()12272712r 271211612e.g. C 1.992710 kg 1.992710 kge.g. C 1.992710 kg 12C m A ---⎧=⨯⎪⎪⨯=⎨⨯⨯-⨯⎪⎪⎩原子的质量原子的实际质量原子的实际质量原子相对原子质量一个碳原子质量原子的近似相对原子质量●⎧⎨⎩元素的平均相对原子质量元素元素的平均近似相对原子质量⏹原子的相对原子质量——指天然同位素的一个的真实质量(g)与一个碳—12原子质量(g)的1/12的比值。
⏹原子的近似相对原子质量——在数值上等于该同位素原子的质量数;如对于816O来说,它的近似相对原子质量为16。
⏹元素的相对原子质量——指该元素各同位素原子的相对原子质量与其在自然界的原子个数百分比的乘积之和。
⏹元素的近似相对原子量——指该元素各同位素原子的质量数与其在自然界的原子个数百分比的乘积之和。
经典例题1 设某元素原子的核内质子数为m,中子数为n,则下列论断正确的是A不能由此确定该元素的相对原子质量 B 该元素的相对原子质量为m+nC 若碳原子质量为w g。

原子结构与性质一、单选题1.下列比较正确的是()①与冷水的反应速率:K>Na>Mg②热稳定性:HF>H2Se>H2S③结合质子的能力:CH3CH2O->CH3COO->HCO3-④离子半径:Cl->O2->Al3+A.①④B.②③C.②④D.①③【答案】A【解析】①金属性越强,与水反应越剧烈,金属性: K>Na>Mg,与冷水的反应速率: K>Na>Mg,故正确;②非金属性越强,气态氢化物越稳定,非金属性:F>S>Se,所以热稳定性: HF>H2S>H2Se,故错误;③酸性越弱,酸越难电离,对应的酸根离子越易结合氢离子,乙酸的酸性大于碳酸,乙醇为中性,所以结合质子的能力: CH3CH2O->HCO3->CH3COO-,故错误;④电子层数越多半径越大,核外电子数相同的,原子序数越大,半径越小, Cl-有3个电子层, O2-、Al3+有2个电子层,O的原子序数小所以O2-半径比Al3+大,所以离子半径: Cl->O2->Al3+,故正确;结合以上分析可知,只有所以正确的有①④;综上所述,本题正确选项A。
2.铊盐与氰化钾被列为A级危险品,铊(Tl)与铝同主族,原子序数为81,Tl3+与Ag在酸性介质中发生反应:Tl3++ 2Ag =Tl+ +2Ag+ 且已知Ag++Fe2+=" Ag" + Fe3+ 则下列推断正确的是()A.Tl+最外层有3个电子B.氧化性:Tl3+ >Ag+>Fe3+C.还原性:Tl+>Ag D.铊位于第五周期IIIA族【答案】B【解析】A、铊(Tl)与铝同主族,主族元素原子最外层电子相同,选项A错误;B、Tl3++2Ag=Tl+ +2Ag+,且Ag++Fe2+=Ag+Fe3+,氧化剂Tl3+的氧化性大于氧化产物Ag+,氧化剂Ag+的氧化性大于氧化产物Fe3+,所以氧化性顺序为Tl3+>Ag+>Fe3+,选项B正确;C、Tl3++2Ag=Tl++2Ag+,反应中还原剂Ag的还原性大于还原产物Tl+,选项C错误;D、原子序数为81,和铝同主族,结合核外电子排布规律写出原子结构示意图判断,铊位于第六周期第ⅢA族,选项D错误;答案选B。
第9讲原子结构【考纲要求】1.了解元素、核素和同位素的含义。
2.了解原子构成。
了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
了解原子、离子等概念的含义3.了解原子核外电子排布。
【课前预习区】一、原子结构1.原子的组成:Z A X指出各字母的含义_________________________________2.组成原子的各微粒的关系:(1)电性关系:质子数核电荷数原子序数核外电子数。
(2)质量关系:质量数=(3)阳离子zX m+:质子数核电荷数原子序数核外电子数电荷数。
(4)阴离子 zX n-:质子数核电荷数原子序数核外电子数电荷数。
三、原子核外电子排布电子在核外排布的规律如何?(1)能量最低原理:离核越近,能量越,电子总是先排在能量的电子层,然后在排能量的电子层。
(2)各电子层最多容纳个电子;(3)最外层最多不超过电子,K层为最外层时不超过个电子。
次外层超过个电子,倒数第三层不超过个电子。
四、有关粒子结构特点的规律(1)He型(2 e-粒子):(2)Ne型(10e-):分子,阳离子,阴离子,其中质子数相同的粒子是。
(3)Ar型(18e-):分子,阳离子,阴离子。
其中质子数相同的粒子是。
(4)其他常见特殊类型:14电子型。
【课堂互动区】一、原子结构[例题1](原子组成、同位素)(09广东化学1)我国稀土资源丰富。
下列有关稀土元素14462 Sm与15062Sm的说法正确的是()A. 14462Sm与15062Sm互为同位素 B.14462Sm与15062Sm的质量数相同C. 14462Sm与15062Sm是同一种核素 D.14462Sm与15062Sm的核外电子数和中子数均为62【规律总结】1、元素、核素、同位素之间的关系2、用质子数、中子数、核外电子数、最外层电子数、电子层数填写下列空格①原子种类由决定②元素由决定③元素有同位素由决定④同位素相对原子质量由决定⑤元素的原子半径由决定⑥元素的化合价主要由决定⑦元素的化学性质主要由决定⑧价电子数通常是指⑨核电荷数由决定⑩原子的质量数由决定[变式1]:(2010年山东)16O和18O是氧元素的两种核素,N A表示阿伏加德罗常数,下列说法正确的是()A. 16O2与18O2互为同分异构体B. 16O与18O核外电子排布方式不同C.通过化学变化可以实现16O与18O间的相互转化D.标准状况下,1.12L16O2与1.12L18O2均含0.1N A个氧原子[变式2]:(2011海南)13153I是常规核裂变产物之一,可以通过测定大气或水中13153I的含量变化来检测核电站是否发生放射性物质泄漏。