Side view
问题:羊毛衫等羊毛制品在热水中洗涤变长,经枯燥又收缩,而丝制品 经同样处理不收缩,请解释这两种现象。
【解】羊毛纤维多肽链的主要构件单位为连续α-螺旋圈,螺距为0.54nm,在加 热下纤维多肽伸展为 -折叠,相邻R基团之间的距离变为0.7nm,所以变长了; 枯燥后重新由 -折叠转化为α-螺旋,所以收缩了。丝制品是丝心蛋白,为 -折 叠的多肽链,其内含丝氨酸等包装紧密的侧链,比羊毛纤维多肽中的α-螺旋稳 定,所以洗涤枯燥构象根本不变。
假设干β折叠股反平行组合而成,两个β股之间通过一 个发夹链接起来。
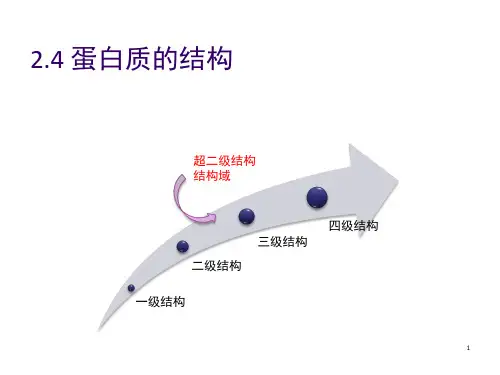
六、超二级结构&结构域——结构域:
➢ “结构域〞是在二级结构或超二级结构的根底上形成三级结构的局部折叠区,是相对独立的 紧密球状实体。对那些较小的球状蛋白质分子或亚基来说,结构域和三级结构是一个意思,也 就是说这些蛋白质或亚基是单结构域的如红氧还蛋白等;较大的蛋白质分子或亚基其三级 结构一般含有两个以上的结构域,即多结构域的,其间以柔性的铰链〔hinge〕相连,以便相 对运动。
α-螺旋
肽链像螺旋一样盘曲上升,每3.6个氨基酸残 基螺旋上升一圈,每圈螺旋的高度为0.54nm, 每个氨基酸残基沿轴上升0.15nm,螺旋上升时, 每个残基沿轴旋转100º;
α-螺旋稳定性主要靠氢键来维 持,多肽主链上第n个残基的羰 基和第n+4个残基的酰氨基形成 氢键,环内原子数13,氢键的取 向几乎与轴平行;
肌钙蛋白的两个结构域。
③稳定蛋白质三维结构的作用力——疏水作用和二硫键
➢疏水作用〔hydrophobic interaction):水介质中球状蛋白质的折叠总是倾向与把疏 水残基埋藏在分子的内部,这一现象称为疏水作用,它在稳定蛋白质的三维结构方面 占有突出地位。疏水作用其实并不是疏水基团之间有什么吸引力的缘故,而是疏水基 团或疏水侧链出自避开水的需要而被迫接近。