高三化学 原子结构
- 格式:ppt
- 大小:677.00 KB
- 文档页数:17

原子排布式知识点总结1. 原子的基本结构原子由原子核和围绕核运动的电子组成。
原子核由质子和中子组成,而电子则围绕原子核运动。
原子核带正电,电子带负电,原子的整体电荷是中性的。
2. 原子的排布式原子的排布式是指原子在晶体中的位置排列关系,主要包括周期性排列和非周期性排列两种形式。
3. 周期性排列在晶体中,原子的位置和结构具有周期性,这种周期性称为晶体结构,是晶体特有的性质。
常见的周期性排列有立方晶系、四方晶系、六方晶系等。
4. 非周期性排列非周期性排列指的是在一定区域内,原子的分布是无规律的,不具备周期性规律。
这种排列形式也在一些物质中存在,比如非晶体材料。
5. 晶体结构晶体结构是指原子的排布式在空间中的三维分布规律。
晶体结构有多种类型,包括简单晶格、复杂晶格、密堆积结构等。
6. 简单晶格简单晶格是指在三维空间中,原子依照一定规则排列在各个晶格点上,这种排列形式称为简单晶格结构。
7. 复杂晶格复杂晶格是指由多种不同原子组成的晶格结构,这种结构比较复杂,常见的有闪锌矿结构、蓝晶石结构等。
8. 密堆积结构密堆积结构是指原子以一定的方式堆积在晶格点上,形成一种密集的排布形式,这种结构在金属材料中比较常见。
9. 晶体的性质晶体的结构决定了其性质,有些晶体具有良好的机械性能,有些晶体具有优异的导电性能,有些晶体具有较强的磁性等。
10. 晶体的应用晶体在材料科学、电子学、光学等领域有着广泛的应用,比如半导体材料、光学材料、磁性材料等都与晶体有着密切的联系。
总的来说,原子的排布式是物质中非常重要的一部分,它决定了物质的性质和行为。
通过对原子排布式的研究和了解,可以更好地理解物质的本质和特性,为材料科学和工程技术的发展提供重要的理论基础。
希望以上的知识点总结对大家有所帮助。

化学必背知识点北京高三化学必背知识点一、原子结构与元素周期表1. 原子结构- 原子核由质子和中子组成,质子带正电荷,中子不带电荷。
- 原子核外围存在电子,电子带负电荷。
- 原子中的质子数决定了元素的原子序数,而中子数可以不同,形成同位素。
2. 电子排布- 电子在原子中按照能级分布,最内层能级最低。
- 每个能级最多容纳2n^2个电子,其中n为能级数。
- 电子填充遵循"Aufbau原理"和"皮层填充顺序"原则。
3. 元素周期表- 元素周期表按照原子序数排列,具有周期性规律。
- 元素周期表分为周期和族。
- 周期指元素的电子壳层数。
- 族指元素的化学性质相似的一组元素。
二、化学键与化合物1. 化学键- 金属键:金属原子之间通过共享自由电子形成。
- 离子键:金属和非金属原子之间,通过电子的转移和吸引形成。
- 共价键:非金属原子之间,通过电子的共用形成。
2. 化合物- 离子化合物:由正负离子组成,通常为金属和非金属的组合。
- 共价化合物:由非金属原子通过共价键结合而成。
三、化学反应和化学方程式1. 反应类型- 合成反应:两个或多个物质结合成一个新物质。
- 分解反应:一个物质分解成两个或多个物质。
- 取代反应:一种元素或基团取代另一种元素或基团。
- 双替反应:两种化合物中的阳离子和阴离子互相交换。
2. 化学方程式- 化学反应可以用化学方程式表示。
- 方程式左边为反应物,右边为生成物。
- 方程式中的化学符号表示物质的状态,如(s)表示固体,(l)表示液体,(g)表示气体,(aq)表示溶液。
四、氧化还原反应和电化学1. 氧化还原反应- 氧化指物质失去电子,还原指物质获得电子。
- 氧化剂:能够使其他物质氧化的物质。
- 还原剂:能够使其他物质还原的物质。
- 氧化还原反应可以用电子转移的角度来考虑。
2. 电化学- 电解:在电解质溶液中,通过外加电势使得离子发生氧化还原反应。
- 电解质溶液中,导电性由离子的含量决定。

专题复习(一)原子结构班级姓名各位同学:这份学案是我们的二轮复习,请同学们认真学习。
认真填写学案然后核对答案(答案就在旁边),本讲的例题4、5、6、9在微视频中有详解,也请在全部做完再观看。
课后作业完成后请上传至智学网。
直击考点——知识梳理一、原子结构1、下列在探索原子结构的过程中形成的主要观点有道尔顿的原子论、汤姆逊提出的原子结构的模型;卢瑟福提出的原子结构的模型。
(答案:葡萄干面包、行星)2.原子是由原子核和核外电子构成的,其中原子核是由质子和中子构成的。
元素的种类由决定,原子的种类由决定,元素化学性质主要由决定。
答案及解析:元素的定义:具有相同核电荷数(即质子数)的一类原子。
因此元素的种类取决于质子数。
例如1H、2H、3H都是氢元素,但是不同的同位素原子,因此原子的种类取决于质子数和中子数。
元素的化学性质主要由原子的最外层电子数和电子层数决定。
3、微粒之间的关系:①质子数=核电荷数=原子序数=原子的核外电子数②质量数=质子数+中子数Ts)例题1:117号新元素Ts的中子数为176,则Ts的化学符号为(答案:293117二、同位素——概念辨析:同位素:质子数相同、中子数不同的不同原子互为同位素。
注意同位素一定是原子,不能是分子。
由于同位素的质子数相同使其核外电子排布相同,则同位素之间化学性质相同。
但同位素的中子数不同使其原子质量不同,因此同位素之间物理性质不同。
另外,同位素在自然界的丰度恒定不变同素异形体:同种元素构成的不同单质。
因此同素异形体一定是单质。
同分异构体:分子式相同,结构不同的化合物之间,例如正戊烷、异戊烷、新戊烷。
同系物:结构相似、分子组成上相差一个或若干个-CH2-的化合物,例如甲醇、乙醇。
同系物具有相同的通式,例如单炔烃的通式为C n H2n-2。
例题2、据报道,科学家已成功合成了少量N4,N4与N2互为,相同质量的N4和N2所含原子个数比为。
例题3、下列互为同位素的是()A.H2和D2B.H2O和D2OC.金刚石和石墨D.2He和3He例题4、H2O、D2O、T2O三者之间_(“是”或“不是”)同位素。

2022届高三化学一轮复习导学案: 原子结构 〔人教版〕根底再现 考点一 原子构成 1.构成原子的微粒及作用原子⎩⎪⎨⎪⎧原子核⎩⎪⎨⎪⎧ 质子(Z 个)——决定的种类中子[(A -Z )个]在质子数确定后决定种类同位素核外电子(Z 个)——最外层电子数决定元素的性质2.将以下核素符号(X)周围5个位置数字的含义填写在方框内 3.微粒之间的关系(1)质子数(Z )=核电荷数=____________;(2)质量数(A )=________(Z )+________(N ); (3)阳离子的核外电子数=质子数-_______; (4)阴离子的核外电子数=质子数+________。
1.222 86Rn 具有放射性,从而对人体产生伤害。
该原子的中子数和质子数之差是( ) A .136 B .50 C .86 D .2222.以下离子中,电子数大于质子数且质子数大于中子数的是( ) A .D 3O +B .Li +C .OD -D .OH -考点二 元素、核素、同位素 1.元素、核素、同位素的关系 2.同位素的性质同一元素的各种核素的_____不同,______相同,化学性质______,物理性质_________。
4.如下是四位同学学习原子结构知识后,对这节内容的认识,你认为不正确的选项是( ) 6.有关H 、D 、T 、HD 、H 2、D +、H -这七种微粒的说法正确的选项是( ) A .互为同位素 B .是七种氢元素 C .电子数相同 D .HD 和H 2均是单质 7.以下表达错误的选项是( )A .16O 、18O 属于同一种元素,它们互为同位素B .D 和T 是不同的核素,它们的质子数相等C .14C 和14N 的质量数相等,它们的中子数不等D .6Li 和7Li 的电子数相等,中子数也相等〔A ZX 〕考点三核外电子排布1.电子层的表示方法及能量变化电子层数由内向外数字表示法 1 2 3 4 5 6 7字母表示法由到离核远近――→由到电子能量――→2.原子核外电子排布规律(1)核外电子一般总是尽先排布在__________的电子层里。
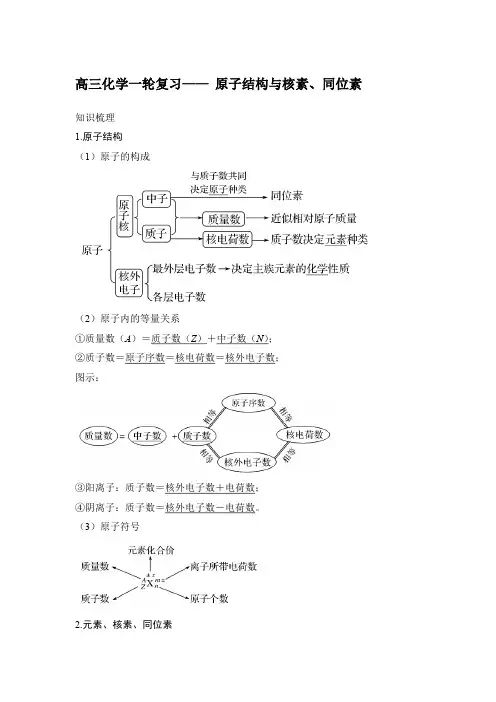
高三化学一轮复习——原子结构与核素、同位素知识梳理1.原子结构(1)原子的构成(2)原子内的等量关系①质量数(A)=质子数(Z)+中子数(N);②质子数=原子序数=核电荷数=核外电子数;图示:③阳离子:质子数=核外电子数+电荷数;④阴离子:质子数=核外电子数-电荷数。
(3)原子符号2.元素、核素、同位素(1)“三素”概念的辨析:(2)几种重要的核素及其应用U21H31H18 8O 核素23592用途核燃料用于考古断代制氢弹示踪原子[名师点拨]①同一元素的各种核素的中子数不同,质子数相同,化学性质几乎完全相同,物理性质差异较大。
②同一元素的各种稳定核素在自然界中所占的原子百分数(丰度)不变。
3.特征电子数粒子(1)2e-微粒H2←H-←→Li+→Be2+(2)10e-微粒(3)18e-微粒[考在课外]教材延伸判断正误(1)一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原子。
(√)(2)不同的核素可能具有相同的质子数,也可能质子数、中子数、质量数均不相同。
(√)(3)核聚变如21H+31H―→42He+10n,因为有新微粒生成,所以该变化是化学变化。
(×)(4)中子数不同而质子数相同的微粒一定互为同位素。
(×)(5)通过化学变化可以实现16O与18O间的相互转化。
(×)(6)3517Cl与3717Cl得电子能力几乎相同。
(√)(7)21H+核外电子数为2。
(×)(8)两种粒子,若核外电子排布完全相同,则其化学性质一定相同。
(×)(9)13C与C60互为同素异形体。
(×)(10)所有的原子中都含有质子和中子。
(×)拓展应用(1)①11H、21H、31H分别是氢元素的三种________,它们互称为________。
②5626Fe2+的质子数为________,中子数为________,核外电子数为________。

高三总复习专题十二 ----物质结构与性质课时1 原子结构与性质考点一原子核外电子排布原理1.能层、能级与原子轨道(1)能层(n):在多电子原子中,核外电子的能量是不同的,按照电子的能量差异将其分成不同能层。
通常用K、L、M、N、O、P、Q……表示相应的第一、二、三、四、五、六、七……能层,能量依次升高(2)能级:同一能层里的电子的能量也可能不同,又将其分成不同的能级,通常用s、p、d、f等表示,同一能层里,各能级的能量按s、p、d、f的顺序升高,即E(s)<E(p)<E(d)<E(f)。
(3)原子轨道:表示电子在原子核外的一个空间运动状态。
电子云轮廓图给出了电子在核外经常出现的区域,这种电子云轮廓图也就是原子轨道的形象化描述。
原子轨道轨道形状轨道个数s 球形 1p 纺缍形 3—————————[特别提醒]———————第一能层(K),只有s能级;第二能层(L),有s、p两种能级;第三能层(M),有s、p、d三种能级;s能级上只有一个原子轨道,p能级上有三个原子轨道p x、p y、p z,d能级上有五个原子轨道,各能级上的原子轨道具有相同的能量。
2.基态原子核外电子排布的三个原理(1)能量最低原理:电子尽先占有能量低的轨道,然后依次进入能量较高的轨道,使整个原子的能量处于最低状态。
即原子的电子排布遵循构造原理能使整个原子的能量处于最低状态。
如图为构造原理示意图:———————————[特别提醒]—————————————————能级交错现象:核外电子的能量并不是完全按能层序数的增加而升高,不同能层的能级之间的能量高低有交错现象,如E(3d)>E(4s)、E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。
(2)泡利原理在一个原子轨道中,最多只能容纳2个电子,并且这两个电子的自旋状态相反。
(3)洪特规则当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,并且自旋状态相同。


高三化学教案:《原子结构》教学设计本文题目:高三化学教案:原子结构1、了解元素、核素、同位素含义;知道核素在医疗、新能源开发等方面的应用。
2、了解原子的构成,了解质量数、质子数、中子数、核电荷数、核外电子数之间的相互关系,理解AZX 的含义。
3、从原子结构示意图的角度了解前18号元素的原子核外电子的排布规律。
中子N(不带电荷) 同位素 (核素)原子核质量数(A=N+Z) 近似相对原子质量质子Z(带正电荷) 核电荷数元素元素符号原子结构最外层电子数打算主族元素的打算原子呈电中性电子数(Z个)化学性质及最高正价和族序数体积小,运动速率高(近光速),无固定轨道核外电子运动特征电子云(比方) 小黑点的意义、小黑点密度的意义。
排布规律电子层数周期序数及原子半径表示方法原子(离子)的电子式、原子结构示意图第1课时原子结构1. 三个基本关系(1)数量关系:质子数 = 核电荷数 = 核外电子数(原子中)(2)电性关系:①原子中:质子数=核电荷数=核外电子数②阳离子中:质子数核外电子数或质子数=核外电子数+电荷数③阴离子中:质子数核外电子数或质子数=核外电子数-电荷数(3)质量关系:质量数 = 质子数 + 中子数2. 对于公式:质量数(A)=质子数(Z)+中子数(N),无论原子还是离子,该公式均适应。
原子可用表示,质量数A写在原子的右上角,质子数Z写在原子的左下角,上下两数值的差值即为中子数。
原子四周右上角以及右下角或上面均可出现标注,留意不同位置标注的含义,右上角为离子的电性和电荷数,写作n ;右下角为微粒中所含X原子的个数,上面标注的是化合价,写作 n形式,留意与电荷的标注进行正确区分,如由氧的一种同位素形成的过氧根离子,可写作 O(-1) 。
原子结构及离子结构中各种基本微粒间的关系原子种类微粒之间的关系中性原子 AZ 原子序数=核电荷数=核内质子数=核外电子数质量数=质子数+中子数阳离子 A n+原子序数=核电荷数=核内质子数=核外电子数+n阴离子 A m-Z 原子序数=核电荷数=核内质子数=核外电子数-m3.核外电子核外电子的运动状态1.原子结构理论的进展。


高中化学选修三知识点总结:原子结构与性质一.原子结构1.能级与能层2.原子轨道3.原子核外电子排布规律⑴构造原理:随着核电荷数递增,大多数元素的电中性基态原子的电子按右图顺序填入核外电子运动轨道(能级),叫做构造原理。
能级交错:由构造原理可知,电子先进入4s轨道,后进入3d轨道,这种现象叫能级交错。
说明:构造原理并不是说4s能级比3d能级能量低(实际上4s能级比3d能级能量高),而是指这样顺序填充电子可以使整个原子的能量最低。
也就是说,整个原子的能量不能机械地看做是各电子所处轨道的能量之和。
(2)能量最低原理现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。
构造原理和能量最低原理是从整体角度考虑原子的能量高低,而不局限于某个能级。
(3)泡利(不相容)原理:基态多电子原子中,不可能同时存在4个量子数完全相同的电子。
换言之,一个轨道里最多只能容纳两个电子,且电旋方向相反(用“↑↓”表示),这个原理称为泡利(Pauli)原理。
(4)洪特规则:当电子排布在同一能级的不同轨道(能量相同)时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则叫洪特(Hund)规则。
洪特规则特例:当p、d、f轨道填充的电子数为全空、半充满或全充满时,原子处于较稳定的状态。
即p0、d0、f0、p3、d5、f7、p6、d10、f14时,是较稳定状态。
前36号元素中,全空状态的有4Be2s22p0、12Mg3s23p0、20Ca4s23d0;半充满状态的有:7N2s22p3、15P3s23p3、24Cr3d54s1、25Mn3d54s2、33As4s24p3;全充满状态的有10Ne2s22p6、18Ar3s23p6、29Cu3d104s1、30Zn3d104s2、36Kr4s24p6。
4.基态原子核外电子排布的表示方法(1)电子排布式①用数字在能级符号的右上角表明该能级上排布的电子数,这就是电子排布式,例如K:1s22s22p63s23p64s1。

2020届高三化学一轮考点精讲精析(8):元素核素和同位素考点8 元素、核素和同位素1.把握原子的组成和结构。
2.把握原子序数、核电荷数、质子数、中子数、核外电子数以及质量数与质子数和中子数之间的关系3.明白得元素、核素、同位素的概念及其相互关系4.了解同位素的性质及其应用,把握核素的表示方法一、原子结构1.原子组成原子可分为 和 两部分,其中原子核又是由 和 构成的2.构成原子的粒子之间的关系①核电荷数 = = = 元素的原子序数摸索:哪些微粒的质子总数才等于核外电子总数?②质量数 = + 数学表达式:A = +二、元素、核素、同位素1.元素、核素、同位素的区不与联系元素是具有 的同一类原子的总称核素是具有 和 的一种原子同一元素的不同 之间互称为同位素元素、核素、同位素间的关系可用右图表示:2.原子中各粒子的作用① 数决定元素种类,同种元素的不同 ,其 数相同 数不同, ② 数和 数共同决定了原子(核素)的种类③元素的化学性质决定于 和 ,其中 是决定元素化学性质的要紧因素3.同位素的性质及表示方法同位素的 性质几乎完全相同而 性质不同,假设某元素的原子核内有6个质子和6个中子,其核素组成符号为 ,讲出核素的一个用元素 同位素 核素核素途 。
摸索:什么缘故同位素的化学性质几乎完全相同而物理性质不同?4.同位素、同素异形体、同分异构体、同系物的研究对象同位素 同素异形体 同分异构体 同系物 研究对象试题枚举【例1】以下讲法正确的选项是A .原子核差不多上由质子和中子构成的B .质子数相同的粒子其化学性质不一定相同C .质子数不同的原子其质量数也一定不同D .质子数相同的微粒,核外电子数一定相同,但化学性质不一定相同 解析:H 中只有质子,没有中子,A 错;Na 、 Na +、 NH 4+质子数相同,化学性质不同,B 正确D 错;质子数不同,但质子数与中子数之和可能相同,C 不对;。
答案:B 。
高三化学原子结构练习题在高三化学学习中,原子结构是一个重要而复杂的概念。
理解原子结构对于学生们掌握化学知识、解答化学题目至关重要。
为了帮助大家更好地理解原子结构,并提高解题能力,本文将提供一些原子结构的练习题。
练习题一:填空题1. 原子的质子数等于 _______。
2. 具有相同质子数但中子数不同的原子叫做 _______。
3. 原子核中质子与中子的总个数被称为原子的 _______。
4. 原子的电子数等于 _______。
5. 同位素是指具有相同 _______,但质子数和中子数不同的原子。
练习题二:选择题1. 氧的原子序数是8,氧的原子结构中包含的质子数与电子数分别是:a) 8, 10b) 8, 8c) 10, 8d) 10, 102. 下面哪个命题是正确的?a) 同一原子的质子数和中子数相等。
b) 同一元素的质子数和电子数相等。
c) 同一同位素的中子数和电子数相等。
d) 同一元素的质子数和中子数相等。
3. 下列物质中,属于同位素的是:a) ¹⁶O, ²⁰Ob) ⁴He, ⁴Bec) ²H, ¹Hd) ¹⁹F, ²⁰F练习题三:计算题1. 一个氧原子的质子数为8,中子数为8,电子数为8。
请计算它的原子序数和原子质量数。
2. 一个氯原子的质子数为17,中子数为18,电子数为17。
请计算它的原子序数和原子质量数。
练习题四:应用题1. 甲和乙是同位素,都具有相同的原子序数为6。
甲的原子质量数为12,而乙的原子质量数为14。
请问甲和乙分别有多少个质子、中子和电子。
2. 氖原子的原子序数为10,原子质量数为20。
请问氖原子中质子、中子和电子的个数分别是多少。
练习题答案如下:练习题一:填空题1. 原子的质子数等于原子序数。
2. 具有相同质子数但中子数不同的原子叫做同位素。
3. 原子核中质子与中子的总个数被称为原子的质量数。
4. 原子的电子数等于原子的质子数(或原子序数)。
第9讲原子结构【考纲要求】1.了解元素、核素和同位素的含义。
2.了解原子构成。
了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
了解原子、离子等概念的含义3.了解原子核外电子排布。
【课前预习区】一、原子结构1.原子的组成:Z A X指出各字母的含义_________________________________2.组成原子的各微粒的关系:(1)电性关系:质子数核电荷数原子序数核外电子数。
(2)质量关系:质量数=(3)阳离子zX m+:质子数核电荷数原子序数核外电子数电荷数。
(4)阴离子 zX n-:质子数核电荷数原子序数核外电子数电荷数。
三、原子核外电子排布电子在核外排布的规律如何?(1)能量最低原理:离核越近,能量越,电子总是先排在能量的电子层,然后在排能量的电子层。
(2)各电子层最多容纳个电子;(3)最外层最多不超过电子,K层为最外层时不超过个电子。
次外层超过个电子,倒数第三层不超过个电子。
四、有关粒子结构特点的规律(1)He型(2 e-粒子):(2)Ne型(10e-):分子,阳离子,阴离子,其中质子数相同的粒子是。
(3)Ar型(18e-):分子,阳离子,阴离子。
其中质子数相同的粒子是。
(4)其他常见特殊类型:14电子型。
【课堂互动区】一、原子结构[例题1](原子组成、同位素)(09广东化学1)我国稀土资源丰富。
下列有关稀土元素14462 Sm与15062Sm的说法正确的是()A. 14462Sm与15062Sm互为同位素 B.14462Sm与15062Sm的质量数相同C. 14462Sm与15062Sm是同一种核素 D.14462Sm与15062Sm的核外电子数和中子数均为62【规律总结】1、元素、核素、同位素之间的关系2、用质子数、中子数、核外电子数、最外层电子数、电子层数填写下列空格①原子种类由决定②元素由决定③元素有同位素由决定④同位素相对原子质量由决定⑤元素的原子半径由决定⑥元素的化合价主要由决定⑦元素的化学性质主要由决定⑧价电子数通常是指⑨核电荷数由决定⑩原子的质量数由决定[变式1]:(2010年山东)16O和18O是氧元素的两种核素,N A表示阿伏加德罗常数,下列说法正确的是()A. 16O2与18O2互为同分异构体B. 16O与18O核外电子排布方式不同C.通过化学变化可以实现16O与18O间的相互转化D.标准状况下,1.12L16O2与1.12L18O2均含0.1N A个氧原子[变式2]:(2011海南)13153I是常规核裂变产物之一,可以通过测定大气或水中13153I的含量变化来检测核电站是否发生放射性物质泄漏。
第32讲原子结构与元素性质【考纲要求】1、了解原子核外电子的运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义。
2、了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示常见元素(1-36号)原子核外电子的排布。
3、了解同一周期、同一主族元素电离能的变化规律,了解元素电离能和核外电子排布的关系。
4、了解同一周期、同一主族元素电负性的变化规律,能根据元素电负性说明2周期中元素金属性和非金属性的变化规律。
【课前预习区】一、核外电子排布(原子结构)1、描述核外电子的运动状态涉即________(即能层)、________(即能级)、________、________;核外电子的排布遵循、、。
2、写出24号元素原子的电子排布式、外围电子(价电子排布式)排布式、外围电子轨道表示式;确定其在周期表中的分区?二、元素性质★1、元素的第一电离能的周期性变化同周期从左至右________________________________________要注意什么?为什么?同主族从上至下_______________________________________★2、元素电负性的周期性变化同周期从左至右________________________________________要注意什么?同主族从上至下_______________________________________【课堂互动区】【考点1】:了解原子核外电子的能级分布,能用电子排布式表示常见元素(1-36号)原子核外电子的排布。
了解原子核外电子的运动状态。
例1:下列各组原子中,彼此化学性质一定相似的是()A、原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子B、原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子C、2p轨道上有一成对电子的X原子与3p轨道上有一成对电子的Y原子D、最外层都只有一个电子的X、Y原子规律总结:变式1、请完成下列各题:①前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有_______种。
化学原子结构知识点高三化学原子结构是高三化学学科的重要内容之一。
它是建立在原子理论的基础上,通过研究原子的组成部分以及它们之间的关系和性质,揭示了物质的微观世界。
在高三学习中,我们需要掌握一些关键的原子结构知识点,下面将详细介绍这些知识点。
1. 原子的组成部分原子是物质的基本单位,由质子、中子和电子组成。
质子带正电荷,质量约为1.67×10^-27千克;中子不带电荷,质量约为1.67×10^-27千克;电子带负电荷,质量约为9.11×10^-31千克。
质子和中子位于原子的中心核中,电子则绕核运动。
2. 原子序数和质量数原子序数指的是一个原子核中所含质子的数量,通常用字母Z 来表示。
质量数指的是一个原子核中所含质子和中子的总数,通常用字母A来表示。
原子的元素符号可以表示为X=AZ,其中X 代表元素的符号。
3. 原子核的稳定性和放射性原子核的稳定性是衡量一个原子核的不稳定程度的标准。
原子核的稳定性受到核子的数目以及核子间的相互作用力的影响。
放射性是指原子核发生自发性转变放出粒子或电磁辐射的性质。
放射性可以分为α衰变、β衰变和γ射线等。
4. 原子的电子排布原子的电子以能量层次分布在不同的轨道上,其中最内层能量最低,最外层能量最高。
原子电子的排布遵循阿尔尼斯特规则,即填充顺序按照能量递增的方式进行。
通过电子的排布,我们可以确定原子的化合价、离子价以及元素的周期性属性。
5. 原子半径和原子半径趋势原子半径指的是原子核到外层电子轨道最外电子的平均距离。
原子半径的大小受到原子核的正电荷吸引力和电子之间的排斥力的双重影响。
在周期表中,原子半径随着周期数的增加而减小,随着原子序数的增加而增大。
6. 原子电离能和电离能趋势原子电离能是指从一个原子中去掉一个电子所需的能量。
原子电离能的大小与原子的核电荷和电子与核的距离有关。
在周期表中,原子电离能随着周期数的增加而增加,随着原子序数的增加而减小。
原子结构知识点前言原子结构是化学中一个非常重要的概念,它解释了物质的性质和行为。
本文将重点介绍原子结构相关的知识点,包括原子的组成、结构和性质,希望能帮助读者更深入地了解原子的奥秘。
原子的组成原子是构成所有物质的基本单位,它由三种基本粒子组成:质子、中子和电子。
质子带正电荷,中子是中性粒子,而电子带负电荷。
质子和中子位于原子核中,形成原子的核心,而电子则绕核壳层运动。
原子的结构原子的结构包括原子核和电子壳层。
原子核由质子和中子组成,电子围绕在原子核外部的不同能级壳层上运动。
原子核的直径约为电子壳层的万分之一,但其中包含原子99.9%以上的质量。
电子结构电子壳层的能级分为K、L、M、N等,每个能级壳层可以容纳不同数量的电子。
根据泡利不相容原理和居里原理,每个电子轨道最多容纳2个电子,且必须填满低能级轨道后才能填满高能级轨道。
原子物理性质原子的物理性质主要由其原子序数(核电荷数)和电子结构决定。
原子序数越大,原子核中的质子数目越多,电子结构也更加稳定。
原子的性质还受到元素化学属性的影响,如电负性、原子半径、离子半径等。
原子结构的应用原子结构不仅在化学领域有重要应用,还在物理、材料科学等领域发挥关键作用。
人们通过深入研究原子结构,可以设计新材料、开发新技术,甚至探索宇宙奥秘。
结语原子结构是一个精彩而复杂的领域,本文只是对其进行了简要介绍,希望读者在学习过程中能够继续深入探索原子结构的奥秘,拓展对自然世界的认识,为科学发展做出贡献。
以上就是有关原子结构知识点的介绍,希望能对你有所启发。