(阿片类)镇痛药
- 格式:ppt
- 大小:5.65 MB
- 文档页数:54



第二节吗啡吗啡为纯天然阿片类生物碱。
1806年德国化学家F.W.A.Serturner从鸦片中提出纯品吗啡;1847年Knorr确定其分子式;上世纪20年代初J.M.Gulland和R.Robinson提出吗啡的化学结构;1952年M.Gates和G.Tschudi人工合成了吗啡,才正式确定了其化学结构。
虽历经一百余年,吗啡仍然是目前使用最为广泛的阿片类药物之一,因其止痛效果确切、价格低廉而被世界卫生组织(WHO)推荐为阿片类镇痛药物的标准用药,通常也作为其他阿片类药物临床评估的参考。
化学结构:分子式:C17H19NO3分子量:285.37一、药动学吗啡口服易吸收,由于肝脏和消化道的首过效应(first-pass effect),其生物利用度为30%~40%,控缓释制剂与即释制剂生物利用度相近,直肠给药生物利用度变异比较大。
皮下、肌肉和静脉注射吗啡无首过效应,生物利用度接近100%。
吗啡的pKa为7.9,进入血管内的吗啡约有1/3与血浆蛋白结合,其余在生理pH下呈游离状态,并迅速分布于人体大多数组织中,包括实质性脏器、空腔脏器甚至体液、皮肤、毛发等,其表观分布容积(apparent volume of distribution,Vd)约为1.0~4.7 L/kg。
只有游离状态的吗啡可通过血-脑脊液屏障和胎盘组织。
吗啡的辛醇/水(octanol/water)分配系数在pH7.4时为1.42,呈低脂溶性,亲水性强,虽然吗啡在机体内分布广泛,但其组织穿透力弱,因而只有极少部分吗啡(静脉注射后不到1%)能够透过血-脑脊液屏障发挥镇痛作用。
吗啡血浆清除率(plasma clearance)为0.9~1.2 L/(kg·h),主要在肝脏代谢。
5%左右去甲基化生成去甲吗啡(normorphine),60%~80%葡萄糖醛酸化,其分子结构上3位和6位的羟基分别被葡糖醛酸替代,生成吗啡-3-葡萄糖醛酸(morphine-3-glucuronide,M3G)和吗啡-6-葡萄糖醛酸(morphine-6-glucuronide,M6G)。


阿片类镇痛药及其拮抗剂阿片类镇痛药是一种常见的药物类别,用来缓解疼痛。
阿片类药物以其镇痛、催眠和欣快作用而被广泛应用。
但是,它们也会导致一些严重的副作用和成瘾性问题。
因此,阿片类药物的滥用和成瘾现象也越来越普遍。
本文将介绍阿片类镇痛药的成分、作用、副作用,以及其拮抗剂的作用和应用。
阿片类镇痛药的成分和作用阿片类镇痛药包括吗啡、芬太尼、可待因等药物。
它们与人体内的内源性阿片肽受体结合,同时增强胃肠道运动和缓解呼吸和心跳等症状。
这些药物可以通过方式如口服、皮下注射、静脉注射等途径进入人体。
阿片类药物通常用于缓解剧烈疼痛,例如在手术前和手术后、癌症和骨伤痛等。
此外,阿片类药物还可以产生欣快、瞌睡、镇静和呕吐等作用。
阿片类镇痛药的副作用尽管阿片类药物是一种常见的镇痛药,但它们也存在着许多副作用。
常见的副作用包括:可致呼吸减慢或停止;便秘,尿潴留;恶心和呕吐;产生视觉和思维障碍等。
对于一些人,特别是有药物滥用史和心理障碍的人,可能会出现成瘾现象。
因此,在使用阿片类药物时应该遵循医嘱,并注意药量和使用时间,以免患上不必要的副作用和成瘾问题。
阿片类药物的拮抗剂阿片类药物的拮抗剂一般是通过与阿片受体结合并取代或阻断阿片类药物的作用来实现的。
拮抗剂可以避免某些副作用,尤其是呼吸抑制。
阿片类药物的拮抗剂包括纳洛酮、納爾芬等。
这些拮抗剂可以修复阿片类药物的作用,实现便携的救治和毒品戒断治疗等。
阿片类药物的滥用阿片类药物的滥用和成瘾现象在全球范围内越来越受到关注。
在美国,阿片类药物已经成为致死药物之一。
阿片类药物被滥用的原因有很多,其中包括为了体验欣快作用,为了缓解疼痛,以及出于其他各种各样的原因。
因此,当使用阿片类药物时应该注意药物的成瘾性和副作用,特别是对于那些有药物滥用史和心理障碍的人。
阿片类药物是一种常见的药物类别,用于缓解剧烈疼痛。
虽然它们可以缓解疼痛,但也存在很多严重的副作用和成瘾问题。
因此,我们应该遵循医嘱,谨慎使用药物,以避免药物滥用和成瘾问题。
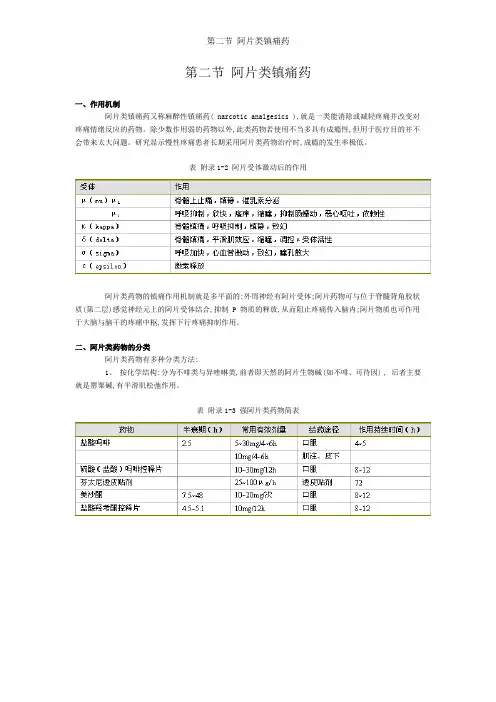
第二节阿片类镇痛药一、作用机制阿片类镇痛药又称麻醉性镇痛药( narcotic analgesics ),就是一类能消除或减轻疼痛并改变对疼痛情绪反应的药物。
除少数作用弱的药物以外,此类药物若使用不当多具有成瘾性,但用于医疗目的并不会带来太大问题。
研究显示慢性疼痛患者长期采用阿片类药物治疗时,成瘾的发生率极低。
表附录1-2 阿片受体激动后的作用阿片类药物的镇痛作用机制就是多平面的:外周神经有阿片受体;阿片药物可与位于脊髓背角胶状质(第二层)感觉神经元上的阿片受体结合,抑制 P 物质的释放,从而阻止疼痛传入脑内;阿片物质也可作用于大脑与脑干的疼痛中枢,发挥下行疼痛抑制作用。
二、阿片类药物的分类阿片类药物有多种分类方法:1、按化学结构:分为不啡类与异喹啉类,前者即天然的阿片生物碱(如不啡、可待因) , 后者主要就是罂粟碱,有平滑肌松弛作用。
表附录1-3 强阿片类药物简表表附录1-4 弱阿片类药物简表2、按来源该类药物可分为天然阿片类、半合成衍生物 ( 如双氢可待因,二乙酰不啡 ) 与合成的阿片类镇痛药。
合成药物又分为四类:①苯丙不啡烷类 (phenylpiperidine derivatives) ,如哌替啶、芬太尼等;②不啡喃类 (morphinenans) ,如左不喃;③苯异不啡烷类 (bengmorphans) ,如喷她佐辛;④二苯甲烷类 (diphenylmethanes) ,如美散酮。
3、按受体类型可分为μ、κ、δ受体,该三种受体的分子结构已被确定,并被成功克隆。
从功能上还可能存在ε与δ受体,并可能进一步分为μ 1 、μ 2 、κ 1 、κ 2 、κ 3 与δ 1 、δ 2 等亚型。
表 3-2 为受体激动后的药理作用。
4、按药理作用分,阿片类镇痛药又可分为激动药 ( 不啡、芬太尼、哌替啶等 ) ,激动一拮抗药( 喷她佐辛、纳布啡等 ) ,部分激动药(丁丙诺啡)与拮抗药 (纳洛酮等) 。
激动—拮抗药又称部分激动药,主要激动κ受体,对δ受体也有一定激动作用,而对μ受体则有不同程度的拮抗作用。



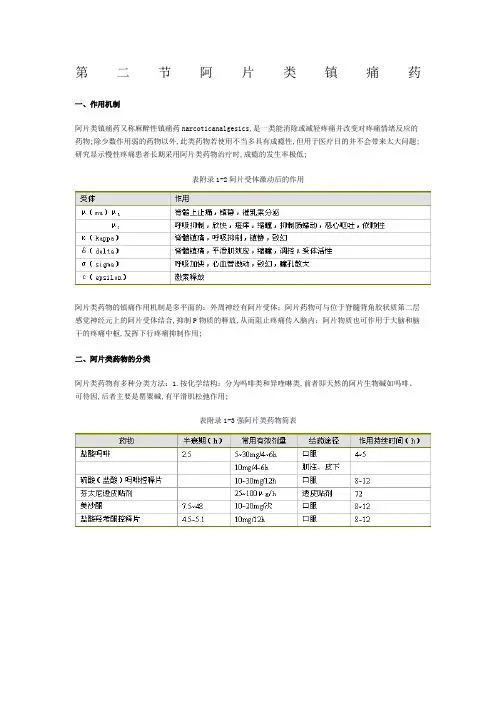
第二节阿片类镇痛药一、作用机制阿片类镇痛药又称麻醉性镇痛药narcoticanalgesics,是一类能消除或减轻疼痛并改变对疼痛情绪反应的药物;除少数作用弱的药物以外,此类药物若使用不当多具有成瘾性,但用于医疗目的并不会带来太大问题;研究显示慢性疼痛患者长期采用阿片类药物治疗时,成瘾的发生率极低;表附录1-2阿片受体激动后的作用阿片类药物的镇痛作用机制是多平面的:外周神经有阿片受体;阿片药物可与位于脊髓背角胶状质第二层感觉神经元上的阿片受体结合,抑制P物质的释放,从而阻止疼痛传入脑内;阿片物质也可作用于大脑和脑干的疼痛中枢,发挥下行疼痛抑制作用;二、阿片类药物的分类阿片类药物有多种分类方法:1.按化学结构:分为吗啡类和异喹啉类,前者即天然的阿片生物碱如吗啡、可待因,后者主要是罂粟碱,有平滑肌松弛作用;表附录1-3强阿片类药物简表表附录1-4弱阿片类药物简表2.按来源该类药物可分为天然阿片类、半合成衍生物如双氢可待因,二乙酰吗啡和合成的阿片类镇痛药;合成药物又分为四类:①苯丙吗啡烷类phenylpiperidinederivatives,如哌替啶、芬太尼等;②吗啡喃类morphinenans,如左吗喃;③苯异吗啡烷类bengmorphans,如喷他佐辛;④二苯甲烷类diphenylmethanes,如美散酮;3.按受体类型可分为μ、κ、δ受体,该三种受体的分子结构已被确定,并被成功克隆;从功能上还可能存在ε和δ受体,并可能进一步分为μ1、μ2、κ1、κ2、κ3和δ1、δ2等亚型;表3-2为受体激动后的药理作用;4.按药理作用分,阿片类镇痛药又可分为激动药吗啡、芬太尼、哌替啶等,激动一拮抗药喷他佐辛、纳布啡等,部分激动药丁丙诺啡和拮抗药纳洛酮等;激动—拮抗药又称部分激动药,主要激动κ受体,对δ受体也有一定激动作用,而对μ受体则有不同程度的拮抗作用;由于对受体作用不同,这类药物通过κ受体产生镇痛和呼吸抑制作用,有“天花板”效应,很少产生依赖性;通过σ受体产生精神作用和幻觉;根据激动—拮抗程度不同,纳布啡和布托啡诺主要用作镇痛药,而另一些药如烯丙吗啡主要用作拮抗药;在临床应用中,已应用纯激动药治疗的患者不能换用混合激动一拮抗药或部分激动药,否则可能导致戒断反应,而用混合激动—拮抗药或部分激动药进行治疗的患者可较安全地换用纯阿片激动药,不会产生戒断反应;5.根据阿片类药的镇痛强度,临床分为强阿片药表附录1-3和弱阿片药表附录1-4;弱阿片药如可待因、双氢可待因,强阿片药包括吗啡、芬太尼、哌替啶、舒芬太尼和雷米芬太尼;弱阿片药主要用于轻至中度急慢性疼痛和癌痛的治疗,强阿片类则用于全身麻醉诱导和维持的辅助用药以及术后镇痛和中至重度癌痛、慢性痛的治疗;表附录1-5常用阿片类药的作用强度和药代学参数表附录1-6阿片类药物剂量换算表阿片类药的作用强度和药代学性质不同表附录1-5;表附录1-6为临床常用的阿片类药物剂量换算表;三、阿片类药物的临床给药途径和方法阿片类药物是目前已发现镇痛作用最强的药物,并且没有“天花板”效应,镇痛作用随剂量的增加而增强,因此并不存在所谓最大或最佳剂量;对个体患者而言,最佳剂量由镇痛作用与可耐受不良反应之间的平衡决定,若判定患者对阿片类药物仅部分敏感如部分神经病理性疼痛,则不应再增加剂量;因此,在获得镇痛作用的同时处理阿片类相关不良反应具有重要意义;一临床药理脂溶性、离子化程度和蛋白结合率在决定起效时间、峰时间和作用时间上起主要作用;脂溶性高、分子量小的药物有较高的生物膜渗透性;非离子化药物的脂溶性比离子化药物大1000~10000倍,故非离子化药物的比率愈高,可被弥散入中枢神经系统的药物愈多,起效愈快;蛋白结合力影响药物的再分布是因为只有未被结合的药物可弥散透过生物膜,蛋白结合率高,可用作补偿血浓度降低的储备量也较多;二终末半衰期直接随分布容积变化并与清除率相关;分布容积大,排除半衰期延长,清除率增加,则排除半衰期缩短;故芬太尼虽清除率高,但分布容积大,半衰期仍长;除雷米芬太尼主要由红细胞和骨骼肌中的非特异性酯酶代谢外,其余阿片类药物的代谢主要在肝脏中进行,与肝血流相关;三给药途径无创给药口服、经皮等是治疗慢性疼痛、癌痛的首选给药方式,对无创方法给药无效以及手术和手术后镇痛的患者则选择持续或单次静脉给药、持续或单次硬膜外给药,也可以用持续皮下给药或临时性肌注给药;为避免或减少外周阿片受体激动导致的不良反应,集中发挥中枢镇痛作用,新的给药途径正在扩大应用;包括经口腔粘膜、鼻腔粘膜、眼结膜给药等;1经口腔粘膜吸收芬太尼oraltransmucosalfentanyl将枸橼酸芬太尼做成糖块,患者含服时,芬太尼经口腔和食管粘膜吸收直接进入血液循环,仅小部分随唾液进入胃肠,使与胃肠道阿片受体结合的药物明显减少,也降低了恶心、呕吐和便秘的发生率;此种给药方式已成功用于癌痛的突发性疼痛治疗、小儿术前用药和小儿诊断性操作;经鼻粘膜和经眼结膜给药同样有避免肝脏首过效应和减少阿片受体与胃肠道阿片受体结合的优点,目前主要用芬太尼滴鼻和舒芬太尼;2经皮给药芬太尼脂溶性高,分子量小,镇痛作用强,无局部刺激和皮肤代谢,生物利用度高;芬太尼透皮贴剂多瑞吉贴于皮肤后12~24h,血药浓度渐升至稳态并维持72h;便秘发生率远低于口服给药是其主要优点;该药已广泛用于癌痛提供基础镇痛和慢性疼痛治疗;3患者自控镇痛PCAPCA是患者感觉疼痛时按压PCA启动键,由镇痛泵向体内自动注射设定剂量药物的方法;其特点是医师设置负荷剂量尽快达到治疗窗浓度、持续给药量维持基础镇痛、冲击量控制突发痛或作为基础镇痛不足的补充和锁定时间避免冲击量尚未发挥作用,患者反复按压启动键导致药物蓄积,患者按镇痛所需调控镇痛药的注射时机和剂量,是适合于不同患者、不同疼痛时间和强度的个体化给药方法,也是国际上通用的术后镇痛给药方法;PCA分为静脉PCAPCIA、硬膜外PCAPCEA、皮下PCAPCSA和外周神经阻滞PCAPCNA;PCIA采用的主要镇痛药为阿片类药吗啡、芬太尼、舒芬太尼、阿芬太尼、瑞芬太尼或曲马多,为防止阿片类药物的恶心、呕吐等不良反应,常加用胃复安、地塞米松、5—HT、受体拮抗药或小剂量氟哌啶5mg/d以下,也可复合非甾体抗炎药以减少阿片类药物的用量;PCEA则常采用低浓度罗哌卡因、布比卡因或利多卡因等局麻药复合芬太尼、舒芬太尼、吗啡等药物;可加用小剂量可乐定,与局麻药和阿片类药物均有协同作用;四副作用阿片类药的副作用实际是阿片的受体效应;可分为短时间耐受和长时间耐受两大类;镇静、意识模糊包括幻觉、嗜睡、恶心、呕吐、瘙痒及尿潴留都是短暂反应,数天或1—2周后这些症状可消失;最顽固和持久的副作用是便秘,见于所有强、弱阿片类药;耐受性和躯体依赖性也是长期用药后的副作用;阿片耐受性发生缓慢,个别病人可能因基因突变导致对吗啡耐受;躯体依赖表现为突然停药时出现戒断症状,可通过逐渐减量来避免这种现象;。
