第十二章质谱分析
- 格式:doc
- 大小:1.65 MB
- 文档页数:23

第十二章光催化性能评价研究方法本章重点介绍在光催化机理、降解产物分析和性能评价研究中所涉及到的各种表征方法。
光催化机理是物理化学研究所关注的领域,在本章中重点介绍了各种光电化学测量手段在光催化机理研究中的应用,除此外也介绍了光生载流子寿命以及活性物种的研究方法;对于光催化降解产物的研究一直是环境化学所关注的重要问题,在这里介绍了不同分析方法(色谱、质谱、色质联用等)在中间产物分析中的应用;光催化材料性能的表征是评价光催化材料及其制备工艺优劣的关键,不仅在理论研究中获得广泛的关注,而且随着光催化技术的迅速发展和广泛的工业化应用,光催化性能标准测试方法的建立是实现不同光催化材料和光催化材料制备工艺评价的基础。
12.1 光催化机理研究光催化污染物的降解是一个复杂的物理化学过程,涉及到光能吸收、光生电荷分离和界面反应等环节,只有当光激发载流子(电子和空穴)被俘获并与电子给体/受体发生作用才是有效的。
在研究光生电荷产生、迁移及复合相关的机理时,需要多种测试手段的相互辅助。
这些检测技术如果按照检测参数可以分为:(1)光生电荷产生:吸收光谱法;(2)电荷密度与传输过程特性:电子自旋共振(ESR)、光谱电化学法、电化学I-V法、阻抗谱、表面光伏/光电流技术;(3)寿命与复合,产生辐射、声子或者能量传递给其它载流子:载流子辐射度测量、荧光光谱技术、光声/光热测量、表面能谱技术等等。
对于光催化机理的研究是深入认识光催化材料性能及光催化过程的基础,但由于所涉及到的技术手段较多,不同技术涉及到的机理及表征方法各不相同,故在本章中仅介绍文献中常用的技术方法。
12.1.1 紫外-可见漫反射光谱法在光催化研究中,半导体光催化材料高效宽谱的光吸收性能是保证光催化活性的一个必要而非充分的条件,因此对于光催化材料吸收光谱的表征是必不可少的。
半导体的能带结构一般由低能价带和高能导带构成,价带和导带之间存在禁带。
当半导体颗粒吸收足够的光子能量,价带电子被激发越过禁带进入空的导带,而在价带中留下一个空穴,形成电子-空穴对。
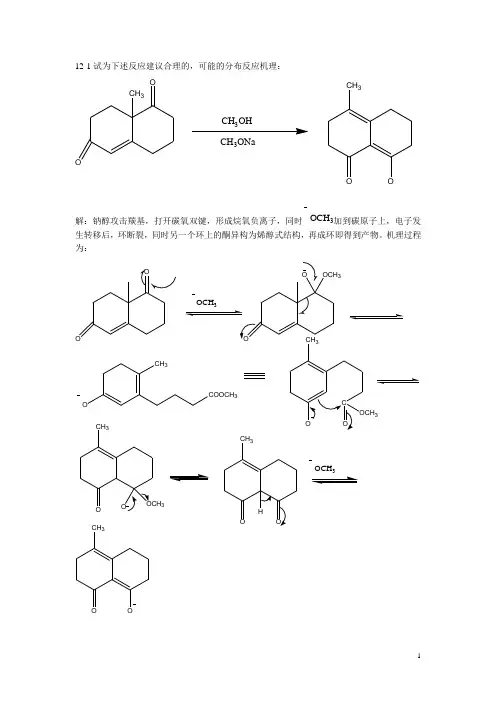
12-1试为下述反应建议合理的,可能的分布反应机理:O CH 3OCH3OHCH3ONaCH3OO解:钠醇攻击羰基,打开碳氧双键,形成烷氧负离子,同时OCH3加到碳原子上,电子发生转移后,环断裂,同时另一个环上的酮异构为烯醇式结构,再成环即得到产物。
机理过程为:OOOCH3OO OCH3CH3COOCH3O CCH3O OOCH3 CH3O OCH3OCH3HO OOCH3OCH3O12-2反应机理推断 1)CHO+CH 3NO 2NaOHC HCHNO 2(2)C OR 'CH 2R+HCHO +HN(CH 3)2HCOR 'H C RCH 2N(CH 3)2解(1)硝基甲烷在碱性条件下失去一个质子形成碳负离子,碳负离子为亲核试剂,攻击羰基使电子转移形成氧负离子,得到一个质子后氧负离子变为羟基,脱去一分子水形成双键,得到所求产物,反应机理如下:OHCH 3NO 2OHCH 2NO 2+CH 2NO2C OHCH 2NO2C OH HCH 2NO 2H 2OCH CHNO 2(2)甲醛与仲胺发生加成反应,羟基在酸性条件下脱去形成双键和氮原子,酮异构为烯醇结构,电子转移后发生亲核加成得到产物,过程为:H 2CO+HN(CH 3)2H 2COHN(CH 3)2HH 2CN +(CH 3)2COR 'CH 2RHCCHROHR'H 2CN(CH 3)2COHR 'H C CH 2N(CH 3)2RCR 'H C OHRCH 2N(CH 3)2-H +12-3对下列反应提出合理解释。
OO+OEtONaOO解; 该题涉及两个反应,分别为碳负离子与羰基加成以及碳负离子与αβ不饱和烯烃的迈克尔加成反应,均为碳负离子机理。
机理为:OOEtO -OOOOOEtO -OOO OHO O-H 2OOOO12-4用合理分步的反应机理解释下列反应事实:OOOHOHHOO解:环状缩酮中的一个O 结合H 开环生成羟基,另一个收H 2O 攻击,碳氧双键断裂。



质谱分析的原理质谱分析是一种广泛应用于化学、生物、环境等领域的分析技术,它通过测定化合物的分子质量和结构,来揭示样品中化合物的成分和结构信息。
质谱分析的原理主要包括样品的离子化、质谱仪的质谱扫描和质谱图的解析三个方面。
首先,样品的离子化是质谱分析的第一步。
在质谱分析中,样品通常需要先进行离子化处理,将其转化为带电离子。
这通常通过电离源来实现,电离源可以是电子轰击电离、化学电离或者光解电离等方式。
离子化后的样品离子会被加速器加速,形成一束离子流,然后进入质谱仪进行下一步的分析。
其次,质谱仪的质谱扫描是质谱分析的核心步骤。
质谱扫描是指质谱仪对进入的离子流进行分析,测定其质荷比。
质谱仪通常包括质子化区、分析区和检测器。
在质子化区,离子流会被进一步加速和聚焦,然后进入分析区。
在分析区,离子流会受到磁场和电场的作用,不同质荷比的离子会受到不同的力,从而形成质谱图。
最后,质谱图会被送入检测器进行检测和记录。
最后,质谱图的解析是质谱分析的最终步骤。
质谱图是质谱分析的结果,它通过记录离子流的质荷比和强度,来反映样品中不同化合物的质谱特征。
质谱图的解析需要借助计算机和质谱数据库等工具,通过比对已知化合物的质谱数据,来识别出样品中的化合物成分和结构信息。
总的来说,质谱分析的原理包括样品的离子化、质谱仪的质谱扫描和质谱图的解析三个方面。
通过这些步骤,质谱分析可以准确、快速地揭示样品中的化合物成分和结构信息,为化学、生物、环境等领域的研究和应用提供重要的分析手段。

第二章气相色谱分析例1:在一根90米长的毛细管色谱柱上测得各组分保留时间:正十四烷15.6min ;正十五烷21.95min ;正十六烷31.9min 。
计算色谱柱的死时间及载气平均速度。
解:方法一:同系物保留值之间存在以下关系:,11,r rn n n n=-+ ''''()(1)(1)()//R n R n R n R n t t t t -+=以()R M t t -代替'Rt 可推导出: 2(1)(1)()(1)()()(1)()()R n R n R n M R n R n R n R n t t t t t t t t -++--=---将正十四烷、正十五烷、正十六烷的保留时间代入公式:231.915.621.95min (31.921.95)(21.9515.6)M t ⨯-=--- 得4.40minM t = 载气的平均流速/Mu L t -=, 即90100/(4.4060)/34.09/u cm s cm s -=⨯⨯=方法二:直接用甲烷测定死时间。
即以甲烷的保留时间作为死时间。
例2:在一根2m 长的色谱柱上,A 、B 、C 、三组分的保留时间分别为2.42min 、3.21min 、5.54min ;峰宽分别为0.12min 、0.21min 、0.48min 。
另测得甲烷的保留时间为1.02min 。
求:(1)A 、B 、C 组分的调整保留时间;(2)A 与B 、B 与C 组分的相对保留时间; (3)A 、B 、C 组分的容量因子;(4)A 、B 、C 组分的有效塔板数和塔板高度; (5)A 与B 、B 与C 组分的分离度;解:(1)'(1)(1)R R M tt t =-'()()(2.42 1.02)min 1.40min R A R A M t t t =-=-= '()()(3.21 1.02)min 2.19min R B R B M tt t =-=-= '()()(5.54 1.02)min 4.52min R C R C M tt t =-=-=(2) ''2,1(2)(1)/R R r t t =, 2.19/1.40 1.56B A r ==, 4.52/2.19 2.06C B r ==(3) '1(1)/R M k t t ='()/ 1.40/1.02 1.37A R A M k t t === '()/ 2.19/1.02 2.15B R B M k t t === '()/ 4.52/1.02 4.43CR C M k t t ===(4)'216(),/R eff t n H L nw=='()22()1.416()16()2178,0.12R A eff A A tn w ===()/2100/21780.092A A eff A H L n cm ==⨯= '()22()2.1916()16()17400.21R B eff B B t n w ===()/2100/17400.115B B eff B H L n cm cm ==⨯= '()22()4.5216()16()14190.48R C eff C C t n w ===()/2100/14190.141C C eff C H L n cm ==⨯=(5)(2)(1)212()R R t t Rw w -=+()(),2()2(3.21 2.42)4.790.210.12R B R A A BB At t R w w -⨯-===++()(),2()2(5.54 3.21) 6.750.480.21R C R B B CC Bt t R w w -⨯-===++第三章 高效液相色谱分析例1:高效液相色谱法分离两个组分,色谱柱长30cm 。

质谱分析原理质谱分析是一种用来确定化合物分子结构和组成的重要方法。
它通过测量分子或原子离子的质量和相对丰度,从而得到样品的质谱图,进而推断出化合物的结构和组成。
质谱分析在化学、生物、药学、环境科学等领域都有着广泛的应用。
质谱分析的基本原理是将样品中的化合物转化为气态离子,然后通过质谱仪进行分析。
首先,样品中的化合物被加热或者化学反应,产生气态离子。
然后,这些离子被加速器加速,并进入质谱仪的质子飞行管。
在飞行管中,离子按照其质量-电荷比被分离并加速,最终到达检测器。
检测器会记录下不同质量-电荷比的离子的相对丰度,形成质谱图。
质谱图是质谱分析的结果,它是质谱仪输出的一个图形,横轴表示质荷比,纵轴表示相对丰度。
通过观察质谱图,可以得到样品中的化合物的分子量、分子结构、碳氢比等信息。
根据质谱图的特征峰,可以推断出样品中的化合物的种类和含量。
质谱分析的原理基于离子的质量-电荷比。
不同的化合物由于其分子结构和组成不同,其离子的质量-电荷比也不同。
因此,质谱分析可以通过测量离子的质量-电荷比来区分不同的化合物。
通过比对标准物质的质谱图,可以确定未知物质的组成和结构。
质谱分析的原理还包括离子化方法、质谱仪的结构和工作原理等方面。
离子化方法包括电子轰击离子化、化学离子化、电喷雾离子化等。
不同的离子化方法适用于不同类型的样品。
质谱仪的结构包括离子源、质子飞行管、检测器等部分,每个部分都有着特定的功能。
质谱仪的工作原理是基于离子在电场中运动的原理,通过加速和分离离子来得到质谱图。
总的来说,质谱分析原理是基于离子的质量-电荷比来确定化合物的结构和组成。
通过测量离子的质量-电荷比,得到质谱图,从而推断出样品中的化合物的信息。
质谱分析在化学、生物、药学等领域有着广泛的应用,是一种非常重要的分析方法。

《仪器分析》课后习题答案参考第一章电位分析法1~4 略5.(1)pMg x=5.4(2)3.65×10-6– 4.98×10-66. -17%7. 4.27×10-4%8.(1)=5.4×10-4lg=-2.31=5.0×10-3(2) Cl- =1.0×10-2 mol/L9. pH x ==5.74R入=1011Ω10. Cx=8.03×10-4 mol/L第二章电重量分析和库仑分析法1. 1.64 V2. -1.342,0.2383. 1.08 V,0.4V,7333 s4. Co先析出,阴极电位应维持在-0.313 – -0.795V之间阴极电位应维持在-0.455 – -0.795V之间5 Bi:0.283-0.190V(vs.SHE);-0.005 - -0.098(vs. Ag/AgCl)Cu:0.310-0.159V(vs.SHE);0.022 - -0.129(vs. Ag/AgCl)Ag:0.739-0.444V(vs.SHE);0.451 – 0.156(vs. Ag/AgCl)控制阴极电位大于0.310V(vs.SHE),可以使Ag分离,Cu2+和BiO+不能分离。
6 ,7 , ,89.10. t= 4472s11 6.1×10-4 mol/Lpt阴极产生OH-,改变pH使副反应发生,故pt阴极应用玻璃砂芯套管隔离第三章 伏安法和极谱分析法1~3 略4. 当pH=7时,当pH=5时,5. (1) 线性回归方程: y =6.0733x + 0.3652(2)0.536 mmol/L6. M C x 41023.2-⨯=7. 22.7 μA8. 0.0879. 1.75 ×10-3mol/L10. -0.626 V11. 5.9×10-3第四章气相色谱法1~14 略15. 8.5%,20.6%,60.9%16. 2.15%,3.09%,2.75%,6.18%,85.84%17. (1)4.5, (2)48mL,(3)5.4min,(4)103,(5)1866,(6)1.07nm18. (1)8.6,(2)1.4419. (1)n有效(A) = 636.59n有效(B) = 676(2) 2 m20.(1)0.45 ,(2)7111121.(1)4,(2)4,(3),22. (1)3236,2898,2820,3261,(2)3054(3)0.33m第五章高效液相色谱法1~16 略17. 26.24%,27.26%18. 1600,6.7,7.3,1.1,0.8,7 m19. 0.63,2.38,2.65,4.034021,3099,2818,3394,595,1535,1486,217820. 5.1%21. 0.47%第六章原子发射光谱仪1~8 略9. 2.57 eV10. 0.573%。
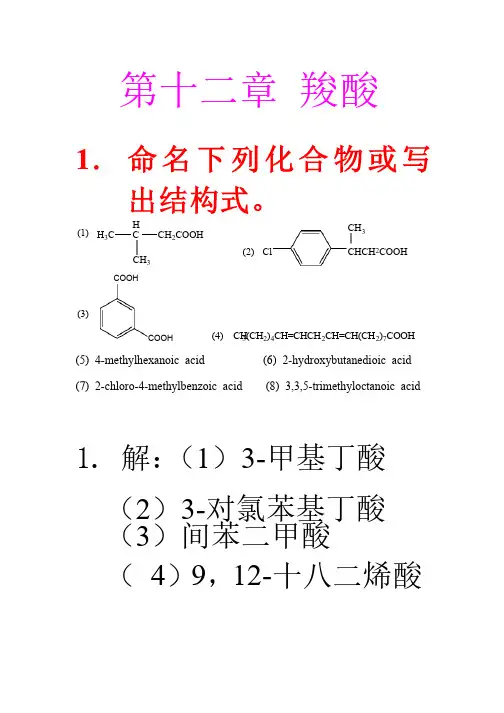
第十二章 羧酸1. 命名下列化合物或写出结构式。
H CCH 2COOHCH 3H 3C(1)ClCHCH 2COOHCH 3(2)COOHCOOH (3)(4) CH3(CH 2)4CH=CHCH 2CH=CH(CH 2)7COOH (5) 4-methylhexanoic acid (6) 2-hydroxybutanedioic acid (7) 2-chloro-4-methylbenzoic acid (8) 3,3,5-trimethyloctanoic acid1. 1. 解:解:(1)3-甲基丁酸 (2)3-对氯苯基丁酸 (3)间苯二甲酸 ( 4)9,12-十八二烯酸十八二烯酸CHCH CHCOOH COOHCl CHCH CCH CHCHOH HCOOH + PClCOOH + PClΔ碱石灰NaCO3Tollens试剂(+)银镜 NaCO3I2 + NaOH(+)△(-)KMnO 4/H (△(丁二酸 二酸己二酸(△() 正丙醇 HBr1) Mg , Et 2O2) CO ; 3) H +O CH HBrNaCNCNH 3OOH H2SO4△H HBr(CHMg Et O1) CO22) H OCl2POH COOH SOCl2COCl CH3CH2COONa THF1) CO222) H+OEtOHH+甲为CH3CH 2COOH , 乙为HCOOC 2H 5 , 丙为CH 3COOCH 3 . 7. 指出下列反应中的酸和碱. (1) 二甲醚和无水三氯化铝二甲醚和无水三氯化铝; (2) (2) 氨和三氟化硼; (3) 乙炔钠和水乙炔钠和水 7.解:按Lewis 酸碱理论:凡可接受电子对的分子、离子或基团称为酸,凡可给予电子对的分子、离子或基团成为碱。
Lewis 碱: 二甲醚二甲醚,, , 氨氨, , 乙炔钠乙炔钠乙炔钠. . Lewis 酸: 三氯化铝三氯化铝 , , , 三氟化硼三氟化硼三氟化硼 , , 水.8. (1) 按照酸性降低的次序排列下列化合物:①乙炔、氨、水; ②乙醇、乙酸、环戊二烯、乙炔(2) 按照碱性降低的次序排列下列离子:①C H3- , CH3O-, HC≡C- ; ②C H3O- , (CH3)3CO-, (CH3)2CHO-8.解:(1)酸性: ①水>乙炔>氨;②乙酸>环戊二烯>乙醇>乙炔(2)碱性:①CH3->HC≡C- >CH3O-; ②(CH3)3CO->(CH3)2CHO->依分OHCOOHCOOHC CHCH3綜上所述,马尿酸的结构为:C NHCHO。

《仪器分析》自学指导书一、课程编码及适用专业课程编码:总学时:72面授学时:32自学学时:40适用专业:化学化工类函授本科各专业二、课程性质仪器分析是以测量物质的物理性质为基础的分析方法。
本课程包括两大部分内容,即基于测定被分析物质的性质对无机、有机和生物物质进行定性和定量分析的各种方法;对复杂混合物质进行定性和定量分析前采用的高效分离技术。
仪器分析是化学、化工专业基础课程之一。
三、本课程的地位和作用仪器分析是化学相关专业的重要专业基础课之一。
仪器分析中的各种方法和技术与现代科学技术的发展相互渗透、相互促进,特别是伴随着微电子学和计算机科学的迅速发展,仪器分析已经成为分析化学的主要组成部分。
通过本课程的学习,可掌握仪器分析的基本原理、基本方法、基本知识和常用仪器的基本操作技能,为学习其它专业课程和今后在实际工作中有效地选用相应的方法和仪器来解决物质的定性和定量问题。
四、学习目的与要求(1) 掌握光谱分析中的基本概念:电磁辐射和电磁波谱,原子光谱和分子光谱,吸收光谱和发射光谱。
(2) 熟悉紫外-可见分光光度法,原子吸收光谱分析,发光分析法的基本原理,分析条件和测量方法。
(3) 了解电化学分析的基本理论和电位分析法,极谱法的基本原理,应用范围,测量条件和测定方法。
(4) 掌握色谱法的理论,分离条件和定量方法。
(5) 熟悉气相色谱,高效液相色谱和薄层色谱法的基本原理,测定方法应用。
(6) 了解核磁共振波谱法和质谱分析法及电泳法的基本原理及其应用。
(7) 熟悉掌握复杂试样前处理的具体步骤及其应用。
五、本课程的学习方法学习本课程,应着重掌握各类分析方法的基本原理、仪器的基本结构及应用。
注意归纳方法原理等有关内容,抽提共性及内在联系,减少内容的零乱和庞杂。
六、自学内容与指导第一部分光谱分析第一章绪论(一)自学内容仪器分析方法分类、仪器分析的特点、仪器分析的发展、现代分析化学-分析科学、现代分析化学中的仪器分析和化学分析。
第十二章质谱分析1.试指出下面哪一种说法是正确的?( )(1) 质量数最大的峰为分子离子峰(2) 强度最大的峰为分子离子峰(3) 质量数第二大的峰为分子离子峰(4) 上述三种说法均不正确解:(4)2.下列化合物含C、H或O、N,试指出哪一种化合物的分子离子峰为奇数?( )(1) C6H6 (2) C6H5NO2(3) C4H2N6O (4) C9H10O2解:(2)3.下列化合物中分子离子峰为奇数的是( )(1) C6H6(2) C6H5NO2(3) C6H10O2S (4) C6H4N2O4解:(2)4.在溴己烷的质谱图中,观察到两个强度相等的离子峰,最大可能的是:( )(1) m/z为15 和29 (2) m/z为93 和15(3) m/z为29 和95 (4) m/z为95 和93解:(4)5.在C2H5F中, F对下述离子峰有贡献的是( )(1) M(2) M+1 (3) M+2 (4) M及M+2解:(1)6.一个酯的质谱图有m/z74(70%)的强离子峰,下面所给结构中哪个与此观察值最为一致?( )(1) CH3CH2CH2COOCH3(2) (CH3)2CHCOOCH3(3) CH3CH2COOCH2CH3(4) (1)或(3)解:(1)7.某化合物分子式为C6H14O, 质谱图上出现m/z59(基峰)m/z31以及其它弱峰m/z73,m/z87和m/z102. 则该化合物最大可能为( )(1) 二丙基醚(2) 乙基丁基醚(3) 正己醇(4) 己醇-2解:(2)8.某胺类化合物, 分子离子峰其M=129, 其强度大的m/z58(100%), m/z100(40%),则该化合物可能为( )(1) 4-氨基辛烷(2) 3-氨基辛烷(3) 4-氨基-3-甲基庚烷(4) (2)或(3)解:(2)9.分子离子峰弱的化合物是:()(1)共轭烯烃及硝基化合物(2)硝基化合物及芳香族(3)脂肪族及硝基化合物(4)芳香族及共轭烯烃解:(3)10.某化合物的质谱图上出现m/z31的强峰, 则该化合物不可能为( )(1) 醚(2) 醇(3) 胺(4) 醚或醇解:(3)11.某化合物在一个具有固定狭峰位置和恒定磁场强度B的质谱仪中分析, 当加速电压V慢慢地增加时, 则首先通过狭峰的是:( )(1) 质量最小的正离子(2) 质量最大的负离子(3) 质荷比最低的正离子(4) 质荷比最高的正离子解:(4)12.下述电离源中分子离子峰最弱的是( )(1) 电子轰击源(2) 化学电离源(3) 场电离源(4) 电子轰击源或场电离源解:(3)13.溴己烷经 均裂后, 可产生的离子峰的最可能情况为:( )(1) m/z93 (2) m/z93和m/z95(3) m/z71 (4) m/z71和m/z73解:(2)14.在下列化合物中, 何者不能发生麦氏重排?( )(1)(2)(3)(4)解:(3)15.某化合物在质谱图上出现m/z 29,43,57的系列峰,在红外光谱图官能团区出现如下吸收峰:>3000c M-1 ;1460c M-1 ,1380c M-1 ,1720c M-1.则该化合物可能是:(1)烷烃(2) 醛(3)酮(4)醛或酮解:(3)16.某化合物质谱图中,M和(M+2)的相对强度大致相当,由此,可以确定该化合物含()(1)硫(2)氯(3)溴(4)氮解:(3)17.质谱计的磁偏转分离器可以将_________ 加以区分,因此它是一种_________分析器。
第十二章质谱分析1.试指出下面哪一种说法是正确的( )(1) 质量数最大的峰为分子离子峰(2) 强度最大的峰为分子离子峰(3) 质量数第二大的峰为分子离子峰(4) 上述三种说法均不正确解:(4)2.下列化合物含 C、H或O、N,试指出哪一种化合物的分子离子峰为奇数( )(1) C6H6(2) C6H5NO2(3) C4H2N6O (4) C9H10O2解:(2)3.下列化合物中分子离子峰为奇数的是( )(1) C6H6(2) C6H5NO2(3) C6H10O2S (4) C6H4N2O4解:(2)4.在溴己烷的质谱图中,观察到两个强度相等的离子峰,最大可能的是:( ) (1) m/z为 15 和 29 (2) m/z为 93 和 15(3) m/z为 29 和 95 (4) m/z为 95 和 93解:(4)5.在C2H5F中, F对下述离子峰有贡献的是( )(1) M (2) M+1 (3) M+2 (4) M及M+2解:(1)6.一个酯的质谱图有m/z74(70%)的强离子峰,下面所给结构中哪个与此观察值最为一致( )(1) CH3CH2CH2COOCH3(2) (CH3)2CHCOOCH3(3) CH3CH2COOCH2CH3(4) (1)或(3)解:(1)7.某化合物分子式为C6H14O, 质谱图上出现m/z59(基峰)m/z31以及其它弱峰m/z73,m/z87和m/z102. 则该化合物最大可能为 ( )(1) 二丙基醚 (2) 乙基丁基醚(3) 正己醇(4) 己醇-2解:(2)8.某胺类化合物, 分子离子峰其M=129, 其强度大的m/z58(100%),m/z100(40%),则该化合物可能为( )(1) 4-氨基辛烷 (2) 3-氨基辛烷(3) 4-氨基-3-甲基庚烷 (4) (2)或(3)解:(2)9.分子离子峰弱的化合物是:()(1)共轭烯烃及硝基化合物 (2)硝基化合物及芳香族(3)脂肪族及硝基化合物 (4)芳香族及共轭烯烃解:(3)10.某化合物的质谱图上出现m/z31的强峰, 则该化合物不可能为( )(1) 醚 (2) 醇 (3) 胺 (4) 醚或醇解:(3)11.某化合物在一个具有固定狭峰位置和恒定磁场强度B的质谱仪中分析, 当加速电压V慢慢地增加时, 则首先通过狭峰的是:( )(1) 质量最小的正离子 (2) 质量最大的负离子(3) 质荷比最低的正离子 (4) 质荷比最高的正离子解:(4)12.下述电离源中分子离子峰最弱的是( )(1) 电子轰击源 (2) 化学电离源(3) 场电离源 (4) 电子轰击源或场电离源解:(3)13.溴己烷经均裂后, 可产生的离子峰的最可能情况为:( )(1) m/z93 (2) m/z93和m/z95(3) m/z71 (4) m/z71和m/z73解:(2)14.在下列化合物中, 何者不能发生麦氏重排( )(1)(2)(3)(4)解:(3)15.某化合物在质谱图上出现m/z 29,43,57的系列峰,在红外光谱图官能团区出现如下吸收峰:>3000c M-1 ;1460c M-1 ,1380c M-1 ,1720c M-1.则该化合物可能是: (1)烷烃 (2) 醛 (3)酮 (4)醛或酮解:(3)16.某化合物质谱图中,M和(M+2)的相对强度大致相当,由此,可以确定该化合物含()(1)硫(2)氯(3)溴(4)氮解:(3)17.质谱计的磁偏转分离器可以将 _________ 加以区分,因此它是一种_________分析器。
而静电偏转分离器可以将 _______ 加以区分,因此它是一种_________分析器。
解:质荷比不同的离子;质量;能量不同的离子;能量。
18. CO2经过质谱离子源后形成的带电粒子有 CO2+、CO+、C+、CO22+等,它们经加速后进入磁偏转质量分析器,它们的运动轨迹的曲率半径由小到大的次序为_______。
解:因为: CO2+、CO+、 C+、 CO22+m/z 44 28 12 22次序为: C+、 CO22+、 CO+、 CO2+19.质谱仪的分辨本领是指的能力.解:分开相邻质量数离子20.高分辨质谱仪一个最特殊的用途是获得化合________________________。
解:精确的相对分子质量、分子式、化合物的大致类型21.质谱图中出现的信号应符合氮规则,它是指。
22.丁苯质谱图上m/z134, m/z91和m/z92的峰分别由于__________________和_______________________过程产生的峰.解:分子失去一个电子, -开裂和麦氏重排23.在有机化合物的质谱图上, 常见离子有______________________________出现,其中只有__________________________是在飞行过程中断裂产生的.解:分子离子峰,同位素离子峰,亚稳离子峰,碎片离子峰,重排离子峰,多电荷离子峰,亚稳离子峰24.试述质谱仪的主要部件及其功能解:真空系统, 进样系统, 电离室, 加速室, 离子分析器, 检测系统功能略。
25.某化合物分子式为C4H8O2, M=88, 质谱图上出现m/z60的基峰.则该化合物最大可能为__________________________.解:正丁酸26.某化合物分子式为C10H12O,质谱图上出现m/z105的基峰, 另外有m/z51,m/z77,m/z120和m/z148的离子峰,试推测其结构, 并解释理由.解:C6H5 COC3H727.相对分子质量的奇偶性与组成分子的元素及原子的数目有关.当相对分子质量为偶数时,必含_________个氮原子; 当相对分子质量为奇数时,必含______个氮原子.解:偶数或零, 奇数28.同位素离子峰位于质谱图的最高质量区,计算___________与___________的强度比,根据________表确定化合物的可能分子式。
解:同位素离子峰;分子离子峰;拜诺。
29.因亚稳态离子峰是亚稳离子在离开_________后碎裂产生的, 故在质谱图上____于其真实质荷比的位置出现.它的出现可以为分子的断裂提供断裂途径的信息和相应的____离子和_____离子。
解:电离室;低;子;母。
30.m/e142的烃的可能分子式是_________________.各自的M和M+1的比例是_______。
解:C10H22和C11H10;100:11和100:12。
31.考虑到12C和13C的分布,乙烷可能的分子式是_________________________.这些同位素分子的分子离子值m/z分别是________________________________。
解:12CH312CH3、12CH313CH3、13CH313CH3;m/z(M)、m/z31(M+1)、m/z32(M+2)。
32.欲将摩尔质量分别为、、和 260.0922g/M ol 的四个离子区分开,问质谱计需要有多大的分辨本领。
解:MMR= ── = ────── = 9328 ≈ 104M33.在某烃的质谱图中m/z57 处有峰,m/ 处有一较弱的扩散峰。
则m/z 57的碎片离子在离开电离室后进一步裂解,生成的另一离子的质荷比应是多少解:M1= 57 M* =∵ M* = (M2)2/M1∴ M2 = (M1·M* )1/2= (57×1/2 = 4334.在化合物 CHCl3的质谱图中,分子离子峰和同位素峰的相对强度比为多少解:∵ (a+b)3 = a3 + 3a2b + 3b2a + b3而a = 3 b = 1∴M : M+2 : M+4 : M+6 = 27 : 27 : 9 : 135.在一可能含C、H、N的化合物的质谱图上,M : M + 1 峰为 100 : 24 ,试计算该化合物的碳原子数。
解:∵ (M+1)/M×100 = + +(M+1)/M×100 ≈ W∴(24/100)×100 = WW≈ 22碳原子数约为 2236.在C100H202中, (M+1)/M为多少已知13C强度为; 2H为.解:(M+1)/M=×100+×202)/100 =112/100=37.试计算CH3SH中(M+2)/M的值. 已知13C、2H和34S的强度分别为,和。
解:(M+2)/M=[×1+×4)2/200+1×]/100 =10038.试计算下列化合物的(M+2)/M和(M+4)/M的值:(1) 二溴甲苯(2) 二氯甲烷解:根据二项展开式(a+b), 可知:(1) M:(M+2):(M+4)为1:2:1(2) M:(M+2):(M+4)为9:6:1 =1::39.已知亚稳离子峰的m/e为, 其离子的m/e为187, 试问在正常情况下裂解,m/峰的真实质量为多少解:M *=M 22/M 1, M 2=(M *×M 1)1/2=×187)1/217240. 将C 10H 5N +.()和C 10 CH 91213+.()离子分开,质谱计应具有多高的分辨率解:分辨率:R m m m =-=-≈12114206567142073781420656717520...41. m/z 为500的离子,在分辨率为1万的质谱仪上可与相差多少质量单位的离子分开解:因为分辨率:R m m m mm m m R =-=∴==⨯=⨯-1211142500110510∆∆(质量单位) 42.用质谱仪辨别分子氧和硫,需要多大的分辨率(相对原子质量:O :;S :)。
解:分辨率:43. 甲醇在M /e =15、28、29、30、31和32处有质谱峰。
在M /e =处存在一条宽而强度低的亚稳离子峰。
试确定子离子和母离子。
解: m m m *().==221229312713所以子离子的质量数29 CHO +母离子的质量数为31 CH3O+44.以最大强度同位素为100,13C的天然强度是,37Cl的天然强度为,试计算含有一个碳原子和一个氯原子的化合物的M、(M+1)、(M+2)、(M+3)峰的相对强度。
解:离子组成强度M+12C35Cl 100M+1 13C35ClM+2 12C37ClM+3 13C37Cl每步一分,组成及强度各分。
45.试计算当加速电压为6000V时,质量为100的一价正离子在的磁场中运行轨迹的半径。
(1单位正电荷=×10-19C)解:E计算中c代表“分子”公式1分,单位1分,计算1分46.某有机化合物在紫外光区的 205n M以上没有吸收,它的质谱、红外(纯液膜)和氢核磁共振谱如下图。