离子的类型及开裂规律 两节课时间太紧张
离子的类型 1.分子离子峰:
在电子轰击下,有机物分子电离一个电子形成 的离子,叫分子离子 分子离子的质量就是化合物的相对分子量。
分子离子足够稳定,质谱中位于质荷比最高 位置的峰就是分子离子峰。
1
辨认分子离子峰的方法
1. 分子离子峰一定是质谱中质量数最大的峰,应处在质 谱图的最右端。
正相反。苯甲醇中M-1峰很强,是因为生成了稳定的羟基 离子 m/z107;苄醇也有M-2 ,M-3的峰,强度较弱,苯酚的M-1是弱峰。 酚的裂解如下:
H O┐ rH
┐
O H H
m/z 94
m/z 94
H
CHO
┐
或
H
┐
H
m/z 66
m/z 65
41
苯甲醇和酚的特征裂解都有经过H转移丢失CO产生M-28 的峰,还有丢失 CHO基团的M-29的峰。苯甲醇有M(CHO),即m/z79的峰是基峰。酚有M-28(m/z66)和 M-29(m/z65)的弱峰。
同部分碎片峰,可粗略推测化合物的大致结构。 • 以所有可能方式把各部分结构单元连接起来,再利
用质谱数据,将造成的结构中不合理的结构排除掉。
45
质谱图解析 —— 例1 (P266)
46
47
质谱图解析 —— 例2
48
49
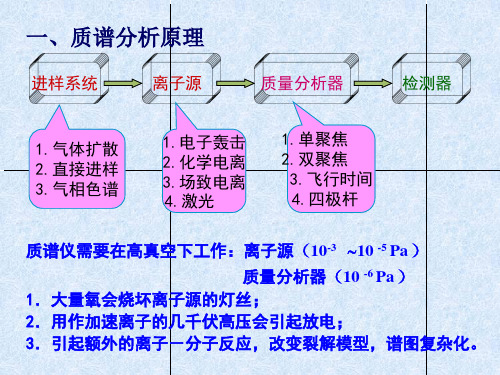
GC和MS联用的优点
• GC:善于分离,不善于定性 • MS:善于定性,不善于分离 • GC-MS:分离,定性同时进行
10
离子开裂的几种类型
单纯开裂— 断一个键,脱离一个游离基 重排开裂— 有两个键断裂,一个氢原子发生转移,
脱去一个中性分子 复杂开裂— 几个键开裂,并有氢原子的转移 双重重排— 有两个氢的转移