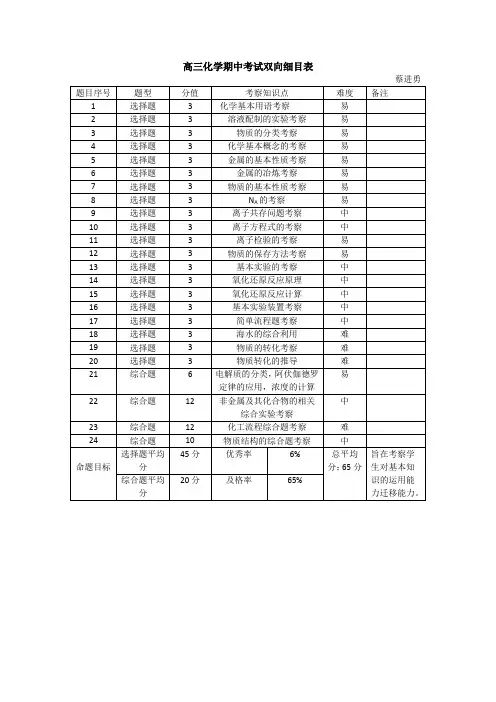
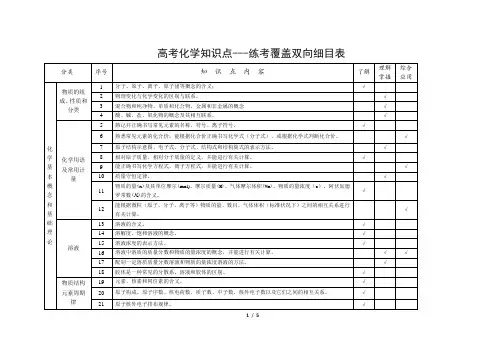
高中化学选修三双向细目表
- 格式:docx
- 大小:15.94 KB
- 文档页数:1
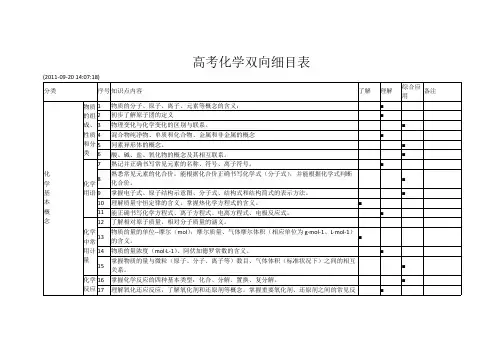
高考化学双向细目表(2011-09-20 14:07:18)分类序号知识点内容了解理解综合应用备注1物质的分子、原子、离子、元素等概念的含义;■2初步了解原子团的定义■3物理变化与化学变化的区别与联系。
■4混合物纯净物、单质和化合物、金属和非金属的概念 ■ 5同素异形体的概念。
■ 物质的组成、性质和分类6酸、碱、盐、氧化物的概念及其相互联系。
■ 7熟记并正确书写常见元素的名称、符号、离子符号。
■ 8熟悉常见元素的化合价。
能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价。
■ 9掌握电子式、原子结构示意图、分子式、结构式和结构简式的表示方法。
■ 10理解质量守恒定律的含义。
掌握热化学方程式的含义。
■化学用语11能正确书写化学方程式、离子方程式、电离方程式、电极反应式。
■ 12了解相对原子质量、相对分子质量的涵义。
13物质的量的单位--摩尔(mol ),摩尔质量、气体摩尔体积(相应单位为g·mol-1、L·mol-1)的含义。
■14物质的量浓度(mol·L-1)、阿伏加德罗常数的含义。
■ 化学中常用计量15掌握物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系。
■ 16掌握化学反应的四种基本类型:化合、分解、置换、复分解。
■化学基本概念化学反应17理解氧化还应反应,了解氧化剂和还原剂等概念。
掌握重要氧化剂、还原剂之间的常见反■应。
18能判断氧化还原反应中电子转移的方向和数目,并能配平反应方程式。
■与能量19了解化学反应中的能量变化,吸热反应、放热反应、反应热、燃烧热和中和热及新能源的开发等概念。
■20了解溶液的涵义■21了解溶液的组成,理解溶液中溶质的质量分数的概念。
■22了解饱和溶液、不饱和溶液的概念。
了解溶解度的概念。
了解温度对溶解度的影响及溶解度曲线。
■23初步了解结晶、结晶水、结晶水合物、风化、潮解的概念。
■溶液24了解胶体的概念及其重要性质和应用。

2021山东高考化学双向细目表一、物质的结构与性质1.1 原子结构1.1.1 原子的组成及结构1.1.2 原子的尺寸与质量1.1.3 元素周期表的基本规律1.1.4 原子的结构与性质关系1.2 化学键及其性质1.2.1 价键理论及其原则1.2.2 共价键、离子键和金属键的特点1.2.3 键的极性及其影响1.2.4 键的性质与物质性质的关系1.3 物质的结构与性质1.3.1 晶体的结构及其性质1.3.2 分子的结构及其性质1.3.3 聚合物的结构及其性质1.3.4 点择性吸附与分离技术二、化学反应与能量2.1 化学反应及其类型2.1.1 化学反应的基本概念2.1.2 氧化还原反应及其类型2.1.3 酸碱中和反应及其类型2.1.4 水解与水合反应2.2 反应速率与化学平衡2.2.1 反应速率的测定及影响因素2.2.2 化学平衡的条件和平衡常数2.2.3 平衡常数与反应的热力学关系2.2.4 平衡常数与反应进行方向的关系2.3 化学能量变化2.3.1 化学反应的热力学基础2.3.2 燃烧和爆炸的热效应2.3.3 化学反应的热效应计算2.3.4 化学反应的能量变化与反应进行方向的关系三、物质的量与浓度3.1 物质的量及其计算3.1.1 质量、物质的量及摩尔的概念3.1.2 原子量、分子量及摩尔质量计算3.1.3 溶质的量浓度计算3.1.4 离子在溶液中的浓度计算3.2 溶液与离子平衡3.2.1 溶液的分类及其表达方式3.2.2 溶解度、溶解度积与离子平衡3.2.3 溶液的酸碱性及其浓度3.2.4 氧化还原反应与化学平衡3.3 溶液的反应性3.3.1 溶液的电导率与电解质3.3.2 溶液的中和与沉淀生成3.3.3 溶液的挥发性与溶解度规律3.3.4 离子的选择性吸附分离技术四、电化学与化学动力学4.1 电解质溶液4.1.1 电解质溶液的电导率及其测定4.1.2 离子迁移与电泳现象4.1.3 离子迁移速率与电解质溶液浓度关系4.1.4 电解质溶液的极化现象4.2 电解与电沉积4.2.1 电解的基本概念及电解池的组成4.2.2 电解的电压与电解的施行4.2.3 电沉积与析氢析氧以及析金析银反应4.2.4 电沉积与电化学腐蚀的关系4.3 化学动力学4.3.1 化学反应速率的概念及测定方法4.3.2 影响化学反应速率的因素4.3.3 化学反应机理及速率定律4.3.4 化学反应的速率与热力学关系五、化学反应中的能量变化5.1 化学反应的热效应5.1.1 化学反应的热效应概念及测定方法5.1.2 燃烧与爆炸的热效应计算5.1.3 化学反应的热效应对反应进行方向的影响5.1.4 化学反应的热效应与热化学方程的关系5.2 化学反应中的能量转化5.2.1 化学反应热与能量转化的基本规律5.2.2 化学反应热效应计算应用5.2.3 标准生成焓与生成焓变的计算5.2.4 化学反应热性质与热力学关系5.3 化学反应的热力学基础5.3.1 系统与外界的热力学基本概念及关系5.3.2 热力学第一定律与能量守恒定律的适用性5.3.3 热力学第二定律与熵增加原理的应用5.3.4 化学反应热力学基础与热化学方程的关系六、化学元素及其化合物6.1 元素的发现及应用6.1.1 元素的发现及命名6.1.2 元素的性质及其规律6.1.3 元素的应用及其环境影响6.1.4 新型元素的发现及其应用前景6.2 元素及其化合物的制备6.2.1 元素及其化合物的实验制备6.2.2 元素及其化合物的工业制备6.2.3 元素及其化合物的纯化6.2.4 元素及其化合物的再利用与资源的可持续利用6.3 元素周期律及离子理论6.3.1 原子的结构与性质周期律6.3.2 元素化合价与价态规律6.3.3 阱离子稳定性规律及其应用6.3.4 离子组成及其性质与周期律的关系以上便是2021年山东高考化学的双向细目表,通过系统的学习与复习这些内容,相信学生们定能在高考中取得优异的成绩。
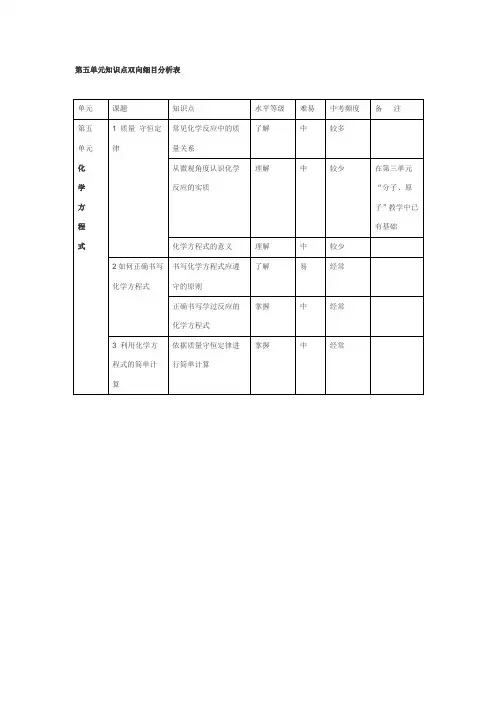
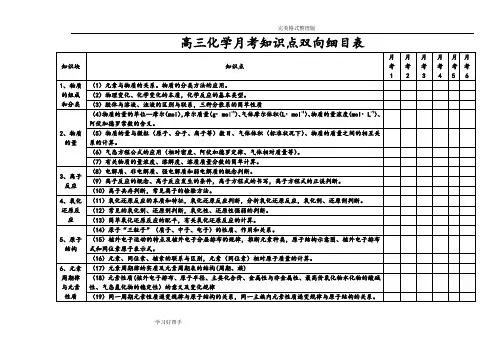


高中化学双向细目表高考化学双向细目表分类序号知识点内容1 物质的组成、性质和分类2 化学基本概念3 物质的分子、原子、离子、元素等概念的含义;初步了解原子团的定义4 物理变化与化学变化的区别与联系5 混合物、纯净物、单质和化合物、金属和非金属的概念6 同素异形体的概念7 酸、碱、盐、氧化物的概念及其相互联系8 熟记并正确书写常见元素的名称、符号、离子符号9 熟悉常见元素的化合价;能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价10 掌握电子式、原子结构示意图、分子式、结构式和结构简式的表示方法;理解质量守恒定律的含义;掌握热化学方程式的含义11 能正确书写化学方程式、离子方程式、电离方程式、电极反应式12 了解相对原子质量、相对分子质量的涵义13 掌握物质的量的单位--摩尔(mol),摩尔质量、气体摩尔体积(相应单位为g·mol-1、L·mol-1)的含义14 物质的量浓度(mol·L-1)、阿伏加德罗常数的含义15 掌握物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系16 掌握化学反应的四种基本类型:化合、分解、置换、复分解17 理解氧化还原反应,了解氧化剂和还原剂等概念;掌握重要氧化剂、还原剂之间的常见反应18 能判断氧化还原反应中电子转移的方向和数目,并能配平反应方程式19 了解化学反应中的能量变化,吸热反应、放热反应、反应热、燃烧热和中和热及新能源的开发等概念20 了解溶液的涵义21 了解溶液的组成,理解溶质的质量分数的概念22 了解饱和溶液、不饱和溶液的概念;了解溶解度的概念;了解温度对溶解度的影响及溶解度曲线23 初步了解结晶、结晶水、结晶水合物、风化、潮解的概念24 了解胶体的概念及其重要性质和应用25 了解原子的组成及同位素的概念26 掌握原子序数、核电荷数、质子数、中子数、核外电子数,以及质量数与质子数、中子数之间的相互关系注:综合应用部分不在此表中列出。

高中化学命题双向细目表
高中化学命题双向细目表是一个指导教师命题的重要工具,它详细列出了高中化学的各个知识点和技能,以及它们在试卷中的比重和难度。
以下是一个简化的高中化学命题双向细目表,供您参考:
高中化学命题双向细目表
一、目标领域与认知层级
1. 知识
回忆
理解
应用
2. 技能
分析
判断
实验
3. 态度与价值观
兴趣与好奇心
安全意识
环境保护
二、内容主题
1. 物质结构与性质
分子、原子、离子的基本性质
元素周期表与元素性质
酸、碱、盐、氧化物的性质与反应2. 化学反应与能量
化学反应的类型与能量变化
电化学基础(原电池、电解池)3. 有机化学基础
常见有机物的结构与性质
有机反应类型与机理
4. 实验技能与安全
实验操作与仪器使用
实验设计与数据处理
实验安全与环境保护
5. 化学计算
物质的量与摩尔质量计算
化学反应中的定量关系与计算
6. 化学工艺流程与合成
实际生产中的化学工艺流程
有机合成与高分子合成基础
7. 综合应用
各主题的综合应用与分析解决实际问题能力。

(原创2023)化学高考双向细目表一、无机化学1. 元素和化合物- 1.1 元素周期表- 1.2 常见元素的性质和应用- 1.3 水和溶液中的离子反应- 1.4 化合物的命名和化学式2. 化学反应- 2.1 燃烧反应- 2.2 氧化还原反应- 2.3 酸碱中和反应- 2.4 沉淀反应- 2.5 气体生成和反应3. 化学原理- 3.1 序列化反应和电位差- 3.2 动态平衡和平衡常数- 3.3 反应速率和速率常数- 3.4 催化剂和化学反应速率二、有机化学1. 有机化合物- 1.1 碳的特性和共价键- 1.2 烃类化合物- 1.3 醇、酚、醚类化合物- 1.4 醛、酮、羧酸类化合物- 1.5 氨基酸和蛋白质2. 有机反应- 2.1 烃类的燃烧反应- 2.2 单官能团化合物的反应- 2.3 多官能团化合物的反应- 2.4 聚合反应和聚合物的合成- 2.5 脂肪酸和酯的反应3. 有机化学原理- 3.1 反应机理和反应路径- 3.2 功能团和化学性质- 3.3 离子和自由基反应- 3.4 共轭系统和共轭反应三、化学实验1. 基本实验操作- 1.1 实验室安全和实验室常识- 1.2 仪器使用和实验操作技巧- 1.3 实验记录和数据处理2. 实验现象和解释- 2.1 气体生成与气体收集- 2.2 溶液中的颜色变化- 2.3 岩石和矿石的检验- 2.4 酸碱中和和中和滴定- 2.5 电解质的电导性实验3. 实验设计和控制变量- 3.1 实验变量和实验因素- 3.2 实验设计和实验步骤- 3.3 实验结果的误差和精度- 3.4 实验报告的撰写和结论以上为高考化学学科的双向细目表,其中包含了无机化学、有机化学和化学实验三个部分的细分内容。
学生可以根据这份细目表来进行有针对性的学习和复习,以便在高考中取得好成绩。
绪言教学目标双向表学习水平层次知识点(列)识记(A)理解(B)简单情境中的应用(C)复杂情境中的应用(D)化学于人类进步以及社会发展的密切关系,学习化学的价值√化学是研究物质的组成、结构、性质以及变化规律的自然科学√√元素是组成物质的基本成分√化学作为一门独立学科的发展史√√原子论、分子学说在学科发展中的作用√运用化学知识也需要坚持科学发展观√化学对其它学科的发展起到促进作用√教学目标与教学评价目标双向表学习水平层次知识点(列)选择题填空题计算题实验题A B C D A B C D A B C D A B C D化学于人类进步以及社会发展的密切关系,学习化学的价值√化学是研究物质的组成、结构、性质以及变化规律的自然科学√√元素是组成物质的基本成分√√化学作为一门独立学科的发展史√原子论、分子学说在学科发展中的作用√√√√运用化学知识也需要坚持科学发展观√化学对其它学科的发展起到促进作用√第一单元走进化学实验室课题1 物质的变化和性质教学目标双向表学习水平层次知识点(列)识记(A)理解(B)简单情境中的应用(C)复杂情境中的应用(D)化学变化、物理变化的概念√√区分物质的物理性质和化学性质√√√物理变化和化学变化的联系√化学变化时常伴随能量变化,物理技术和方法对研究化学也是很重要的√物质的性质与物质的组成和结构的联系√物质性质与物质变化规律以及用途之间的关系√教学目标与教学评价目标双向表学习水平层次知识点(列)选择题填空题计算题实验题A B C D A B C D A B C D A B C D化学变化、物理变化的概念√√√√区分物质的物理性质和化学性质√√√√√√物理变化和化学变化的联系√√化学变化时常伴随能量变化,物理技术和方法对研究化学也是很重要的√√物质的性质与物质的组成和结构的联系√√物质性质与物质变化规律以及用途之间的关系√√课题2 化学是一门以实验为基础的科学教学目标双向表学习水平层次知识点(列)识记(A)理解(B)简单情境中的应用(C)复杂情境中的应用(D)实验是学习化学的重要途径√对实验现象进行观察和描述,记录①条件②变化前后的颜色和状态③过程中的现象√√√认识蜡烛及蜡烛燃烧现象√√吸入和呼出气体成分的差异√√根据方案进行实验,及写实验报告√教学目标与教学评价目标双向表学习水平层次知识点(列)选择题填空题计算题实验题A B C D A B C D A B C D A B C D实验是学习化学的重要途径√√√√对实验现象进行观察和描述,记录①条件②变化前后的颜色和状态③过程中的现象√√√√√√√√√认识蜡烛及蜡烛燃烧现象√√√√√√吸入和呼出气体成分的差异√√√√√√根据方案进行实验,及写实验报告√√课题3 走进化学实验室教学目标双向表学习水平层次知识点(列)识记(A)理解(B)简单情境中的应用(C)复杂情境中的应用(D)实验室规则√化学试剂取用原则,药品取用的方法(粉末状、块状、液体药品的取用,量筒、滴灌的使用等)√√酒精灯使用的注意事项√√给试管里的液体或固体物质加热的方法√√玻璃仪器的洗涤方法√√常用仪器的使用及操作注意事项√√正确使用托盘天平,对错误称量进行正确的数据处理√√√分析量筒量液时读数错误(俯视,仰视)给实验数据的计算带来误差√√√教学目标与教学评价目标双向表学习水平层次知识点(列)选择题填空题计算题实验题A B C D A B C D A B C D A B C D实验室规则√√√化学试剂取用原则,药品取用的方法(粉末状、块状、液体药品的取用,量筒、滴灌的使用等)√√√√√√酒精灯使用的注意事项√√√√√√给试管里的液体或固体物质加热的方法√√√√√√玻璃仪器的洗涤方法√√√√√√常用仪器的使用及操作注意事项√√√√√√正确使用托盘天平,对错误称量进行正确的数据处理√√√√√√√√√分析量筒量液时读数错误(俯视,仰视)给实验数据的计算带来误差√√√√√√√√√第二单元我们周围的空气课题1 空气教学目标双向表学习水平层次知识点(列)识记(A)理解(B)简单情境中的应用(C)复杂情境中的应用(D)空气成分实验,及各成分的用途√纯净物和混合物√√√设计实验,探究空气中氧气的体积分数√√√探究空气中氧气体积分数实验结果的误差原因分析√√√√氧气、氮气、稀有气体的主要用途及相关性质√√空气污染的原因、危害及防治措施√√√文字表达式表示化学反应过程√√绿色化学的理念√√教学目标与教学评价目标双向表学习水平层次知识点(列)选择题填空题计算题实验题A B C D A B C D A B C D A B C D空气成分实验,及各成分的用途√√纯净物和混合物√√√√√√设计实验,探究空气中氧气的体积分数√√√√√√探究空气中氧气体积分数实验结果的误差原因分析√√√√√√√√√氧气、氮气、稀有气体的主要用途及相关性质√√√√空气污染的原因、危害及防治措施√√√√√√文字表达式表示化学反应过程√√√√√√绿色化学的理念√√√√课题2 氧气教学目标双向表学习水平层次知识点(列)识记(A)理解(B)简单情境中的应用(C)复杂情境中的应用(D)氧气的物理性质√氧气能与很多物质发生化学反应,氧气的化学性质比较活泼√√√许多物质在氧气中和在空气中燃烧现象不同,从实验中获取化学信息√√√化合反应、氧化反应√√√√缓慢氧化及相关事例√√化学反应中的能量变化√√文字表达式表示化学反应过程√√√教学目标与教学评价目标双向表学习水平层次知识点(列)选择题填空题计算题实验题A B C D A B C D A B C D A B C D氧气的物理性质√√√氧气能与很多物质发生化学反应,氧气的化学性质比较活泼√√√√√√许多物质在氧气中和在空气中燃烧现象不同,从实验中获取化学信息√√√√√√√√√化合反应、氧化反应√√√√√√√√√√√√缓慢氧化及相关事例√√√√化学反应中的能量变化√√√√文字表达式表示化学反应过程√√√√√√√课题3 制取氧气教学目标双向表学习水平层次知识点(列)识记(A)理解(B)简单情境中的应用(C)复杂情境中的应用(D)实验室制取氧气的原理、装置、步骤及注意事项√√√√催化剂及催化作用√√√运用简单装置制取氧气√√通过铁、碳在氧气中燃烧的实验探究,验证氧气的性质√√分解反应的特点√√√通过实验认识氧化铁、氧化铜也可做实验室制取氧气的催化剂√√通过比较分析,探究温度、浓度等也会影响过氧化氢溶液制取氧气的速率√√√√对实验失败,收集氧气不纯等的原因进行分析、纠正√√√√教学目标与教学评价目标双向表学习水平层次知识点(列)选择题填空题计算题实验题A B C D A B C D A B C D A B C D实验室制取氧气的原理、装置、步骤及注意事项√√√√√√√√√√√√√√√√催化剂及催化作用√√√√√√√√√运用简单装置制取氧气√√√√√√通过铁、碳在氧气中燃烧的实验探究,验证氧气的性质√√√√√√分解反应的特点√√√√√√通过实验认识氧化铁、氧化铜也可做实验室制取氧气的催化剂√√√√√√通过比较分析,探究温度、浓度等也会影响过氧化氢溶液制取氧气的速率√√√√√√√√√√√√对实验失败,收集氧气不纯等的原因进行分析、纠正√√√√√√√√√√√√第三单元物质构成的奥秘课题1 分子和原子教学目标双向表学习水平层次知识点(列)识记(A)理解(B)简单情境中的应用(C)复杂情境中的应用(D)物质是由分子原子等微小的粒子构成的√通过实验探究活动和自测的分子模型,由形象到抽象认识分子、原子的特征√√√用分子原子的观点解释一些简单的现象√√分子是保持物质化学性质的最小粒子,原子是化学变化中的最小粒子,分子与原子的区别和联系。
2020年-2021年高考化学知识点双向细目表高考化学知识点双向细目表序分类知识点内容近三年高考再现号物质的分子、原子、离子、1元素等概念的含义;物质17 18 19的组 3 成、性质 4 和分物理变化与化学变化的区别与联系。
混合物纯净物、单质和化合物、金属和非金属的概念28 盐类反应8中的基础涉及5 同素异形体的概念。
类化酸、碱、盐、氧化物的概念6学及其相互联系。
基熟记并正确书写常见元素本的名称、符号、离子符号。
概熟悉常见元素的化合价。
能7念根据化合价正确书写化学式(分子式),并能根据化化学学式判断化合价。
用语熟悉常见元素的化合价。
能根据化合价正确书写化学8,综合化合 6 价,共价键主要考 C 族元素27,综合元素周期律8 式(分子式),并能根据化学式判断化合价。
掌握电子式、原子结构示意图、分子式、结构式和结构简式的表示方法。
能正确书写化学方程式、离子方程式、电离方程式、电极反应式。
了解相对原子质量、相对分12子质量的含义。
物质的量的单位-- 摩尔(mol),摩尔质量、气体摩13化学尔体积(相应单位为中常g·mol -1 、L·mol -1 )。
用计物质的量浓度(mol·L-1 )、14量阿伏加德罗常数。
掌握物质的量与微粒(原子、分子、离子等)数目、15气体体积(标准状况下)之11,综合原子结构中等6,氧化还原涉及简单16 化学反应与能量17 间的相互关系。
掌握化学反应的四种基本类型:化合、分解、置换、复分解。
理解氧化还应反应,了解氧化剂和还原剂等概念。
掌握重要氧化剂、还原剂之间的常见反应。
12 氧化还原、物质的量、化学计算中等26 题一问6,综合部份物质的量计算,主要得失电子守恒、部份氧化还原,中上13 题氧化10,得失电子守恒,方程式配平能判断氧化还原反应中电与离子综合18 子转移的方向和数目,并能配平反应方程式。
了解化学反应中的能量变26,热方程,11 热化学书7 热化学书化,吸热反应、放热反应、19反应热、燃烧热和中和热及反应热7 分写反应热,中等写反应热,中等新能源的开发等概念。