(完整版)高考化学知识点双向细目表.doc
- 格式:doc
- 大小:537.01 KB
- 文档页数:5
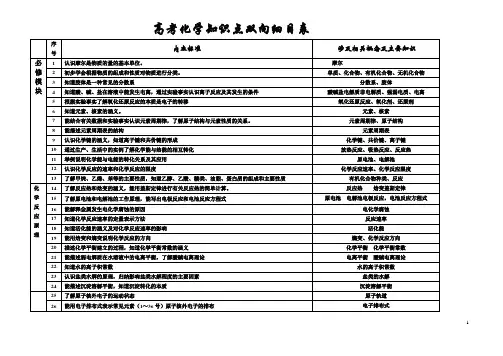


高一化学必修双向细目表1. 化学基础知识- 原子结构和元素周期表- 化学键和化合物的分类- 化学反应和化学方程式- 酸碱中和和中性化学反应- 物质的状态变化和相变- 化学量和化学计算- 元素周期表中的主要元素和其特性- 元素的周期性和趋势- 物质的分子结构和化学键的类型2. 化学实验技能- 实验室安全和实验室设备的使用- 常用实验方法和仪器的操作- 实验数据的记录和处理- 实验结果的分析和解释- 实验原理和实验设计3. 化学反应与能量变化- 化学反应的能量变化- 燃烧反应和氧化还原反应- 酸碱中和反应和热化学方程式- 粒子间的引力作用和化学反应的速率- 化学反应的平衡和平衡常数- 溶液中的溶解度和溶液的浓度4. 化学物质的构成与结构- 元素和化合物的构成- 原子和分子的结构- 组成物质的化学键- 元素周期表中元素的结构特性- 金属和非金属元素的性质- 化合物的分子结构和性质- 傅里叶光谱和分子结构分析5. 化学周期律与离子反应- 元素周期表和周期律规律- 同一周期和同一族的元素特性- 阴离子与阳离子的结构和特性- 离子反应的性质和反应方程式- 酸碱反应和生成离子的化学方程式- 离子溶液中的电离反应和电导率6. 环境与持续发展化学- 化学物质对环境的影响- 大气污染和水污染的原因和防治- 可持续发展和绿色化学的概念- 环境友好的化学产品和过程- 生物质资源的利用和能源转化- 化学垃圾处理和废物回收利用的方法7. 高分子物质与生物化学- 高分子物质的结构和性质- 聚合反应与高分子合成- 塑料和纤维的生产和应用- 生物大分子的结构和功能- 生物有机物的合成和代谢- 酶的催化作用和生物化学反应以上是高一化学必修双向细目表的主要内容。
这份文档包含了学习该科目所需的基础知识、实验技能以及各个单元的重点内容。
希望能对你的学习和备考有所帮助。
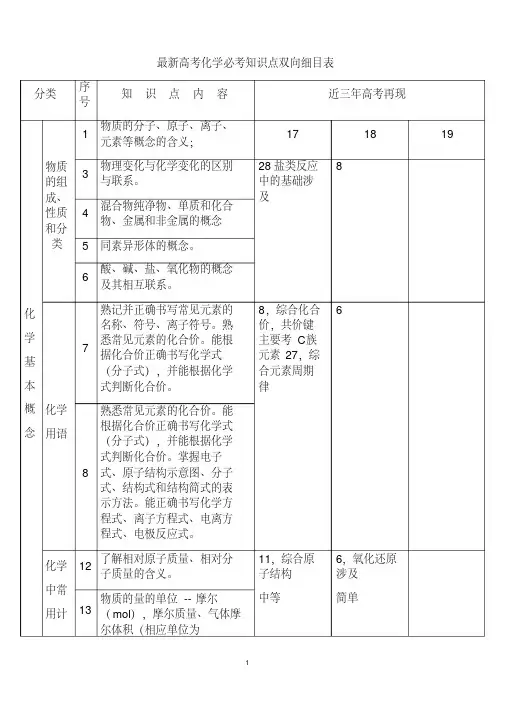
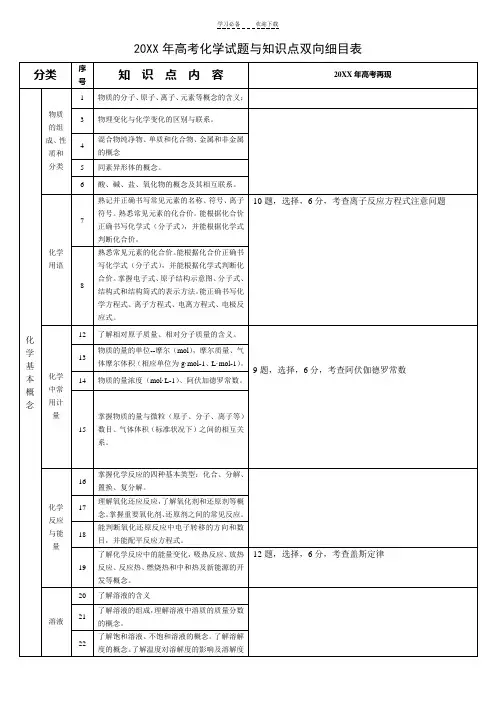
最新高考化学必考知识点双向细目表分类序号知识点内容近三年高考再现化学基本概念物质的组成、性质和分类1物质的分子、原子、离子、元素等概念的含义;17 18 193物理变化与化学变化的区别与联系。
28盐类反应中的基础涉及84混合物纯净物、单质和化合物、金属和非金属的概念5 同素异形体的概念。
6酸、碱、盐、氧化物的概念及其相互联系。
化学用语7熟记并正确书写常见元素的名称、符号、离子符号。
熟悉常见元素的化合价。
能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价。
8,综合化合价,共价键主要考C族元素27,综合元素周期律68熟悉常见元素的化合价。
能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价。
掌握电子式、原子结构示意图、分子式、结构式和结构简式的表示方法。
能正确书写化学方程式、离子方程式、电离方程式、电极反应式。
化学中常用计12了解相对原子质量、相对分子质量的含义。
11,综合原子结构中等6,氧化还原涉及简单13物质的量的单位--摩尔(mol),摩尔质量、气体摩尔体积(相应单位为量g·mol-1、L·mol-1)。
14 物质的量浓度(mol·L-1)、阿伏加德罗常数。
15 掌握物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系。
化学反应与能量16掌握化学反应的四种基本类型:化合、分解、置换、复分解。
12氧化还原、物质的量、化学计算中等26题一问6,综合部份物质的量计算,主要得失电子守恒、部份氧化还原,中上13题氧化与离子综合10,得失电子守恒,方程式配平17理解氧化还应反应,了解氧化剂和还原剂等概念。
掌握重要氧化剂、还原剂之间的常见反应。
18能判断氧化还原反应中电子转移的方向和数目,并能配平反应方程式。
19了解化学反应中的能量变化,吸热反应、放热反应、反应热、燃烧热和中和热及新能源的开发等概念。
26,热方程,反应热7分11热化学书写反应热,中等7热化学书写反应热,中等溶液20 了解溶液的含义8涉及21了解溶液的组成,理解溶液中溶质的质量分数的概念。


高中化学命题双向细目表
高中化学命题双向细目表是一个指导教师命题的重要工具,它详细列出了高中化学的各个知识点和技能,以及它们在试卷中的比重和难度。
以下是一个简化的高中化学命题双向细目表,供您参考:
高中化学命题双向细目表
一、目标领域与认知层级
1. 知识
回忆
理解
应用
2. 技能
分析
判断
实验
3. 态度与价值观
兴趣与好奇心
安全意识
环境保护
二、内容主题
1. 物质结构与性质
分子、原子、离子的基本性质
元素周期表与元素性质
酸、碱、盐、氧化物的性质与反应2. 化学反应与能量
化学反应的类型与能量变化
电化学基础(原电池、电解池)3. 有机化学基础
常见有机物的结构与性质
有机反应类型与机理
4. 实验技能与安全
实验操作与仪器使用
实验设计与数据处理
实验安全与环境保护
5. 化学计算
物质的量与摩尔质量计算
化学反应中的定量关系与计算
6. 化学工艺流程与合成
实际生产中的化学工艺流程
有机合成与高分子合成基础
7. 综合应用
各主题的综合应用与分析解决实际问题能力。
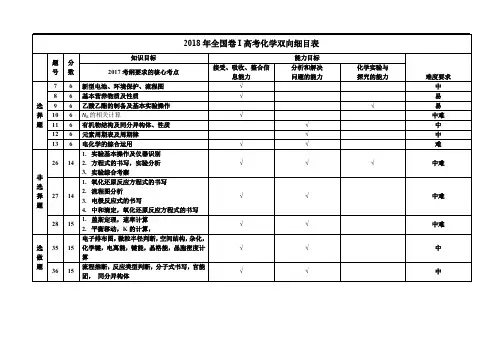
2018 年全国卷 I 高考化学双向细目表题分 号数知识目标 2017 考纲要求的核心考点接受、吸收、整合信 息能力7 6 新型电池、环境保护、流程图√8 6 基本营养物质及性质√选 9 6 乙酸乙酯的制备及基本实验操作择 10 6 NA 的相关计算√题 11 6 有机物结构及同分异构体、性质12 6 元素周期表及周期律13 6 电化学的综合运用√1. 实验基本操作及仪器识别26 14 2. 方程式的书写,实验分析√非3. 实验综合考察选1. 氧化还原反应方程式的书写择 题272. 流程图分析 14 3. 电极反应式的书写√4. 中和滴定,氧化还原反应方程式的书写1. 盖斯定理,速率计算28 15 2. 平衡移动,K 的计算,√电子排布图,微粒半径判断,空间结构,杂化,选 35 15 化学键,电离能,键能,晶格能,晶胞密度计√做算题流程推断,反应类型判断,分子式书写,官能36 15 团, 同分异构体√能力目标 分析和解决 问题的能力√ √ √ √√√ √ √化学实验与 探究的能力√√难度要求 中 易 易 中难 中 中 难中难中难中难中中2018 年全国卷Ⅱ高考化学双向细目表知识目标题分号数2017 考纲要求的核心考点接受、吸收、整合信 息能力7 6 化学与生活(漂白粉,钡餐,抗酸药)√8 6 化学与环境保护,识图选 9 6 有机物甲烷的取代反应择 10 6 元素周期表及周期律,化学键√题 11 6 NA 的相关计算12 6 电化学的综合运用实验综合考察(溶液的配置,气体纯化,探究13 6 速率,维生素 C 的还原性检验)√锌元素1. 方程式的书写,流程图分析。
26 14 2. 离子方程式书写√非3. 电化学,电极反应式的书写选择 题271. 盖斯定理,平衡移动,K 的计算 14 2. 看表格整合知识,识图,速率,平衡常数√1. 氧化还原方程式,2. 实验操作28 15 3. 物质检验(Fe2O3)√4. 中和滴定(终点判断,计算)电子排布图,电子轮廓图,价层电子对互斥理选 35 15 论,分子的性质,空间结构,杂化,化学键,√做电离能,晶胞密度计算题流程推断,反应类型判断,分子式书写,官能36 15 团, 核磁共振氢谱,同分异构体√能力目标 分析和解决 问题的能力√√ √ √√√√√ √化学实验与 探究的能力√ √√难度要求易 中 易 中难 中 中难 难中难中难中难中 中2018 年全国卷Ⅲ高考化学双向细目表知识目标题分号数2017 考纲要求的核心考点接受、吸收、整合信 息能力7 6 化学与生活,环保,蛋白质,√8 6 质子数,中子数,化学键,原子个数的计算选 9 6 有机物的性质√择 10 6 实验操作√题 11 6 电化学的综合运用12 6 滴定曲线图13 6 元素周期表及周期律√1. 实验操作26 14 2. 溶液的配置√3. 中和滴定,纯度计算非1. 名称书写选 择272. 氯气性质,氧化还原反应 14 3. 电极反应式的书写√题4. 电池具体分析1. 反应方程式书写2. 盖斯定律计算28 15 3. 转化率计算,平衡常数,平衡移动,图像√分析电子排布式,第一电离能,价层电子对互斥理选 35 15 论,分子的性质,空间结构,杂化,化学键,√做金属的堆积方式,晶胞密度计算题流程推断,反应类型判断,分子式书写,官能36 15 团, 核磁共振氢谱√能力目标 分析和解决 问题的能力√√ √ √ √√√√ √化学实验与 探究的能力√ √√难度要求易 中 易 中难 中 难 中难 中难中难中难中中高考一、 考试中途应饮葡萄糖水赠送以下资料 考试知识点技巧大全大脑是记忆的场所,脑中有数亿个神经细胞在不停地进行着繁重的活动,大脑细胞活动需要大量能量。
(原创2023)化学高考双向细目表一、无机化学1. 元素和化合物- 1.1 元素周期表- 1.2 常见元素的性质和应用- 1.3 水和溶液中的离子反应- 1.4 化合物的命名和化学式2. 化学反应- 2.1 燃烧反应- 2.2 氧化还原反应- 2.3 酸碱中和反应- 2.4 沉淀反应- 2.5 气体生成和反应3. 化学原理- 3.1 序列化反应和电位差- 3.2 动态平衡和平衡常数- 3.3 反应速率和速率常数- 3.4 催化剂和化学反应速率二、有机化学1. 有机化合物- 1.1 碳的特性和共价键- 1.2 烃类化合物- 1.3 醇、酚、醚类化合物- 1.4 醛、酮、羧酸类化合物- 1.5 氨基酸和蛋白质2. 有机反应- 2.1 烃类的燃烧反应- 2.2 单官能团化合物的反应- 2.3 多官能团化合物的反应- 2.4 聚合反应和聚合物的合成- 2.5 脂肪酸和酯的反应3. 有机化学原理- 3.1 反应机理和反应路径- 3.2 功能团和化学性质- 3.3 离子和自由基反应- 3.4 共轭系统和共轭反应三、化学实验1. 基本实验操作- 1.1 实验室安全和实验室常识- 1.2 仪器使用和实验操作技巧- 1.3 实验记录和数据处理2. 实验现象和解释- 2.1 气体生成与气体收集- 2.2 溶液中的颜色变化- 2.3 岩石和矿石的检验- 2.4 酸碱中和和中和滴定- 2.5 电解质的电导性实验3. 实验设计和控制变量- 3.1 实验变量和实验因素- 3.2 实验设计和实验步骤- 3.3 实验结果的误差和精度- 3.4 实验报告的撰写和结论以上为高考化学学科的双向细目表,其中包含了无机化学、有机化学和化学实验三个部分的细分内容。
学生可以根据这份细目表来进行有针对性的学习和复习,以便在高考中取得好成绩。
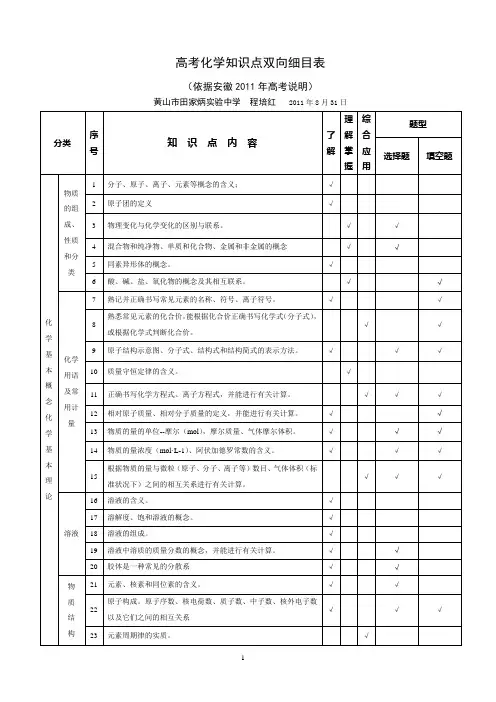
高考化学知识点双向细目表(依据安徽 2011 年高考说明)黄山市田家炳实验中学程培红2011年 8月 31日理综题型分类序知识点内容了解合号解掌应填空题选择题握用物质1 分子、原子、离子、元素等概念的含义;√的组2 原子团的定义√成、3 物理变化与化学变化的区别与联系。
√√性质4 混合物和纯净物、单质和化合物、金属和非金属的概念√√和分类5 同素异形体的概念。
√6 酸、碱、盐、氧化物的概念及其相互联系。
√√7 熟记并正确书写常见元素的名称、符号、离子符号。
√√化熟悉常见元素的化合价。
能根据化合价正确书写化学式(分子式),8 √√或根据化学式判断化合价。
学基9 原子结构示意图、分子式、结构式和结构简式的表示方法。
√√√化学本用语概及常念用计化量学基本理论溶液物质结构10 质量守恒定律的含义。
√11 正确书写化学方程式、离子方程式,并能进行有关计算。
√√√12 相对原子质量、相对分子质量的定义,并能进行有关计算。
√√13 物质的量的单位 -- 摩尔( mol ),摩尔质量、气体摩尔体积。
√√√14 物质的量浓度( mol·L-1 )、阿伏加德罗常数的含义。
√√√根据物质的量与微粒(原子、分子、离子等)数目、气体体积(标15准状况下)之间的相互关系进行有关计算。
√√√16 溶液的含义。
√17 溶解度、饱和溶液的概念。
√18 溶液的组成。
√19 溶液中溶质的质量分数的概念,并能进行有关计算。
√√20 胶体是一种常见的分散系√√21 元素、核素和同位素的含义。
√√原子构成。
原子序数、核电荷数、质子数、中子数、核外电子数√√√22以及它们之间的相互关系23 元素周期律的实质。
√和 24 元素周期表 ( 长式 )的结构 (周期、族 ) 及其应用。
√√元以第 3 周期为例,掌握同一周期内元素性质的递变规律与原子结25素构的关系√√周以 I A 和Ⅶ A 族为例,掌握同一主族内元素性质递变规律与原期26子结构的关系。
√√律27 金属、非金属在元素周期表中的位置及其性质递变规律。
√ √ 28 化学键的定义。
离子键、共价键的的形成。
√ √29 氧化还原反应的本质是电子转移。
√30氧化还原反应的有关知识 ( 氧化反应与还原反应、 反应方程式的配平、物质的氧化性与还原性的强弱比较等)。
√√√31 化学反应中能量转化的原因,能说出常见的能量转化形式。
√ 化学 32 化学能与热能的相互转化。
吸热反应、 放热反应、 反应热等概念。
√反应 33 热化学方程式的含义, 能用盖斯定律进行有关反应热的简单计算。
√√与能能源是人类生存和社会发展的重要基础。
化学在解决能源危机中√√量34的重要作用。
35 原电池和电解池的工作原理。
常见电源的种类及其工作原理。
√√36 写出电极反应和电池反应方程式。
√√√金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的37措施。
√38 化学反应速率的概念、反应速率的定量表示方法。
√ √39 催化剂在生产、生活和科学研究领域中的重大应用。
√ 化学40 化学反应的可逆性。
√反应速率 41 化学平衡的建立过程。
√√和 42 化学平衡常数的含义,能够用化学平衡常数进行简单计算。
√√化学43外界条件 ( 浓度、温度、压强、催化剂等 )对反应速率和化学平衡√√的影响,认识其一般规律。
平衡化学反应速率和化学平衡的调控在生活、生产和科学研究领域中 √44的重要作用。
√45 电解质的概念、强电解质和弱电解质的概念。
√ 电 46 电解质在水溶液中的电离,以及电解质的导电性。
√解 47 弱电解质在水溶液中的电离平衡。
√ √ 质 48 了解水的电离,离子积常数。
√ √溶 49 溶液 pH 的定义。
能进行 pH 的简单计算。
√√液50盐类水解的原理 ( 弱酸弱碱盐的消解不作要求 )、影响盐类水解程√√√度的主要因素、盐类水解的应用。
常见常金属见元素无机物常见及非金其属元应素用常见有机物及其应用化学实验51 离子反应的概念、离子反应发生的条件。
常见离子的检验。
√√52 难溶电解质的沉淀溶解平衡及沉淀转化的本质(不要求计算 )。
√√以上各部分知识的综合应用√(如 Na、 Al 、 Fe、 Cu)53 常见金属的活动性顺序。
√54 常见金属及其重要化合物的主要性质及其应用。
√√55 合金的概念及其重要应用。
√√如 H 、C、 N 、O、Si 、S、Cl 等 )56 常见非金属元素单质及其重要化合物的主要性质及其应用。
√√57 常见非金属元素单质及其重要化合物对环境质量的影响。
√√以上各部分知识的综合应用√58 有机化合物中碳的成键特征。
√59 甲烷、乙烯、苯等有机化合物的主要性质及其重要应用。
√√60 乙醇、乙酸的组成和主要性质及其重要应用。
√√61 糖类、油脂、蛋白质的组成和主要性质及其重要应用。
√62 常见高分子材料的合成反应及其重要应用。
√以上各部分知识的综合应用√63 化学实验室常用仪器的主要用途和使用方法。
√64 化学实验的基本操作。
√65 能识别化学品安全使用标识、实验室一般事故的预防和处理方法。
√√66常见气体的实验室制法 (包括所用试剂、仪器、反应原理和收集方法) 。
√√67 对常见的物质进行检验、分离和提纯。
√√68 一定溶质质量分数、物质的量浓度的溶液配制方法。
√√69 酸碱中和滴定的基本原理。
√√70 能根据实验试题要求,设计、评价或改进实验方案。
√√71 能根据实验试题要求,分析或处理数据,得出合理结论。
√√72 能根据实验试题要求,绘制和识别典型实验仪器装置图。
√√以上各部分知识的综合应用√有机化合物的组成与结有构机化学基础模烃及块其衍生物的性质与应用原子结构物与元质素性结质构与性化学质键分模子间块作用力与物质性质能根据有机化合物的元素含量、相对分子质量确定有机化合物的74分子式。
75常见常见有机化合物的结构。
76有机物分子中的官能团,能正确表示它们的结构。
确定有机化合物结构的化学方法和某些物理方法(不包括波谱方77法) 。
有机化合物存在同分异构现象,能判断简单有机化合物的同分异78构体 (不包括手性异构体)。
79能根据有机化合物命名规则命名简单的有机化合物。
80能列举事实说明有机分子中基团之间存在相互影响。
以烷、烯、炔和芳香烃的代表物为例,比较它们在组成、结构、81性质上的差异。
82天然气、石油液化气和汽油的主要成分及其应用。
83举例说明烃类物质在有机合成和有机化工中的重要作用。
卤代烃、醇、酚、醛、羧酸、酯的代表物的组成、结构、性质以84及它们相互联系。
85加成反应、取代反应、消去反应和聚合反应。
结合实际了解某些有机化合物对环境和健康可能产生影响,关注86有机化合物的安全使用问题。
氨基酸的组成、结构特点和主要化学性质,以及氨基酸与人体健87康的关系。
88化学科学在生命科学发展中所起的重要作用。
89原子核外电子的能级分布。
90能用电子排布式表示常见元素 (1~36 号)原子核外电子的排布。
91核外电子的运动状态。
92电离能的含义。
93同一周期、同一主族中元素电离能的变化规律。
94电负性的概念。
95知道元素性质与电负性的关系。
96共价键的主要类型 (σ键和π键 )。
97能用键能、键长、键角等说明简单分子的某些性质。
98极性键和非极性键。
分子晶体、原子晶体、离子晶体和金属晶体的结构微粒及微粒间99作用力的区别。
√√√√√√√√√√√√√√√√√√√√√√√√√√√√√√√√√√√√√√√√√√。