丙型肝炎病毒核心抗原检测的临床价值
- 格式:doc
- 大小:169.00 KB
- 文档页数:4


·论著·丙型肝炎病毒RNA与核心抗原的相关性及其临床意义张怡青王洁常静霞汪茂荣【摘要】目的探讨丙型肝炎患者丙型肝炎病毒(HCV)RNA与HCV核心抗原(HCV cAg)的相关性及其临床意义。
方法收集南京中医药大学附属八一医院全军肝病中心就诊的652例丙型肝炎患者血清,分别检测其HCV RNA和HCV cAg,分析二者间以及与丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆红素(TBil)、直接胆红素(DBil)以及γ-谷氨酰转移酶(GGT)各项生化指标的相关性。
结果丙型肝炎患者HCV RNA和HCV cAg阳性率分别为30.2%和39.4%,HCV cAg阳性和阴性患者HCV RNA阳性率差异有统计学意义(χ2 = 370.907、P< 0.001),HCV RNA与HCV cAg的阳性符合率(即HCV RNA阳性患者中HCV cAg阳性的比率)为95.4%,阴性符合率为84.8%,总符合率(即HCV RNA与HCV cAg同时阳性或同时阴性的患者占比)为88.0%。
若以HCV RNA水平为金标准作ROC曲线,HCV cAg的曲线下面积(AUC)为0.968,95%置信区间(CI)为0.948~0.988。
HCV RNA与HCVcAg检测值显著相关(r = 0.629、P< 0.001)。
肝功能正常和异常丙型肝炎患者HCV RNA和HCV cAg阳性率差异均有统计学意义(χ2 = 140.435、89.507,P< 0.001)。
HCV RNA和HCV cAg阳性时,ALT、AST、TBil、DBil和GGT与HCV RNA和HCV cAg检测值均不相关。
77例患者在接受干扰素加利巴韦林抗病毒治疗前HCV RNA与HCV cAg均为阳性,抗病毒治疗过程中HCV RNA与HCV cAg阴转时机不完全同步,大多数患者[88.7%(68/77)]治疗过程中HCV RNA阴转早于HCV cAg,少数患者[11.3%(9/77)]HCV cAg阴转早于HCV RNA。



丙型肝炎病毒核心抗原检测技术国内外临床研究应用情况(综述)张贺秋丙型肝炎是由丙型肝炎病毒(hepatitis C virus, HCV)感染引起的一种重要的世界性传染病。
一般地,15~20%左右的HCV感染者为自限性感染,可以很快的康复。
但是,也有80~85%的感染者发展为慢性丙型肝炎,其中又有20%的可发展为肝纤维化,最终有4~5%的肝纤维化患者发生肝细胞性肝癌,危害十分严重。
目前,慢性丙型肝炎除了干扰素有确切的疗效外,尚无其它有效的治疗药物。
国际上近来报道,PEG修饰的干扰素加利巴韦林联合治疗可在40~50%左右的患者获得较好的反应,但也有疗程长、价格昂贵、毒副作用大以及易反弹等缺点。
此外,丙型肝炎疫苗的研制也因HCV高度变异而困难重重,短期内难有突破性进展。
因此,尽早检出HCV感染者,阻断HCV的传播是当务之急。
1 HCV检测技术的现状HCV一般通过被HCV污染的血液和血液制品传播,现在常用的HCV检测技术有两种方式:(1)间接检测,主要检测抗HCV抗体;(2)直接检测,通过定性或定量检测HCV病毒粒子的组成成分确定病毒的存在,例如HCV RNA。
这两种检测方式在确诊HCV感染,选择HCV感染者的治疗方案以及评价抗HCV 治疗的疗效方面起到了关键作用。
1.1 抗HCV抗体的检测上世纪九十年代初,利用重组HCV抗原开发出了抗HCV抗体检测技术,即酶免疫分析(enzyme immunoassays, EIAs)技术,已经发展到第三代。
该技术可检测样本中针对不同HCV抗原(如C区、NS3区、NS4区和NS5区等)的混合抗体,目前检测的特异性已高达99%以上。
由于缺乏更敏感的金标准,抗HCV EIA技术的敏感性还很难确定。
在免疫健全的患者中,抗HCV EIA的检测敏感性高于99%,几乎所有的HCV感染者都可以被检测出来。
但对于正进行血液透析的患者和严重免疫缺损患者,虽然其体内有HCV复制活跃,但EIA检测可能就是阴性结果。


丙型肝炎的病毒学检测指标及其临床意义摘要】:目的分析探讨丙型肝炎的病毒学检测指标及其临床意义。
方法选取我院2018年3月~2019年8月收治的90例丙型肝炎患者作为研究对象,采集其血液样本进行丙型肝炎病毒抗体(HCV)联合核酸检测(HCV-RNA),对其检测结果进行分析探讨。
结果 90例样本联合应用HCV抗体与HCV-RNA检测后,检测为阳性7例,联合检测的阳性率为7.8%(7/90),单独HCV抗体检测阳性率为7.8%(7/90),单独HCV-RNA抗体筛查阴性标本未检测出阳性标本,差异有统计学意义(P<0.05)。
结论在血液筛查中采用HCV抗体筛查联合HCV-RNA检测能够提高丙型肝炎病毒抗体筛查效果,有助于尽早发现输血相关传染病,降低输血风险。
【关键词】:血液筛查;丙型肝炎病毒抗体检测;核酸检测;联合应用Virological detection of hepatitis c and its clinical significance[abstract] : objective to analyze the virological detection index and its clinical significance of hepatitis c.Methods 90 cases of hepatitis c patients admitted to our hospital from march, 2018 to August, 2019 were selected as the research object, and their blood samples were collected for hepatitis c virus antibody (HCV) and nucleic acid detection (hcv-rna), and the test results were analyzed and discussed.Results after the combined HCV antibody and hcv-rna detection in 90 cases, 7 cases were positive, the positive rate of the combined detection was 7.8%(7/90), and the positive rate of HCV antibody alone was 7.8%(7/90). Hcv-rna antibody alone did not detect positive samples in the negative samples, the difference was statistically significant(P<0.05).Conclusion HCV antibody screening combined with hcv-rna detection in blood screening can improve the screening effect of hepatitis c virus antibody, which is helpful to detect transfusion-related infectious diseases as soon as possible and reduce the risk of blood transfusion.【 key words 】 : blood screening;Detection of hepatitis c virus antibody;Nucleic acid testing;The joint application丙型肝炎为我国常见传染性疾病,其主要传播途径为体液或血液。


丙肝病毒核心抗原的检测与R N A 定量和谷丙转氨酶的相关性及临床意义侯莉莉1,万㊀红1,林㊀源2,刘振聪1,程㊀杨1(1.齐齐哈尔市第一医院检验科,黑龙江齐齐哈尔161000;2.齐齐哈尔医学院附属第三医院皮肤科,黑龙江齐齐哈尔161000)D O I :10.11748/b j m y .i s s n .1006-1703.2021.04.027收稿日期:2021G02G21;修回日期:2021G03G08基金项目:齐齐哈尔市科技计划创新激励项目(丙肝病毒核心抗原的检测与丙肝病毒R N A 定量检测的相关性研究)(编号:C S F G G G2020063)作者简介:侯莉莉(1985 ),女,硕士,副主任技师.研究方向:免疫㊁分子生物学.摘要:目的㊀探索丙肝病毒核心抗原(H C V Gc A g )与R N A 定量及谷丙转氨酶(A L T )的相关性,以指导临床应用.方法检测本院98例疑似丙型病毒性肝炎患者血清中H C V Gc A g ㊁R N A 定量及A L T 水平,评估检测结果的准确性及相关性.结果㊀所有疑似患者血清中检测到H C V GR N A 的患者87.76%(86/98),检测到H C V Gc A g 患者有82.65%(81/98),P >0.05.相对于H C V GR N A 检测,H C V Gc A g 检测的灵敏度为94.19%.所有检测到H C V Gc A g 患者的血清中均能检测到R N A ,H C V Gc A g 检测的特异性为100%.当病毒载量大于1.0ˑ103I U /m L 时,H C V GR N A 定量与H C V Gc A g 水平高度正相关,r =0.93,P <0.0001.H C V GR N A 定量或H C V Gc A g 水平分别与AL T 水平高度正相关,r 值分别为0.83㊁0.80,P <0.0001.结论㊀H C V Gc A g 或H C V GR N A 水平对于诊断丙型肝炎有相似诊断价值.H C V Gc A g 检测特异性高,灵敏度不及H C V GR N A .当病毒载量高时,H C V GR N A 及H C V Gc A g 水平高度正相关,且分别与A L T 水平均有高度正相关性.关键词:丙型肝炎病毒;㊀丙肝病毒核心抗原;㊀丙肝病毒核酸定量;㊀谷丙转氨酶中图分类号:R 512.6+3㊀㊀文献标识码:AT h eC o r r e l a t i o na n dC l i n i c a l S i gn i f i c a n c e o fD e t e c t i o no fC o r e A n t i g e no fH e pa t i t i sCV i r u sw i t hR N A Q u a n t i f i c a t i o na n d G l u t a m i cP yr u v i cT r a n s a m i n a s e H O U L i l i 1,WA N H o n g 1,L I N Y u a n 2,L I U Z h e n c o n g 1,C H E N G Y a n g1(1.D e p a r t m e n t o fC l i n i c a l L a b o r a t o r y ,Q i q i h a rF i r s tH o s p i t a l ,Q i qi h a r 161000,C h i n a ;2.D e p a r t m e n t o fD e r m a t o l o g y ,t h eT h i r dA f f i l i a t e dH o s p i t a l o fQ i q i h a rM e d i c a l C o l l e g e ,Q i qi h a r 161000,C h i n a )A b s t r a c t :O b j e c t i v e T oe x p l o r e t h e c o r r e l a t i o nb e t w e e nH C Vc o r e a n t i g e n (H C V Gc A g),H C V GR N At e s t a n d a l a n i n e a m i n o t r a n s f e r a s e (A L T ),s oa s t o g u i d ec l i n i c a l a p p l i c a t i o n s .M e t h o d s H C V Gc A g,R N Aa n d A L T l e v e l s i n 98s u s p e c t e d p a t i e n t sw i t h v i r a l h e p a t i t i s C i n o u r h o s pi t a l w e r e d e t e c t e d ,a n d t h e c o r r e l a t i o n o f t h e t e s t v a l u e sw a s e v a l u a t e d .R e s u l t s H C V GR N Aw a s d e t e c t e d i n 87.76%(86/98)o f s a m p l e s a n dH C V Gc A g i n 82.65%(81/98)o fs a m p l e s .C o n s i d e r i n g t h e H C V GR N A t e s ta sa g o l ds t a n d a r d ,t h es e n s i t i v i t y an d s p e c i f i c i t y o fH C V Gc A g t e s tw e r e s h o w n t ob e 94.19%a n d 100%,r e s p e c t i v e l y .Ah i gh l e v e l o f c o r r e l a t i o n w a s s e e nb e t w e e nH C V GR N Aa n dH C V Gc A g t e s t a m o n g t h o s e p a t i e n t sw i t hv i r a l l o a d sh i gh e r t h a n 1.0ˑ103I U /m L (r =0.93,P <0.0001).H C V GR N A q u a n t i t a t i o no r H C V Gc A g l e v e lw e r eh i g h l yp o s i t i v e l yc o r r e l a t e dw i t hA L T l e v e l ,w i t h r v a l u e s o f 0.83a nd 0.80,re s p e c t i v e l y (P <0.0001).C o n c l u s i o n :H C V Gc A g o rH C V GR N At e s t h a v e s i m i l a rd i a g n o s t i cv a l u e i n t h ed i a g n o s i s o fh e p a t i t i sC .H C V Gc A g d e t e c t i o nh a s a h i g h s p e c if i c i t y a n dl o w e r s e n s i t i v i t y t h a n H C V GR N A .B o t h H C V GR N Aa n d H C V Gc Ag l e v e l sa r ehi g h l y p o s i t i v e l y co r r e l a t e dw i t hA L T l e v e l s .K e y w o r d s :H e p a t i t i s Cv i r u s ;㊀H C Vc o r e a n t i ge n ;㊀H C V GR N A r e a l t i m e P C R ;㊀A l a n i n e a m i n o t r a n sf e r a s e 656L a b e l e d I mm u n o a s s a y s&C l i n M e d ,A pr .2021,V o l .28,N o .4㊀㊀1970年发现了非甲型非乙型病毒性肝炎,1989年在非甲㊁非乙型肝炎患者中使用分子克隆技术检测出丙型肝炎病毒(h e p a t i t i sCv i r u s,H C V).这一发现使H C V成为检测指标,降低了输血后丙型肝炎的发生率[1].2020年诺贝尔生理学或医学奖授予H A R V E YJA L T E R㊁M I C H A E L HO U G H T O N和C HA R L E S M R I C E,以表彰他们发现了H C V[2].据统计,全球约有1.85亿丙型肝炎病毒感染者,其中慢性感染者约1.3~1.7亿[3],潜伏期约1~2周,感染后大都无明显临床症状,感染2周后在血清中方能被检测出R N A从而诊断急性丙型病毒性肝炎,而病毒抗体需更长时间方能检测到,若持续感染12~24周则演变为慢性丙型病毒性肝炎.慢性丙型肝炎是慢性肝病的重要病因之一,易导致肝硬化和肝细胞癌的发生[4].临床中术前㊁输血前我们常用抗GH C V检测结果排除丙型肝炎病毒感染,但有研究发现,检测术前及输血前患者H C VGR N A可提高检测的准确性并缩短检测的窗口期,他们发现,10173例样本中共57例患者抗GH C V与H C VGR N A检测结果不一致,其中7例患者抗GH C V阴性而H C VGR N A阳性则被漏诊[5].因此寻找早期正确诊断丙型肝炎病毒感染的方法具有重要意义.H C VGR N A 被认为是金标准,但对人员设备要求较高,部分研究通过检测H C V核心抗原(c A g)来早期诊断H C V感染并指导抗病毒治疗[6],本研究拟评估H C VGc A g 检测的准确性及与H C VGR N A或丙氨酸转移酶(a l a n i n e a m i n o t r a n s f e r a s e,A L T)水平的相关性.材料和方法㊀㊀1㊀一般资料㊀㊀选择本院2019年1月至2020年12月在本院疑似丙型病毒性肝炎患者98例作为研究对象,其中男性63例,女性35例,年龄19~81岁,平均年龄53.1ʃ8.4岁.采集患者空腹血3管,标记好患者基本信息,分别作H C VGR N A㊁H C VGc A g及A L T检测.㊀㊀纳入标准:①诊断符合2019版丙型肝炎防治指南[7],抗GH C V阳性;②年龄ȡ18岁,有完全民事行为能力并签署伦理委员会批准的知情同意书;③入组前3个月未曾抗病毒治疗者.㊀㊀排除标准:①肝硬化或肝细胞癌患者;②甲㊁乙㊁戊型病毒性肝炎者;③合并精神疾病并无完全民事行为能力者;④合并其他恶性肿瘤或自身免疫性疾病患者.㊀㊀2㊀方法㊀㊀2.1㊀H C VGc A g检测㊀血清H C VGc A g的定量检测,采用新一代H C VGc A g检测试剂盒(C M I A) (A r c h i t e c tH C V核心抗原试剂盒,雅培诊断,美国),严格按照试剂盒说明书操作,检测值范围3.00~20000f m o l/L.㊀㊀2.2㊀H C VGR N A检测㊀H C VGR N A检测试剂盒购自上海科华生物工程股份有限公司(国药准字S20040063).实时定量P C R仪(C O B A SA m p l i P r e p/ C O B A ST a q M a n,德国).提取R N A后进行实时定量P C R检测R N A水平,所有操作严格按照试剂盒及仪器操作说明进行.㊀㊀2.3㊀A L T检测㊀抽清晨空腹血3m L,3000r/ m i n离心5m i n,分离出的血清使用贝克曼库尔特A U5800全自动生化分析仪及其配套试剂(A U Z6540)检测A L T.操作严格按试剂及仪器说明书进行,A L T参考范围为0~40U/L.㊀㊀3㊀统计学处理㊀㊀采用G r a p h P a dP r i s m8软件进行数据分析及作图,计量资料采用均数ʃ标准差表示,计数资料用率表示,采用卡方检验和F i s h e r精确概率法检验,相关分析采用直线性相关分析,计算P e a r s o n积差相关系数,以P<0.05为差异有统计学意义.结㊀㊀果㊀㊀1㊀H C VGR N A和H C VGc A g检测结果评价㊀㊀所有纳入研究患者中检测到H C VGR N A的患者87.76%(86/98),检测到H C VGc A g患者有82.65%(81/98),采用卡方检验,χ2=1.01,P=0.3,差异无统计学意义.H C VGc A g灵敏度94.19%.其中H C VGR N A定量大于1.0ˑ103I U/m L患者77.55%(76/98),均检测到H C VGc A g.但H C VGR N A定量小于1.0ˑ103I U/m L的10.2%(10/98)患者血清中未检测到H C VGc A g.所有检测到H C VGc A g患者血清中均能检测到R N A,H C VGc A g 特异性㊁阳性预测值均为100%.㊀㊀2㊀H C VGc A g与H C VGR N A水平的相关性㊀㊀对如上H C VGR N A定量大于1.0ˑ103I U/m L 患者的H C VGc A g与H C VGR N A检测值的对数值进行相关性分析,结果显示H C VGc A g与H C VGR N A水平呈显著正相关性,r=0.93,P<0.0001.见图1.756标记免疫分析与临床㊀2021年4月第28卷第4期图1㊀H C V Gc A g 与H CV R N A 水平的相关性分析㊀㊀3㊀H C VR N A 定量与A L T 水平的相关性㊀㊀分析H C V GR N A 定量大于1.0ˑ103I U /m L 的76例患者的A L T 水平与R N A 水平的关系,取R N A 值的对数值与A L T 水平进行相关性分析,结果显示H C V GR N A 值与A L T 水平呈显著相关性,r =0.83,P <0.0001.见图2.图2㊀H C V R N A 定量与A L T 值的相关性分析㊀㊀4㊀H C V Gc A g 与AL T 水平的相关性㊀㊀检测76例H C V Gc A g 阳性患者的A L T 水平,取H C V Gc A g 的对数值与A L T 水平进行相关性分析,结果显示H C V Gc A g 值与A L T 水平呈显著正相关性,r =0.80,P <0.0001.见图3.图3㊀H C V Gc A g 与AL T 检测值的相关性分析讨㊀㊀论㊀㊀丙型病毒性肝炎是因感染H C V 而导致的乙类传染病.目前我国主要流行的丙肝病毒基因型有1型㊁2型㊁3型和6型;其亚型有1a 亚型㊁1b 亚型㊁2a亚型㊁3a 亚型㊁3b 亚型和6a 亚型[3].感染急性期症状轻微,约45%感染者能自行清除病毒,感染病毒后大都无明显症状,或仅表现疲乏㊁食欲减退等,因此患者得不到及时治疗,病毒持续感染6个月则发展为慢性丙型肝炎,约55%~85%感染者转为慢性感染,最后可能发展为肝硬化㊁肝癌[7].世界卫生组织提出到2030年消除病毒性肝炎作为公共卫生威胁的目标,使新发感染率降低到90%,病死率降低到65%,使确诊率达到90%,治疗率达到80%.中国病毒性肝炎防治规划中提出,将丙型肝炎纳入体检范畴,对抗GH C V 阳性患者必须进一步检查以确诊,对确诊患者提供抗病毒治疗,到2020年实现血站H C V 检测率100%,以减少输血传播的丙型肝炎的发生[7].因此寻找早期及准确的H C V 检测方法对早期诊断㊁指导治疗具有重要意义.㊀㊀当前大部分医院通过抗GH C V 筛查H C V 感染情况,然而急性H C V 感染者出现临床症状时,仅50%~70%抗GH C V 阳性,感染3个月后90%感染者表现抗GH C V 阳性,病毒清除后仍持续阳性[7],显然抗GH C V 检测可能导致早期漏诊,不能准确反映病毒载量.而感染H C V 1~2周在患者血清中就能检测出H C V GR N A ,有学者提出H C V GR N A 是检测H C V 的金标准,H C V GR N A 水平与肝损程度有相关性[8G9].C E T I N E R 等[9]用化学发光微粒子免疫法(C M I A )及酶联免疫(E L I S A )两种方法检测了132例样本的H C V Gc A g,发现当病毒载量大于103I U /m L ,H C V Gc A g 水平与H CV GR N A 水平存在高度相关性,但当病毒载量小于103I U /m L ,H C V Gc A g 水平与H C VR N A 水平相关性明显降低.有研究提出H C V Gc A g 定量检测在诊断H CV 活动性感染方面具有非常高的灵敏度和特异性.H C V Gc A g 和H C V GR N A 定量检测具有高度相关性,99%的H C V Gc A g 阳性患者可不需要再进行H CV GR N A 检测即可诊断H C V 感染[6,10],体现了H C V Gc A g 检测价值.这与本研究结果一致,我们发现所有疑似丙型肝炎患者血清中检测到H C V GR N A 的阳性率87.76%,H C V Gc A g 阳性率82.65%,P >0.05,两种检测方法的结果差异无统计学意义.H C V Gc A g 检测的灵敏度为94.19%,其中77.55%患者血清中检856L a b e l e d I mm u n o a s s a y s&C l i n M e d ,A pr .2021,V o l .28,N o .4测到H C VGc A g及H C VGR N A定量大于1.0ˑ103I U/m L,这些患者的H C VGR N A水平与H C VGc A g 水平有高度相关性,r=0.93,P<0.0001.且有研究[11]发现,H C VGc A g和H C VGR N A水平抗病毒治疗前和治疗1天后呈正相关.在治疗阶段,H C VGc A g的平均水平下降速度快于H C VGR N A水平.治疗第4周,24例H C VGR N A已检测不到,而28例H C VGc A g也检测不到.在治疗结束和随访12周治愈后,所有患者均检测不到H C VGR N A和H C VGc A g.检测H C VGc A g不仅能早期诊断,甚至可以辅助监测抗病毒治疗效果.因此我们认为H C VGR N A 和H C VGc A g有相似的检测价值,可作为诊断治疗的依据和治疗效果的监测指标.㊀㊀有研究[10]认为,H C VGR N A出现1~2d后,外周血中便能检测出H C VGc A g,检测出的H C VGc A g 水平与H C VGR N A定量相关性较好,可作为检测H C V复制的标志物.本研究10.2%H C VGR N A定量小于1.0ˑ103I U/m L的患者血清中未检测到H C VGc A g,H C VGc A g检测的灵敏度比H C VGR N A 低,可能正是因为H C VGc A g比R N A晚出现1~2d.但所有检测到H C VGc A g患者血清中均能检测到R N A,H C VGc A g检测特异性高.H C VGR N A检测耗时较长㊁费用较高,而且检测准确性与检测人员技术熟练程度和检测设备有关.因此如果能找到检测准确㊁迅速㊁操作简单而且费用较低的检测指标以替代H C VGR N A检测,则将更有利于H C V抗病毒治疗的广泛开展.尤其是在医疗资源不足的地区,使用快速检测方法尤为重要[12].有学者[13]认为, H C VGc A g检测和量化是诊断1b型H C V感染的一种有价值的替代H C VGR N A检测方法,他们认为H C VGc A g可作为早期检测指标支持H C V感染诊断,也可反映病毒复制水平.他们还认为1b基因型的H C VGc A g和H C VGR N A之间可能存在相关性.病毒基因型检测可以辅助诊断,指导治疗,需要后期更多的相关研究探索.因此我们认为当病毒载量高时,H C VGc A g与R N A检测对诊断H C V感染具有相同的价值,临床可以采用H C VGc A g检测明确诊断.若H C VGc A g阴性可进一步作R N A检测来明确诊断.㊀㊀A L T明显升高见于急慢性肝损伤,如急慢性病毒性肝炎㊁慢性肝炎导致的肝硬化或肝癌并处于活动期时.A L T水平高低反映肝细胞坏死程度,提示肝功能损害的严重程度,与肝损程度呈正相关[14].本研究H C VGR N A病毒载量小于1.0ˑ103I U/m L 的22例患者的A L T水平均在正常范围,未纳入到H C VGR N A水平或H C VGc A g水平与A L T关系研究中.本研究发现A L T水平与H C VGR N A或H C VGc A g水平高度相关,r值分别为0.83㊁0.80, P<0.0001.因此我们认为A L T水平与病毒载量有明显相关性,A L T检测可以辅助诊断丙型肝炎,并指导治疗.关于机制,有研究[15]发现,在H C V急性感染期间,高A L T和H C VGR N A水平与I PG10水平升高度相关,而高H C VGR N A水平也与M I PG1β水平升高相关.他们认为,I PG10和M I PG1β可能在急性H C V感染早期开始的H C V免疫发病机制中起作用.这还需要进一步探索研究.㊀㊀综上,我们认为临床采用H C VGc A g检测配合A L T的检测对诊断H C V感染具有较高的价值.H C VGc A g或H C VGR N A水平对于诊断丙型肝炎有相似诊断价值.H C VGc A g检测特异性高,灵敏度不及H C VGR N A.当病毒载量大于1.0ˑ103I U/m L 时H C VGR N A及H C VGc A g水平高度正相关,并分别与A L T水平呈高度正相关性.参考文献[1]HO U G H T O N M.H e p a t i t i s C v i r u s:30y e a r s a f t e r i t sd i s c o ve r y[J].C o l d S p r i n g H a r b P e r s p e c t M e d,2019,9(12)a037069.[2]李庆超,钟劲.分子生物学技术推进丙型肝炎病毒的发现和研究G2020年诺贝尔生理学或医学奖解读[J].自然杂志,2021,42(6):449G456.[3]马莹莹,李丽娟.我国丙型病毒性肝炎分布综述[J].昆明学院学报,2020,42(6):98G101.[4]WA N GLS,D S O U Z ALS,J A C O B S O NIM.H e p a t i t i sCGAc l i n i c a l r e v i e w[J].JM e dV i r o l,2016,88(11):1844G1855.[5]李红燕,唐曙明,李志波,等.术前及输血前H C V血清学检测与核酸检测结果不一致分析[J].临床输血与检验,2020,22(6):574G580.[6]W A S I T T H A N K A S E M R,V I C H A I W A T T A N A P,A U P H I M A I C,e t a l.H C Vc o r e a n t i g e n i s a na l t e r n a t i v em a r k e r t oH C V R N Af o re v a l u a t i ng a c t i v e H C V i n f e c t i o n:i m p l i c a t i o n sf o ri m p r o v e dd i a g n o s t i c o p t i o n i na ne r aof a f f o r d a b l eD A A s[J].P e e r J,2017,5:e4008.[7]中华医学会肝病学分会,中华医学会感染病学分会.丙型肝炎防治指南(2019版)[J].肝脏,2019,24(12):1357G1386.[8]葛玉梅,周永列,赵钊,等.丙型肝炎病毒GR N A载量与肝功能指标和血小板参数的相关性研究[J].中国卫生检验杂志,2020,30(23):2817G2820.[9]C E T I N E RS,C E T I N D U R A N A,K I B A RF,e t a l.P e r f o r m a n c ec o m p a r i s o no f n e w g e n e r a t i o n H C Vc o r ea n t i g e nt e s tv e r s u sH C VR N At e s t i nm a n a g e m e n t o f h e p a t i t i s Cv i r u s i n f e c t i o n[J].T r a n s f u sA p h e r S c i,2017,56(3):362G366.(下转第702页)956标记免疫分析与临床㊀2021年4月第28卷第4期p r o t e c t i o n[J].J I mm u n o l,2011,186(2):1022G1031.[30]K I M M C,L E EJ S,KWO N Y M,e t a l.M u l t i p l e h e t e r o l o g o u s M2e x t r a c e l l u l a r d o m a i n s p r e s e n t e d o n v i r u sGl i k e p a r t i c l e s c o n f e r b r o a d e r a n d s t r o n g e rM2i mm u n i t y t h a n l i v e i n f l u e n z aA v i r u s i n f e c t i o n.[J].A n t i v i r a lR e s,2013,99(3):328G335.[31]K I M M C,L E E Y N,K O E J,e ta l.S u p p l e m e n t a t i o no f i n f l u e n z a s p l i t v a c c i n e s w i t h c o n s e r v e d M2e c t o d o m a i n s o v e r c o m e s s t r a i n s p e c i f i c i t y a n d p r o v i d e s l o n gGt e r m c r o s s p r o t e c t i o n[J].M o lT h e r,2014,22(7):1364G1374.[32]Z E B E D E E S L,L AM B R A.I n f l u e n z a A v i r u s M2p r o t e i n: M o n o c l o n a l a n t i b o d y r e s t r i c t i o n o f v i r u s g r o w t h a n d d e t e c t i o n o f M2i nv i r i o n s[J].JV i r o l,1988,62(8):2762G2772.[33]F I L E T T E M D,R AMN E A,B I R K E T T A,e t a l.T h e u n i v e r s a l i n f l u e n z av a c c i n e M2eGH B ca d m i n i s t e r e d i n t r a n a s a l l y i n c o m b i n a t i o nw i t ht h ea d j u v a n tC T A1GD D p r o v i d e sc o m p l e t e p r o t e c t i o n[J].V a c c i n e,2006,24(5):544G551.[34]N I MM E R J A HNF.D i v e r g e n t i mm u n o g l o b u l i n G s u b c l a s s a c t i v i t y t h r o u g h s e l e c t i v e F cr e c e p t o r b i n d i n g[J].S c i e n c e,2005,310(5753):1510G1512.[35]WU F,HU A N GJH,Y U A N X Y,e t a l.C h a r a c t e r i z a t i o no f i mm u n i t y i n d u c e d b y M2e o f i n f l u e n z a v i r u s[J].V a c c i n e,2007,25(52):8868G8873.[36]J E G E R L E HN E R A,S C HM I T Z N,S T O R N I T,e t a l.I n f l u e n z aA v a c c i n eb a s e do nt h ee x t r a c e l l u l a rd o m a i no f M2:w e a k p r o t e c t i o n m e d i a t e d v i a a n t i b o d yGd e p e n d e n t N K c e l l a c t i v i t y[J].J I mm u n o l,2004,172(9):5598G5605.[37]F U T M,F R E E DDC,HO R T O N MS,e t a l.C h a r a c t e r i z a t i o n s o f f o u rm o n o c l o n a l a n t i b o d i e s a g a i n s tM2p r o t e i ne c t o d o m a i no f i n f l u e n z aAv i r u s[J].V i r o l o g y,2009,385(1):218G226.[38]S I MH A D R IV R,D I M I T R O V A M,MA R I A N OJL,e t a l.A h u m a n a n t iGM2a n t i b o d y m e d i a t e s a n t i b o d yGd e p e n d e n t c e l lGm e d i a t e dc y t o t o x i c i t y(A D C C)a n d c y t o k i n e s e c r e t i o nb y r e s t i n g a n dc y t o k i n eGp r e a c t i v a t e dn a t u r a lk i l l e r(N K)c e l l s[J].P L o SO n e,2015,10(4):e0124677.[39]H I R S C H RL,W I N K E L S T E I NJA,G R I F F I NDE.T h e r o l e o f c o m p l e m e n t i nv i r a l i n f e c t i o n s.I I I.A c t i v a t i o no f t h e c l a s s i c a l a n da l t e r n a t i v ec o m p l e m e n t p a t h w a y sb y S i n d b i sv i r u s[J].J I mm u n o l,1980,124(5):2507G2510.[40]B E E B EDP,S C H R E I B E RRD,C O O P E RNR.N e u t r a l i z a t i o n o f i n f l u e n z a v i r u s b y n o r m a l h u m a n s e r a:m e c h a n i s m si n v o l v i n g a n t i b o d y a n d c o m p l e m e n t[J].J I m m u n o l,1983,130(3):1317G1322.[41]WA N GR,S O N GA,L E V I NJ,e t a l.T h e r a p e u t i c p o t e n t i a l o f a f u l l y h u m a nm o n o c l o n a l a n t i b o d y a g a i n s t i n f l u e n z aAv i r u sM2p r o t e i n[J].A n t i v i r a lR e s,2008,80(2):168G177.[42]K I M YJ,K I M K H,K O EJ,e t a l.C o m p l e m e n tC3p l a y sa k e y r o l e i n i n d u c i n g h u m o r a l a n dc e l l u l a r i mm u n e r e s p o n s e s t o i n f l u e n z a v i r u s s t r a i nGs p e c i f i c h e m a g g l u t i n i nGb a s e d o r c r o s sGp r o t e c t i v e M2e x t r a c e l l u l a rd o m a i nGb a s e d v a c c i n a t i o n[J].J V i r o l,2018,92(20):e00969G18.[43]D O H E R T YPC,T O P H AM DJ,T R I P PR A,e t a l.E f f e c t o rC D4+a n dC D8+TGc e l lm e c h a n i s m s i nt h ec o n t r o lo f r e s p i r a t o r y v i r u s i n f e c t i o n s[J].I m m u n o l R e v,1997,159:105G117.[44]E L I A S S O NDG,B A K K O U R I KE,S C H NK,e t a l.C T A1GM2eGD D:A n o v e l m u c o s a la d j u v a n tt a r g e t e di n f l u e n z a v a c c i n e[J].V a c c i n e,2008,26(9):1243G1252.[45]Z HA N G J,F A N H Y,Z H A N G Z,e t a l.R e c o m b i n a n t b a c u l o v i r u s v a c c i n e c o n t a i n i n g m u l t i p l e M2ea n da d j u v a n tL T B i n d u c e sTc e l l d e p e n d e n t,c r o s sGc l a d e p r o t e c t i o na g a i n s tH5N1i n f l u e n z av i r u s i nm i c e[J].V a c c i n e,2016,34(5):626G629.[46]T U R L E Y C B,R U P P R E,J O HN S O N C,e ta l.S a f e t y a n d i mm u n o g e n i c i t y o far e c o m b i n a n t M2e–f l a g e l l i ni n f l u e n z a v a c c i n e(S T F2.4x M2e)i nh e a l t h y a d u l t s[J].V a c c i n e,2011,29(32):5145G5152.[47]L I U WA N L I,Z O U P E N G,C H E N Y I N G HU A.M o n o c l o n a l a n t i b o d i e s r e c o g n i z i n g E V E T P I R Ne p i t o p eo f i n f l u e n z aAv i r u sM2p r o t e i nc o u l d p r o t e c t m i c ef r o m l e t h a l i n f l u e n z a A v i r u s c h a l l e n g e[J].I mm u n o l L e t t,2004,93(2G3):131G136.(上接第659页)[10]鞠伟.H C VG核心抗原及H C V R N A检测在慢性丙型肝炎诊断中的价值分析[J].当代医学,2021,27(1):52G55.[11]L U C E J K O M,F L I S I A KR.Q u a n t i t a t i v em e a s u r e m e n t o fH C V c o r e a n t i g e n f o rm a n a g e m e n t o f i n t e r f e r o nGf r e e t h e r a p y i nH C VGi n f e c t e d p a t i e n t s[J].A n t i v i rT h e r,2018,23(2):149G156.[12]A P P L E G A T E T L,F A J A R D O E,S A C K SJ A.H e p a t i t i sC v i r u s d i a g n o s i s a n d t h e h o l y g r a i l[J].I n f e c tD i s C l i nN o r t hA m,2018,32(2):425G445.[13]X I A N G Y,L A IXF,C H E NP,e t a l.T h e c o r r e l a t i o no fH C VR N Aa n dH C Vc o r e a n t i g e n i nd i f f e r e n t g e n o t y p e s o fH C V[J].JC l i nL a bA n a l,2019,33(1):e22632.[14]曾珠,张卫云,魏丽娟.丙肝抗体㊁丙肝病毒R N A㊁白蛋白及谷丙转氨酶在丙肝诊断中的应用[J].生物技术通讯,2015,26(6):849G852.[15]H A J A R I Z A D E HB,L A M O U R YF M,F E L DJ J,e t a l.A l a n i n e a m i n o t r a n s f e r a s e,H C VR N A l e v e l s a n d p r oGi n f l a m m a t o r y a n d p r oGf i b r o g e n i c c y t o k i n e s/c h e m o k i n e s d u r i n g a c u t e h e p a t i t i s C v i r u s i n f e c t i o n[J].V i r o l J,2016,13:32.207L a b e l e d I mm u n o a s s a y s&C l i n M e d,A p r.2021,V o l.28,N o.4。
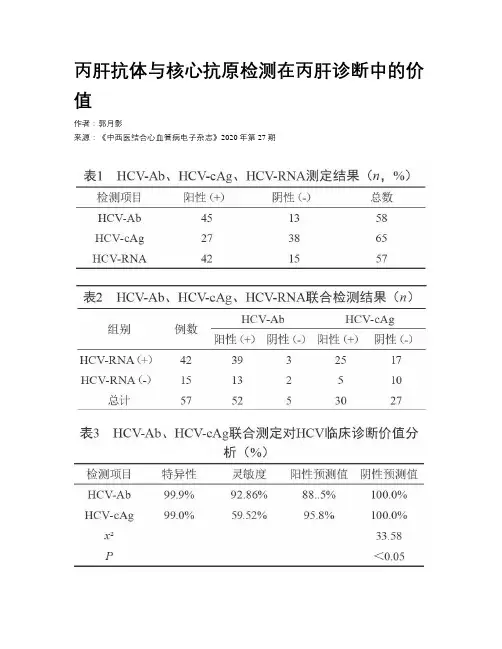
丙肝抗体与核心抗原检测在丙肝诊断中的价值作者:郭月影来源:《中西医结合心血管病电子杂志》2020年第27期【摘要】目的通过对丙型肝炎的抗体以及核心抗原的联合检测探讨其在肝炎诊断中的价值。
方法选取2018年9月~2019年9月我院1200例住院或门诊患者进行丙型肝炎抗体(HCV-Ab)及核心抗原(HCV-cAg)的检测,对单个阳性或双阳性者同时进行丙型肝炎病毒RNA(HCV-RNA)的检测。
结果 1200例患者检测中,HCV-Ab、HCV-cAg两项均为阳性的患者为72例,单项阳性的患者分别为45例和27例;HCV-RNA检测出来的阳性患者为42例,阴性患者15例;发现HCV-Ab的阳性检出率为92.86%,阳性预测值为88.5%;HCV-cAg的阳性检出率为59.52%,阳性预测值为95.8%。
结论通过对HCV-Ab及HCV-cAg的联合检测能够更加准确的检测出是否感染丙型肝炎病毒的情况,同时对早期的诊断和预防具有重要意义,值得在临床检验进一步推广。
【关键词】丙型肝炎病毒;丙型肝炎抗体;核心抗原;联合检测【中图分类号】R446 【文献标识码】A 【文章编号】ISSN.2095.6681.2020.27..02丙型肝炎主要是由于丙型肝炎病毒(HCV)感染引起的重要传染病之一[1],该疾病的感染发生率在我国达到了3.3%,同时由于该疾病在感染后症状不明显,极易由急性转变为慢性,进而由肝炎转化为肝硬化,再发展为肝癌的表现,严重威胁人类的身体健康[2]。
HCV病毒是由单链RNA病毒构成,其传播途径主要包括:血液传播、医疗器械传播、密切接触传播等[3],因此早期如何有效的进行阻断和诊断具有重要意义。
本文选取我院1200例住院或门诊患者进行丙型肝炎抗体(HCV-Ab)及核心抗原(HCV-cAg)的检测,对单个阳性或双阳性者同时进行丙型肝炎病毒RNA(HCV-RNA)的检测以期为临床诊断提供有利依据。
1 资料与方法1.1 一般资料选取2018年9月~2019年9月我院1200例住院或门诊患者,其中男650例,女550例,年龄11~75岁,平均56.6±6.84岁。

丙肝病毒标志物的临床意义检验科:郭洪晨一丙型肝炎病毒抗体(HCV-Ab/抗-HCV)抗-HCV是丙肝病毒感染筛查和诊断较为常用的检测指标,目前多抗原(HCV Core 、NS3 、NS4和NS5抗原)包被的检测试剂(第3代抗-HCV)平均“窗口期”是70天,也就是说人体感染丙肝病毒大约70天以后产生的抗体滴度才能达到试剂检测最低限,70天之前要么没有产生抗体,要么抗体滴度过低不足以被检出,窗口期容易出现漏检的情况。
抗-HCV不是保护性抗体,不能中和或清除丙肝病毒,对人体亦没有保护作用,该抗体阳性只是提示感染了丙肝病毒。
丙肝病毒感染者即便自愈或治疗后抗HCV也不一定阴转,仍可持续阳性多年甚至终生。
注意:《丙型肝炎防治指南》(2015年更新版)中明确指出一些自身免疫性疾病患者可出现抗-HCV 假阳性;血液透析和免疫功能缺陷或合并HIV 感染者可出现抗-HCV 假阴性,这些患者和可能处于窗口期的急性丙肝患者加测HCV- RNA有助于确诊。
二丙型肝炎病毒核心抗原(HCV cAg)丙肝核心抗原检测“窗口期”大约是14天, 与HCV- RNA具有较好的相关性,是间接反应体内病毒载量和复制程度的指标,阳性代表体内存在丙肝病毒,有一定的传染性。
丙肝核心抗原检测适用于丙型肝炎抗HCV血清阳转前“窗口期”感染者及免疫受损或先天性免疫缺陷群体如HIV感染者、长期透析的肾病患者、器官移植患者或先天性免疫功能缺陷的丙肝感染者的筛查。
三丙型肝炎病毒核糖核酸(HCV- RNA)HCV- RNA是反应丙肝病毒载量和复制情况的直接指标,检测“窗口期”一般是7-11天。
HCV-RNA 定量检测适用于HCV 现症感染的确认、抗病毒治疗前基线病毒载量分析,以及抗病毒治疗过程中及治疗结束后的应答评估。
注意:HCV-RNA是单股正链RNA,本身不稳定;自然界中到处存在大量的RNA酶,加之RNA 又不耐高温,所以容易降解,易出现假阴性,不能仅凭一次阴性结果就排除诊断,至少需要在不同时间连续检测两次,结果都阴性才能排除丙肝病毒现症感染。
丙型肝炎核心抗原检测及其临床应用 侯远沛;刘成永;朱春玲;闫家微;钱秀梅 【期刊名称】《临床荟萃》 【年(卷),期】2007(22)16 【摘 要】随着乙型肝炎疫苗的广泛接种,我国乙型肝炎病毒的感染率已有所下降,而丙型肝炎由于缺乏有效预防措施,其感染率未得到有效的控制。丙型肝炎病毒(HCV)的感染与肝硬化以及肝细胞癌的发生密切相关,丙型肝炎核心抗原(HCV-cAg)的检测作为一种新的检测方法可以一定程度上弥补抗体检测方法的不足,具有高度敏感性及特异性,可以明显缩短窗口期,有利于丙型肝炎的早期诊断,减少因输血传播丙型肝炎的发生率。我们主要就HCV-cAg的检测与临床的关系作初步探讨。
【总页数】2页(P1203-1204) 【作 者】侯远沛;刘成永;朱春玲;闫家微;钱秀梅 【作者单位】徐州市传染病医院,检验科,江苏,徐州,221004;徐州市传染病医院,检验科,江苏,徐州,221004;徐州市传染病医院,检验科,江苏,徐州,221004;徐州市传染病医院,检验科,江苏,徐州,221004;徐州市传染病医院,检验科,江苏,徐州,221004
【正文语种】中 文 【中图分类】R512.63 【相关文献】 1.丙型肝炎病毒核心抗原检测的临床应用价值 [J], 谭晓霞;纪勇平;骆昊翠 2.丙型肝炎病毒核心抗原检测的临床应用 [J], 莫喜明;胡道奇;张将;周咏武;唐爱国 3.丙型肝炎病毒核心抗原检测的临床应用 [J], 赵新萍;杨中文 4.丙型肝炎病毒核心抗原检测的临床应用探讨 [J], 朱鸿;张韬;范存琳;肖晓光;张凤华 5.丙型肝炎病毒核心抗原检测技术的临床应用 [J], 陈振球
因版权原因,仅展示原文概要,查看原文内容请购买
丙型肝炎核心抗原检测试剂的临床应用中国病毒病杂志2013年1月第3卷第1期陈新月1,窦晓光2,Dale Hu3,高峰4,高省5,华文浩6,贾继东7,蒋岩8,John Klena3,鲁凤民9,卢胜男10,欧启水11,魏来12,汪宁8,徐英春13,殷鹏14,张继明15,赵秀英16,庄辉9丙型肝炎核心抗原检测是新近发展的一种HCV感染的检测方法。
由于感染HCV 后,HCV核心抗原出现较早,且与血清中HCV RNA载量呈正相关,并在HCV感染治愈或康复后消失,因此,可作为HCV感染的早期诊断、献血员筛查、慢性HCV感染诊断、高危人群监测、免疫功能障碍患者的HCV感染诊断、鉴别既往感染抑或现症感染,并可用于抗病毒疗效的预测和监测。
1.HCV感染的早期诊断人感染HCV到产生抗-HCV的平均时间约60d,被称为抗-HCV的窗口期。
但HCV 核心抗原于HCV感染后12~15d即可检测到,较抗-HCV出现提前5~7周。
Peterson等报告,HCV核心抗原的出现时间仅较HCV RNA晚1d。
因此,HCV核心抗原筛查可作为HCV感染的早期诊断。
2.用于献血员筛查Lee等检测血液中心128例HCV窗口期感染的血液标本(抗-HCV阴性,HCV RNA 阳性),结果HCV核心抗原的检出率为94%。
Brojer等检测波兰14.4万例血液中心的血标本,2例HCV核心抗原阳性。
因此,波兰考虑将HCV核心抗原作为常规献血员筛查项目之一。
目前,克罗地亚已将HCV核心抗原作为献血员筛查项目之一。
3 .抗-HCV补充试验我国《丙型肝炎病毒实验室检测技术规范(试行)》指出:对初筛呈阳性反应的样品,应用原有试剂双孔或原有试剂加另一种不同原理(或厂家)试剂进行复检,如呈一阴一阳反应者,应进行补充试验。
目前常用的补充试验系用RIBA,如Chiron RIBA HCV 3.0 SIA抗HCV确证试剂(RIBA)和新加坡MP Biomedicals Asia Pacific Pte Ltd公司生产的丙型肝炎病毒抗体补充试剂盒(蛋白印迹法)(HCVBlot 3.0,简称MP),但该法价格较贵,操作较复杂,一般实验室不开展此试验。
抗体ELISA检测联合丙肝病毒核心抗原检测在丙肝治疗中的意
义
背景
乙型肝炎病毒(HBV)感染已被广泛研究,丙肝病毒(HCV)感染是肝炎病毒
导致的第二大原因。
HCV感染可导致丙肝、肝硬化和肝癌等严重后果。
随着抗病
毒治疗的进展和发展,丙肝的治疗逐渐成为可能。
然而,由于潜伏期较长、无症状、具有多样性和难以检测等特点,丙肝病毒的检测和诊断成为制约治疗的主要限制因素之一。
检测方法
抗体ELISA检测和病毒核心抗原检测是目前应用最广泛的两种检测方法。
抗体ELISA检测是通过检测人体对HCV感染产生的抗体反应来实现的,而病毒核心抗
原检测则是检测病毒本身分泌的抗原,这些抗原是病毒感染的最早标志。
这两种检测方法各有优劣,抗体检测范围广,但由于其产生需要时间,因此检测结果不够敏感。
相比之下,病毒核心抗原检测的敏感性更高,但其检测范围可能有限。
意义
采用抗体ELISA检测联合病毒核心抗原检测的方法,可以进一步提高HCV感
染的检测敏感度。
在丙肝治疗中,这种方法的意义尤为重要。
丙肝的治疗通常需要长期的抗病毒治疗,如果治疗前没有检测出HCV感染病例或检测不准确,那么治
疗后疗效的评估就可能存在很大的误差。
因此,在诊断和治疗丙肝病毒感染时,正确和尽可能敏感地检测感染情况对于治疗和预后非常重要。
结论
检测丙肝病毒核心抗原和抗体ELISA联合检测可以有效地提高HCV感染检测
的敏感性,尤其在丙肝治疗中该方法的意义更为重要。
虽然目前该方法仍需要进一步的研究和探索,但相信它将会为丙肝的治疗和预后评估提供更加准确的数据支撑。
丙型肝炎的血清学标志物和检测方法丙型肝炎是一种由丙型肝炎病毒(HCV)引起的慢性肝炎,全球范围内广泛存在。
丙型肝炎的血清学标志物和检测方法对于早期诊断和治疗至关重要。
本文将介绍丙型肝炎的血清学标志物以及常用的检测方法。
一、血清学标志物1. HCV抗体(Anti-HCV):HCV抗体是检测HCV感染的最常用标志物。
抗体检测通常采用酶联免疫吸附试验(ELISA)或免疫荧光法(IFA)等方法。
阳性结果表明曾经感染过HCV,但不能区分活动性感染和已经康复的患者。
2. HCV核心抗原(HCVcAg):HCV核心抗原是HCV感染的早期标志物,可以用于早期诊断。
其检测方法主要有化学发光法和酶免疫法等。
HCV核心抗原的检测灵敏度高,可以检测到病毒感染的早期阶段。
3. HCV RNA:HCV RNA是检测HCV感染的直接指标,可以用于判断病毒感染的活跃性和病情的严重程度。
常用的检测方法包括定量PCR和定性PCR等。
HCV RNA的检测结果可以指导治疗方案的选择和疗效的评估。
二、检测方法1. 酶联免疫吸附试验(ELISA):ELISA是一种常用的HCV抗体检测方法。
该方法通过将患者血清中的HCV抗体与特定的抗原结合,然后用酶标记的二抗进行检测。
ELISA方法操作简便、成本低廉,适用于大规模筛查。
2. 化学发光法:化学发光法是一种高灵敏度的检测方法,可以用于检测HCV 核心抗原和HCV RNA。
该方法利用化学发光反应检测样本中的特定物质,具有高灵敏度、高特异性和广泛线性范围等优点。
3. 聚合酶链式反应(PCR):PCR是一种直接检测HCV RNA的方法。
该方法通过扩增样本中的HCV RNA,然后用特定的探针或引物进行检测。
PCR方法具有高灵敏度和高特异性,可以检测到病毒感染的早期阶段。
总结起来,丙型肝炎的血清学标志物包括HCV抗体、HCV核心抗原和HCV RNA。
常用的检测方法有ELISA、化学发光法和PCR等。
这些血清学标志物和检测方法的应用可以帮助医生早期诊断丙型肝炎、评估病情和指导治疗。
丙型肝炎病毒核心抗原检测的临床价值
目的探讨血清中丙型肝炎病毒核心抗原(HCV-cAg)检测的临床价值。
方法采用酶联免疫吸附试验检测HCV-cAg;采用化学发光方法检测HCV-Ab;采用实时荧光定量PCR方法检测HCV-RNA。
结果137例HCV-Ab阳性标本中HCV-RNA与HCV-cAg检测两种方法通过Kappa检验得出的结论一致性较好(P <0.001,Kappa=0.893);HCV-RNA和HCV-cAg阳性检出率分别为40.15%和37.96%,采用配对卡方检验,差异无统计学意义(χ2=0.571,P>0.05)。
55例HCV-RNA阳性标本中HCV-RNA拷贝数对数值与HCV-cAgOD均值之间有良好的正相关性(r=0.882,P<0.05)。
结论HCV-cAg检测操作简便,能够缩短诊断丙肝病毒感染的时间,其水平一定程度上能反应丙型肝炎患者体内HCV复制程度,具有较好的临床实用价值。
标签:丙型肝炎病毒抗体;丙型肝炎病毒-RNA;丙型肝炎病毒核心抗原
丙型肝炎病毒(HCV)是丙型病毒性肝炎的病原体,主要经血液传播,是目前引起输血后肝炎最常见和最严重的病原体。
丙型肝炎能引起急性和慢性肝炎,其感染慢性化占75%~85%,且慢性丙型肝炎与肝硬化和原发性肝癌关系密切[1]。
我国丙型病毒性肝炎的报告病例数呈现出逐年上升的趋势,严重威胁人民的生命健康。
由于目前尚无针对HCV的有效疫苗可供临床使用,因此对于丙肝感染的及早检出并通过一系列有效措施阻断其在易感人群间的传播就显得尤为重要。
近年来,陆续出现了一些关于HCV核心抗原(HCV-cAg)可以缩短丙肝感染检测窗口期,提高感染检出率的报道[2-3]。
本文通过检测丙型肝炎病毒抗体(HCV-Ab)阳性患者血清中HCV-cAg、HCV-RNA来探讨HCV-cAg检测在临床的应用价值。
1 资料与方法
1.1一般资料137例HCV-Ab阳性血清标本来自我院2014年1月~2015年5月门诊和住院患者,其中男性76例,女性61例,年龄16~68岁,平均39.7岁。
所有标本均空腹抽取静脉血离心分离血清,经HCV-Ab检测阳性,选取S/CO>3.0标本,于-20℃冰箱保存备测。
1.2 仪器与试剂HCV-cAg酶免试剂盒购自湖南康润药物有限公司,仪器为意大利亚特斯全自动酶免分析仪;HCV-RNA试剂购自中山大学达安基因股份有限公司,仪器为厦门安普利公司荧光定量PCR检测仪;HCV-Ab试剂为雅培公司原装试剂,仪器为雅培i2000化学发光仪。
1.3检测方法HCV-cAg采用ELISA方法;HCV-RNA采用實时荧光定量PCR 方法;HCV-Ab采用化学发光方法检测。
1.4统计学方法采用SPSS 18.0统计学软件进行数据分析,计数资料用率(%)表示,比较采用配对χ2检验;采用Pearson进行相关分析。
P<0.05为差
异有统计学意义。
2 结果
2.1 HCV-cAg与HCV-RNA检测结果的一致性分析137例HCV-Ab阳性标本中,HCV-cAg阳性标本52例,HCV-RNA阳性标本55例,两种检验方法通过比较Kappa检验结果(P<0.001,Kappa值=0.893),可认为这两种检验方法得出的结论一致性较好,见表1。
2.2 HCV-cAg与HCV-RNA阳性检出率比较137例HCV-Ab阳性标本中,HCV-RNA阳性检出率为40.15%(55/137)大于HCV-cAg阳性检出率37.96%(52/137),HCV-cAg与HCV-RNA阳性检出率相比较采用配对χ2检验,差异没有统计学意义(χ2=0.571,P>0.05)。
2.3 HCV-RNA阳性标本中HCV-RNA拷贝数与HCV-cAg吸光度(OD值)之间的相关性55例HCV-RNA阳性标本中HCV-RNA拷贝数对数值与HCV-cAgOD均值之间有良好的正相关性(r=0.882,P<0.05),见表2。
3 讨论
丙型肝炎病毒核心抗原是丙肝病毒颗粒的结构蛋白,是导致丙型肝炎体液免疫的重要蛋白,在各亚型丙型肝炎病毒中高度保守,血清中的丙肝病毒核心抗原非常稳定,是比较理想的丙肝病毒感染标志物[4-5]。
临床上对于诊断丙型肝炎病毒感染多采用ELISA检测HCV-Ab[6],因其可同时检测多个抗原位点,操作简便等优点。
但由于厂家之间使用丙型肝炎基因重组抗原质量及各抗原片段包被比例的不同,各厂家试剂间的敏感性和特异性存在着一定差异,从而会导致检测结果不一致[7]。
另外因感染丙型肝炎后HCV-Ab 出现较慢,平均约70 d,容易导致HCV感染的漏诊[8]。
此外,由于酶标抗体是广谱抗人IgG抗体,对吸附在固相上的IgG抗体无筛选作用,这就降低了检测的特异性,容易产生假阳性结果[9]。
目前认为HCV-RNA是反映HCV复制最直接最可靠的指标,HCV-RNA具有早期、敏感性和特异性较高等特点,但HCV-RNA检测对实验室有特殊要求,费用也比较高,在常规工作和多数基层医疗单位还难以开展。
本实验结果显示137例HCV-Ab阳性标本中,HCV-cAg和HCV-RNA两种检验方法通过比较Kappa 检验结果(P<0.001,Kappa=0.893),可认为这两种检验方法得出的结论一致性较好,即诊断结果基本一致。
HCV-RNA与HCV-cAg阳性检出率分别为40.15%和37.96%,差异无统计学意义(χ2=0.571,P>0.05)。
本实验HCV-cAg检出率与某些报道[10]不一致,这可能与标本选取和不同厂家试剂敏感性、特异性不同有关。
本研究结果还显示HCV-RNA阳性标本中HCV-cAgOD均值与HCV-RNA拷贝数对数值之间具有良好的正相关性(r=0.882,P<0.05),说明HCV-cAg一定程度上可以反映体内丙肝病毒复制的活跃程度。
本实验结果中有5例HCV-RNA 阳性但HCV-cAg阴性样本,可能是慢性丙肝病毒感染,目前低于核心抗原的最
低检测值。
另有2例HCV-cAg阳性而HCV-RNA阴性样本,可能是非特异性抗体干扰导致的假阳性,具体原因有待进一步研究。
综上所述,笔者认为HCV-cAg检测不需要特殊的仪器,操作简便,缩短了发现丙肝病毒感染的时间,可以弥补抗体检测的不足,在一定程度上還可作为HCV-RNA的替代或补充检测指标,对评价HCV感染、复制和治疗具有重要的临床应用价值。
在无条件开展HCV-RNA检测的基层医疗单位可以同时检测HCV-cAg和HCV-Ab,达到早期诊断的目的。
在已开展HCV-RNA检测的医院,最好也开展HCV-cAg检测,以避免RNA波动期或RNA样本降解造成的HCV-RNA假阴性。
HCV-RNA、HCV-cAg和HCV-Ab同时检测不但可以尽早检出和早期防治丙型肝炎感染,也可以减少由于输血后丙型肝炎引起的医疗纠纷。
参考文献:
[1]倪语星,等.临床微生物学检验[M].北京:人民卫生出版社,2012.
[2]刘潇,等.联合检测丙肝病毒核心抗原和抗体在丙型肝炎早期诊断中的价值[J].中国卫生检验杂志,2012.
[3]李妙羡,等.HCV抗原检测与HCV-RNA和HCV抗体检测的比较研究[J].现代检验医学杂志,2012.
[4]Chakravarti A,Chauhan MS,Dogra G,et al.Hepatitis Cviruscoreantigenassay:canwe think beyond conventioninresour celimite dsettings[J].Braz J Infect Dis,2013.
[5]刘佳,等.临床实验室仪器间比对实验探讨[J].中华实验和临床病毒学杂志,2013.
[6]许方,等.丙肝病毒核心抗原检测对于丙型肝炎诊断的价值[J].中国实验诊断学,2010.
[7]MoreiraRC.Hepatitis Candhe modialysis:areview[J].Braz J Infect Dis,2005.
[8]陈景芬.酶联免疫吸附试验检测丙型肝炎病毒抗体影响因素分析[J].检验医学与临床,2008.
[9]宁发锦.丙型肝炎病毒载量与核心抗原及丙氨酸转氨酶检测的比较研究[J].检验医学与临床,2011.
[10]徐炜新.抗原抗体联合检测在提高血液透析患者丙肝感染检出率中的应用[J].国际检验医学杂志,2015.。