磷酸钙法细胞转染试剂盒
- 格式:doc
- 大小:43.50 KB
- 文档页数:2

腺病毒操作资料说明
1、AdEasy™ Adenoviral Vector System.pdf:这是过表达腺病毒(用于基因过表达)的操作说明书,作为操作指南;
2、AD-293 Cells.pdf:腺病毒包装细胞说明书,作为操作指南;
3、病毒滴度测定-针对有绿色荧光蛋白标记的病毒.doc:病毒滴度测定方法,作为操作指南;
4、病毒滴度测定-针对没有绿色荧光蛋白标记的病毒.doc:病毒滴度测定方法,作为操作指南;
5、Adeno-X Expression System 1 User Manual.pdf:这是过表达腺病毒(用于基因过表达)的操作说明书,作为操作指南;
6、腺病毒扩增和纯化手册.pdf:腺病毒扩增和纯化方法,作为理论学习
7、腺病毒包装、扩增、纯化、滴度测定及感染.doc:腺病毒包装、扩增、纯化、滴度测定及感染操作指南;
8、C0508磷酸钙法细胞转染试剂盒.pdf:磷酸钙转染方法;。
磷酸钙法细胞转染试剂盒简介:外源基因导入真核细胞的方法有很多种,如磷酸钙转染法、DEAE-葡聚糖转染法、脂质体法、电穿孔法、显微注射法等。
Leagene 磷酸钙法细胞转染试剂盒(Calcium Phosphate Cell Transfection Kit)是在传统的磷酸钙细胞转染方法的基础上进行了改良,提高了转染效率,并降低了毒性,可用于磷酸钙法转染细胞,不仅可以瞬时表达,也可以筛选稳定株。
组成:操作步骤(仅供参考):(一)贴壁细胞转染:1、 在转染前24h 用胰蛋白酶消化培养细胞,取适量对数期细胞转移至新的培养器皿中,待细胞密度大70~80%满时即可进行转染。
后续操作步骤均按6孔板计算,如果转染器皿不同,请按比例自行调节用量。
2、 在加入DNA 之前2~4h ,加入2ml 不含抗生素的完全培养液,置于37℃ 5% CO 2培养箱培养。
3、 取DNA(体积不宜超过20μl)加入100μl Calcium chloride solution ,混匀,即为DNA-CaCl 2溶液。
4、 取BBS solution 100μl ,用移液器一边吹打BBS solution ,一边逐滴加入DNA-CaCl 2溶液(操作缓慢,一般在1~2min)。
5、 室温静置20~30min ,即为DNA-CaCl 2-BBS 溶液,此时可能出现极其微小颗粒沉淀。
6、 取DNA-CaCl 2-BBS 溶液底部物质均匀加入到6孔板细胞中,轻轻晃动混匀。
7、 置于37℃ 5% CO 2培养箱培养。
8、 去除培养液,用PBS 清洗细胞2次,加入2ml 完全培养液继续培养,一般24h 后可见转染细胞的表达。
(二)悬浮细胞转染:1、 低速离心收集悬浮细胞,用PBS 洗涤1次。
2、 取DNA(体积不宜超过20μl)加Calcium chloride solution ,混匀,即为DNA-CaCl 2溶液。
编号 名称CZ0008 100T CZ0008200T Storage 试剂(A): Calcium chloride solution 10ml 20ml -20℃ 试剂(B): BBS solution 10ml 20ml -20℃使用说明书 1份3、取BBS solution,用移液器一边吹打BBS solution,一边逐滴加入DNA-CaCl2溶液。

细胞转染的原理操作步骤以及小技巧细胞转染是一种将外源DNA、RNA、蛋白质等分子导入到细胞内的实验技术。
这种技术可以用来研究基因功能、发现新的信号通路和治疗基因疾病等。
下面将介绍细胞转染的原理、操作步骤以及一些小技巧。
一、细胞转染的原理:细胞转染主要通过三种方法实现:物理法、化学法和生物学法。
1.物理法:通过高压、电穿孔、微射流等方式,使细胞膜发生瞬时破裂,从而使DNA、RNA等外源分子进入细胞。
常用的物理法有电穿孔法和基因枪法。
2.化学法:通过化学物质,如聚吡咯、脂质体等,使外源分子与细胞膜结合,从而实现转染。
常用的化学法有聚乙烯亚胺(PEI)法、磷酸钙共沉淀法等。
3.生物学法:通过利用病毒载体将外源基因导入目标细胞,实现基因的转移。
常用的生物学法有腺相关病毒(AAV)转染、逆转录病毒(RETRO)转染等。
二、细胞转染的操作步骤:1.细胞的预处理:根据细胞类型和实验要求,将细胞培养至合适的状态。
通常细胞应处于快速生长期,但还未达到接触抑制的阶段。
对于一些特定的细胞,如悬浮细胞,可能需要将其转接至适当的培养基中。
2.外源分子的准备:将外源DNA、RNA等转染载体制备好。
如将DNA克隆并纯化至高质量的质粒DNA,或将RNA合成或纯化。
根据实验要求选择合适的转染载体。
3.转染方法的选择:根据实验要求选择合适的转染方法,如物理法、化学法或生物学法。
一般情况下,物理法适用于悬浮细胞,化学法适用于贴壁细胞,而生物学法适用于大多数细胞类型。
4.细胞转染操作:a.物理法:i.电穿孔法:将细胞悬浮于含有外源分子的缓冲液中,然后通过电穿孔仪的电极或电穿孔板进行电穿孔。
ii. 基因枪法:使用基因枪将外源分子直接“枪”入目标细胞中。
b.化学法:i.PEI法:将PEI与外源DNA或RNA按一定比例混合,在适当条件下形成复合物,然后添加至目标细胞中。
ii. 磷酸钙共沉淀法:将外源DNA与磷酸钙按比例混合,并静置形成磷酸钙- DNA沉淀,然后加入至目标细胞中。
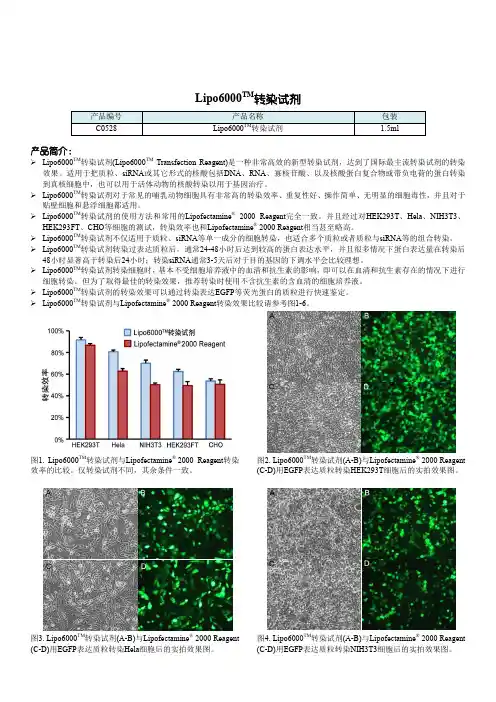
Lipo6000TM转染试剂产品简介:Lipo6000TM转染试剂(Lipo6000TM Transfection Reagent)是一种非常高效的新型转染试剂,达到了国际最主流转染试剂的转染效果。
适用于把质粒、siRNA或其它形式的核酸包括DNA、RNA、寡核苷酸、以及核酸蛋白复合物或带负电荷的蛋白转染到真核细胞中,也可以用于活体动物的核酸转染以用于基因治疗。
Lipo6000TM转染试剂对于常见的哺乳动物细胞具有非常高的转染效率、重复性好、操作简单、无明显的细胞毒性,并且对于贴壁细胞和悬浮细胞都适用。
Lipo6000TM转染试剂的使用方法和常用的Lipofectamine®2000Reagent完全一致。
并且经过对HEK293T、Hela、NIH3T3、HEK293FT、CHO等细胞的测试,转染效率也和Lipofectamine® 2000 Reagent相当甚至略高。
Lipo6000TM转染试剂不仅适用于质粒、siRNA等单一成分的细胞转染,也适合多个质粒或者质粒与siRNA等的组合转染。
Lipo6000TM转染试剂转染过表达质粒后,通常24-48小时后达到较高的蛋白表达水平,并且很多情况下蛋白表达量在转染后48小时显著高于转染后24小时;转染siRNA通常3-5天后对于目的基因的下调水平会比较理想。
Lipo6000TM转染试剂转染细胞时,基本不受细胞培养液中的血清和抗生素的影响,即可以在血清和抗生素存在的情况下进行细胞转染。
但为了取得最佳的转染效果,推荐转染时使用不含抗生素的含血清的细胞培养液。
Lipo6000TM转染试剂的转染效果可以通过转染表达EGFP等荧光蛋白的质粒进行快速鉴定。
Lipo6000TM转染试剂与Lipofectamine® 2000Reagent转染效果比较请参考图1-6。
图1. Lipo6000TM转染试剂与Lipofectamine® 2000Reagent转染效率的比较。


4. 哺乳动物细胞siRNA转染4.1 转染方法:将制备好的siRNA、siRNA表达载体或表达框架转导至真核细胞中的方法主要有以下几种:磷酸钙共沉淀;电穿孔法;DEAE-葡聚糖和polybrene;机械法;阳离子脂质体试剂。
目前用的最多的是阳离子脂质体法。
4.1.1 磷酸钙共沉淀将氯化钙,RNA(或DNA)和磷酸缓冲液混合,沉淀形成包含DNA且极小的不溶的磷酸钙颗粒。
磷酸钙-DNA复合物粘附到细胞膜并通过胞饮进入目的细胞的细胞质。
沉淀物的大小和质量对于磷酸钙转染的成功至关重要。
在实验中使用的每种试剂都必须小心校准,保证质量,因为甚至偏离最优条件十分之一个pH都会导致磷酸钙转染的失败。
4.1.2 电穿孔法电穿孔通过将细胞暴露在短暂的高场强电脉冲中转导分子。
将细胞悬浮液置于电场中会诱导沿细胞膜的电压差异,据认为这种电压差异会导致细胞膜暂时穿孔。
电脉冲和场强的优化对于成功的转染非常重要,因为过高的场强和过长的电脉冲时间会不可逆地伤害细胞膜而裂解细胞。
一般,成功的电穿孔过程都伴随高水平(50%或更高)的毒性。
4.1.3 DEAE-葡聚糖和polybrene带正电的DEAE-葡聚糖或polybrene多聚体复合物和带负电的DNA分子使得DNA 可以结合在细胞表面。
通过使用DMSO或甘油获得的渗透休克将DNA复合体导入。
两种试剂都已成功用于转染。
DEAE-葡聚糖仅限于瞬时转染。
4.1.4 机械法转染技术也包括使用机械的方法,比如显微注射和基因枪(biolistic particle)。
显微注射使用一根细针头将DNA,RNA或蛋白直接转入细胞质或细胞核。
基因枪使用高压microprojectile将大分子导入细胞。
4.1.5 阳离子脂质体试剂在优化条件下将阳离子脂质体试剂加入水中时,其可以形成微小的(平均大小约100-400nm)单层脂质体。
这些脂质体带正电,可以靠静电作用结合到DNA的磷酸骨架上以及带负电的细胞膜表面。

一、磷酸钙转染法【实验原理】磷酸钙沉淀法是基于磷酸钙-DNA复合物的一种将DNA导入真核细胞的转染方法。
磷酸钙有利于促进外源DNA与靶细胞表面的结合。
磷酸钙-DNA复合物粘附到细胞膜并通过胞饮作用进入靶细胞,被转染的DNA可以在细胞内进行瞬时表达,也可整合到靶细胞的染色体上从而产生不同基因型和表型的稳定克隆。
该方法可广泛用于转染许多不同类型的细胞。
【仪器、材料和试剂】(一)仪器、用具CO2培养箱、10cm细胞培养平板、巴斯德吸管、微量移液器、15ml锥形管、烧杯、量筒等。
(二)材料呈指数生长的真核细胞BALB/c 3T3CsCl纯化的表达质粒DNA(三)试剂1.完全培养液DMEM 90mlFCS 10ml2.2M CaCl2,过滤除菌,-20℃保存备用3.2×HEBS (g/500ml)NaCl 8.0KCl 0.38Na2HPO4.7H2O 0.19HEPES 5.0葡萄糖 1.0用NaOH调pH至6.95,过滤除菌后,-20℃保存备用。
【方法与步骤】1.在10cm的培养板上接种1×106个BALB/c 3T3细胞第二天进行转染2.准备CaPO4沉淀2.1 准备两组试管在A管中加入:15μg质粒DNA69μl 2M CaCl2460μl重蒸水在B管中加入:550μl 2×HEBS2.2 用巴斯德吸管将A管中的溶液缓慢地逐滴加入在B管中,同时用另一吸管吹打B管溶液,整个过程需缓慢进行,至少需持续1~2min。
2.3室温静置30min,出现细小颗粒沉淀。
3. 小心地将沉淀逐滴均匀地加入培养细胞的10cm平板中,轻轻晃动(此过程需尽快完成)。
4. 在5%CO2的加湿培养箱中培养细胞2-6 hr。
5. 除去培养液,加入10ml完全培养液培养细胞1-6天(依具体情况而定)。
6. 收集细胞进行基因活性的检测,或分散接种到其他培养皿中进行选择培养。
【注意事项】1.在整个转染过程中要保持无菌操作。


4. 哺乳动物细胞siRNA转染4.1 转染方法:将制备好的siRNA、siRNA表达载体或表达框架转导至真核细胞中的方法主要有以下几种:磷酸钙共沉淀;电穿孔法;DEAE-葡聚糖和polybrene;机械法;阳离子脂质体试剂。
目前用的最多的是阳离子脂质体法。
4.1.1 磷酸钙共沉淀将氯化钙,RNA(或DNA)和磷酸缓冲液混合,沉淀形成包含DNA且极小的不溶的磷酸钙颗粒。
磷酸钙-DNA复合物粘附到细胞膜并通过胞饮进入目的细胞的细胞质。
沉淀物的大小和质量对于磷酸钙转染的成功至关重要。
在实验中使用的每种试剂都必须小心校准,保证质量,因为甚至偏离最优条件十分之一个pH都会导致磷酸钙转染的失败。
4.1.2 电穿孔法电穿孔通过将细胞暴露在短暂的高场强电脉冲中转导分子。
将细胞悬浮液置于电场中会诱导沿细胞膜的电压差异,据认为这种电压差异会导致细胞膜暂时穿孔。
电脉冲和场强的优化对于成功的转染非常重要,因为过高的场强和过长的电脉冲时间会不可逆地伤害细胞膜而裂解细胞。
一般,成功的电穿孔过程都伴随高水平(50%或更高)的毒性。
4.1.3 DEAE-葡聚糖和polybrene带正电的DEAE-葡聚糖或polybrene多聚体复合物和带负电的DNA分子使得DNA 可以结合在细胞表面。
通过使用DMSO或甘油获得的渗透休克将DNA复合体导入。
两种试剂都已成功用于转染。
DEAE-葡聚糖仅限于瞬时转染。
4.1.4 机械法转染技术也包括使用机械的方法,比如显微注射和基因枪(biolistic particle)。
显微注射使用一根细针头将DNA,RNA或蛋白直接转入细胞质或细胞核。
基因枪使用高压microprojectile将大分子导入细胞。
4.1.5 阳离子脂质体试剂在优化条件下将阳离子脂质体试剂加入水中时,其可以形成微小的(平均大小约100-400nm)单层脂质体。
这些脂质体带正电,可以靠静电作用结合到DNA的磷酸骨架上以及带负电的细胞膜表面。
![聚焦转染:8大品牌转染试剂强中强[选购宝典]](https://uimg.taocdn.com/66b7e9b6960590c69ec376a0.webp)
聚焦转染:8大品牌转染试剂强中强[选购宝典]生物通技术专评:数百万年来原核生物如大肠杆菌就经常相互分享它们的遗传物质的——受到自然的启发,出现了将DNA导入哺乳动物培养细胞的技术——这是分子生物学的又一个重要的里程碑。
也多谢这种技术的不断进步,我们终于可以在各种哺乳动物细胞中进行各种克隆化基因的表达,从而达到不同的目的--比如,生产制备大量经过真核特有的翻译后加工的活性蛋白;研究表达蛋白的结构和生化特性;研究基因表达的调控机理;甚至调控基因的表达等等。
可以说在哺乳动物细胞中表达外源基因的2个关键:一个是选择构建合适的表达载体和表达细胞株,另一个就是选择合适的方法将克隆的基因导入培养细胞中进行表达。
转染技术的广泛使用促进了人们对外源基因在哺乳动物细胞中的表达等方面的认识,并在方法学上促进了该领域及相关领域的发展。
从磷酸钙到脂质体,到多胺,可用于转染的细胞种类已越来越多,转染试剂也不断更新换代,而转染也不再仅限于将DNA转入细胞中了,RNA,siRNA,蛋白质等等生物大分子也进入了转染的行列。
在纷纭的产品中,你会选择哪种转染试剂?生物通这个转染试剂专辑希望为大家介绍市面上主流的转染试剂和各自的个性特点和适用范围--可以说,针对不同的细胞株,不同的转染实验目的,还有不同的转染要求,很难找到一种能满足所有的要求,十全十美的产品。
你需要一一尝试和优化条件——但是了解市面上各种产品的特点与长短,无论是对于转染新手,或者是“老革命遇到新问题”,都是有益的。
在生物通这个转染试剂专辑系列我们将分别介绍国外几个经典好用的王牌产品,以及国内物美价廉的后起之秀,以及总结一些使用心得和注意事项。
如果你有自己的心得并愿意和大家分享,欢迎投稿生物通哦:)一、打开转染之门:基本概念作为篇首还是要把老调调再弹弹。
请原谅我有点“唐僧”的回顾几种经典转染方法。
DEAE-葡聚糖(Diethylaminoethyl (DEAE)-dextran):这个早在1965年出现的转染方法差不多是最古董级的方法之一了,直到现在竟然还有少数人坚持采用。
细胞培养与细胞转染目的学习细胞培养的基本方法掌握磷酸钙法转染细胞的原理及操作步骤体外细胞培养技术细胞培养(cell culture):是指从活体中取出小块组织分离出细胞,在一定条件下进行培养,使之能继续生存、生长、增殖的一种方法。
细胞分类:贴壁细胞和悬浮细胞优点:离体条件下观察细胞生命活动规律,不受体内环境影响可人为改变条件,进一步观察生理功能的改变。
原代培养(primary culture):直接取材于有机体组织的细胞进行培养传代培养(secondary culture):把原代培养的细胞从培养瓶中取出进行培养细胞体外培养所需的一般条件:适宜的培养皿血清成分37℃ 5%CO295~100%湿度抗生素细胞系(cell line):在细胞培养中产生了具有无限增殖能力的变种细胞,这种细胞可被无限的传代。
常见的细胞系:NIH3T3细胞系:1963年取自小鼠胚胎细胞建立Hela细胞系:1952年取自人宫颈癌细胞建立细胞培养基本技术培养用品的清洗和消毒无菌操作培养用液的配制组织取材和分离细胞传代培养培养用品的清洗和消毒1.清洗:浸泡,刷洗,清洁液浸泡,冲洗2 包装3 培养用品的消毒灭菌干热消毒湿热消毒紫外线消毒过滤除菌消毒消毒剂和抗生素一次性用品无菌操作(一)清点培养物品和用具(二)操作野消毒,紫外线灯 30分(三)洗手和着装(四)培养过程中的操作酒精灯的使用,物品的摆放(五)操作后台面的清洁和复位培养用液水和平衡盐溶液天然培养基合成培养基水和平衡盐溶液超纯水和三蒸水,双蒸水只能用于清洗平衡盐溶液:配制培养液,洗涤组织和细胞Hanks, D-Hanks, PBS,HEPES等天然培养基血清,水解乳蛋白和胶原血清:小牛血清,胎牛血清,马血清,兔血清,人血清热灭活处理:56度,30分,灭活补体合成培养基DMEM: MEM基础上改良而成,用于生长快,附着性差的肿瘤细胞RPMI1640:应用广泛,用于正常细胞和肿瘤细胞HAM F12:单细胞的培养TC199:较少应用无血清培养基大多数细胞的培养依赖天然培养基,如血清,但干扰实验稳定HAM F12+ DMEM(1:1)混合,再加入其它成分其他常用液体消化液:消化分散细胞胰酶:0.25% ,0.125%EDTA: 0.02%(乙二胺四乙酸二钠)抗生素液:抗污染青霉素,链霉素,卡那霉素,庆大霉素联合使用效果更好细胞传代培养贴壁细胞采用消化法,悬浮细胞可直接吹打,离心后传代材料细胞g/ml链霉素,0.03%谷氨酰胺)μ DMEM培养液(Gibcol公司,含10%小牛血清,100U/ml 青霉素,100胰酶 (0.25%)PBS (pH7.4)细胞培养皿(培养板)CO2培养箱超净台步骤倒出旧培养液,Hanks液洗2-3次加少许消化液,37度消化1-2分钟镜下观察到细胞呈球形,胞质回缩,细胞间隙增大时,弃消化液,加3-5ml培养液终止消化吹下细胞,混匀,分装2-3个培养瓶细胞转染转染技术是指将外源分子如DNA,RNA等导入真核细胞的技术,它是研究基因表达调控,突变分析等的常规工具,随着功能研究的兴起,其应用越来越广泛。
一种高效稳定的磷酸钙转染293T细胞方法的建立及评价华进;程志彬;林春霖;戴起宝;朱广伟【摘要】目的:探讨2种磷酸钙转染法转染293 T细胞的效果,建立一种实现高效稳定磷酸钙转染293 T细胞的方法.方法:荧光显微镜观察采用2种磷酸钙转染方法(传统磷酸钙转染法和改良磷酸钙转染法)转染pCDH-GFP-3xflag-TRAF6质粒进入293T细胞的转染效率.采用Real-time PCR法和Western blotting法分别检测2种磷酸钙转染方法转染pCDH-GFP-3xflag-TRAF6质粒进入293T细胞后,肿瘤坏死因子受体相关因子6(TRAF6)mRNA和flag蛋白表达水平.结果:荧光显微镜下观察,与传统磷酸钙转染法比较,改良磷酸钙转染法转染pCDH-GFP-3xflag-TRAF6质粒进入293T细胞24和48 h后的转染效率明显升高(P<0.01);Real-time PCR法和Western blotting法检测,与传统转染方法比较,磷酸钙转染改良法转染pCDH-GFP-3xflag-TRAF6质粒进入293T细胞24和48 h后,TRAF6 mRNA和flag蛋白表达水平均明显升高(P<0.01).结论:本研究建立的改良磷酸钙转染方法是一种高效、稳定的DNA转染方法.【期刊名称】《吉林大学学报(医学版)》【年(卷),期】2019(045)005【总页数】6页(P1177-1181,前插5)【关键词】磷酸钙转染;293T细胞;肿瘤坏死因子受体相关因子6;flag蛋白【作者】华进;程志彬;林春霖;戴起宝;朱广伟【作者单位】福建医科大学附属第一医院胃肠外科二区,福建福州 350005;福建医科大学附属第一医院胃肠外科二区,福建福州 350005;福建医科大学消化道恶性肿瘤教育部重点实验室,福建福州350005;福建医科大学附属第一医院胃肠外科二区,福建福州 350005;福建医科大学附属第一医院胃肠外科二区,福建福州 350005;福建医科大学附属第一医院胃肠外科二区,福建福州 350005;福建医科大学消化道恶性肿瘤教育部重点实验室,福建福州350005【正文语种】中文【中图分类】Q819目前,将质粒DNA导入动物细胞的方法有很多,最常用的方法包括脂质体转染、电转法、显微注射法和磷酸钙共沉淀法等[1]。
4. 哺乳动物细胞siRNA转染4.1 转染方法:将制备好的siRNA、siRNA表达载体或表达框架转导至真核细胞中的方法主要有以下几种:磷酸钙共沉淀;电穿孔法;DEAE-葡聚糖和polybrene;机械法;阳离子脂质体试剂。
目前用的最多的是阳离子脂质体法。
4.1.1 磷酸钙共沉淀将氯化钙,RNA(或DNA)和磷酸缓冲液混合,沉淀形成包含DNA且极小的不溶的磷酸钙颗粒。
磷酸钙-DNA复合物粘附到细胞膜并通过胞饮进入目的细胞的细胞质。
沉淀物的大小和质量对于磷酸钙转染的成功至关重要。
在实验中使用的每种试剂都必须小心校准,保证质量,因为甚至偏离最优条件十分之一个pH都会导致磷酸钙转染的失败。
4.1.2 电穿孔法电穿孔通过将细胞暴露在短暂的高场强电脉冲中转导分子。
将细胞悬浮液置于电场中会诱导沿细胞膜的电压差异,据认为这种电压差异会导致细胞膜暂时穿孔。
电脉冲和场强的优化对于成功的转染非常重要,因为过高的场强和过长的电脉冲时间会不可逆地伤害细胞膜而裂解细胞。
一般,成功的电穿孔过程都伴随高水平(50%或更高)的毒性。
4.1.3 DEAE-葡聚糖和polybrene带正电的DEAE-葡聚糖或polybrene多聚体复合物和带负电的DNA分子使得DNA 可以结合在细胞表面。
通过使用DMSO或甘油获得的渗透休克将DNA复合体导入。
两种试剂都已成功用于转染。
DEAE-葡聚糖仅限于瞬时转染。
4.1.4 机械法转染技术也包括使用机械的方法,比如显微注射和基因枪(biolistic particle)。
显微注射使用一根细针头将DNA,RNA或蛋白直接转入细胞质或细胞核。
基因枪使用高压microprojectile将大分子导入细胞。
4.1.5 阳离子脂质体试剂在优化条件下将阳离子脂质体试剂加入水中时,其可以形成微小的(平均大小约100-400nm)单层脂质体。
这些脂质体带正电,可以靠静电作用结合到DNA的磷酸骨架上以及带负电的细胞膜表面。
4. 哺乳动物细胞siRNA转染4.1 转染方法:将制备好的siRNA、siRNA表达载体或表达框架转导至真核细胞中的方法主要有以下几种:磷酸钙共沉淀;电穿孔法;DEAE-葡聚糖和polybrene;机械法;阳离子脂质体试剂。
目前用的最多的是阳离子脂质体法。
4.1.1 磷酸钙共沉淀将氯化钙,RNA(或DNA)和磷酸缓冲液混合,沉淀形成包含DNA且极小的不溶的磷酸钙颗粒。
磷酸钙-DNA复合物粘附到细胞膜并通过胞饮进入目的细胞的细胞质。
沉淀物的大小和质量对于磷酸钙转染的成功至关重要。
在实验中使用的每种试剂都必须小心校准,保证质量,因为甚至偏离最优条件十分之一个pH都会导致磷酸钙转染的失败。
4.1.2 电穿孔法电穿孔通过将细胞暴露在短暂的高场强电脉冲中转导分子。
将细胞悬浮液置于电场中会诱导沿细胞膜的电压差异,据认为这种电压差异会导致细胞膜暂时穿孔。
电脉冲和场强的优化对于成功的转染非常重要,因为过高的场强和过长的电脉冲时间会不可逆地伤害细胞膜而裂解细胞。
一般,成功的电穿孔过程都伴随高水平(50%或更高)的毒性。
4.1.3 DEAE-葡聚糖和polybrene带正电的DEAE-葡聚糖或polybrene多聚体复合物和带负电的DNA分子使得DNA 可以结合在细胞表面。
通过使用DMSO或甘油获得的渗透休克将DNA复合体导入。
两种试剂都已成功用于转染。
DEAE-葡聚糖仅限于瞬时转染。
4.1.4 机械法转染技术也包括使用机械的方法,比如显微注射和基因枪(biolistic particle)。
显微注射使用一根细针头将DNA,RNA或蛋白直接转入细胞质或细胞核。
基因枪使用高压microprojectile将大分子导入细胞。
4.1.5 阳离子脂质体试剂在优化条件下将阳离子脂质体试剂加入水中时,其可以形成微小的(平均大小约100-400nm)单层脂质体。
这些脂质体带正电,可以靠静电作用结合到DNA的磷酸骨架上以及带负电的细胞膜表面。
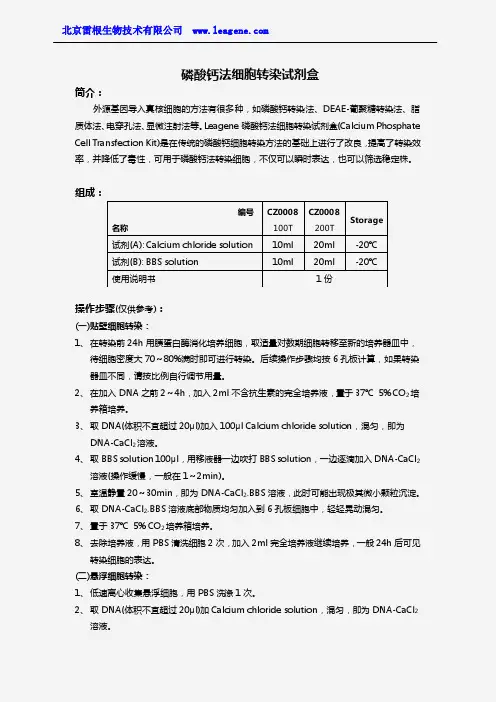
磷酸钙法细胞转染试剂盒
简介:
外源基因导入真核细胞的方法有很多种,如磷酸钙转染法、DEAE-葡聚糖转染法、脂质体法、电穿孔法、显微注射法等。
Leagene 磷酸钙法细胞转染试剂盒(Calcium Phosphate Cell Transfection Kit)是在传统的磷酸钙细胞转染方法的基础上进行了改良,提高了转染效率,并降低了毒性,可用于磷酸钙法转染细胞,不仅可以瞬时表达,也可以筛选稳定株。
HEK293是最适合磷酸钙法转染的细胞之一,优化条件后转染效率可以高达85%以上,一般的转染效率可达40~50%左右。
其他常见细胞(例如Hela 、CHO 细胞等)也适合磷酸钙法转染,但效率比293细胞要略低一些。
本转染试剂盒主要适合于大多数贴壁细胞的转染,也可于一些悬浮细胞的转染,一般要求DNA 浓度在10~50μg 为宜,Hela 、BALB 等细胞沉淀放置16h ,CHO 、DUKX 、B Ⅱ等细胞可以通过甘油、DMSO 进行热休克处理以提高转染效率。
组成:
自备材料:
1、 胰蛋白酶消化液
2、 完全培养基
3、 PBS
4、 无菌水
操作步骤(仅供参考):
(一)贴壁细胞转染:
1、 在转染前用胰蛋白酶消化培养细胞,取适量对数期细胞转移至新的培养器皿中,待细胞密度达即可进行转染。
后续操作步骤均按6孔板计算,如果转染器皿不同,请按比例自行调节用量。
2、 在加入DNA 之,加入不含抗生素的完全培养液,置于CO 2培养箱培养。
3、 取DNA(体积不宜超过20μl)加入Calcium chloride solution ,混匀,即为DNA-CaCl 2溶液。
编号 名称 CZ0008 100T CZ0008 200T Storage 试剂(A): Calcium chloride solution 10ml 20ml -20℃ 试剂(B): BBS solution 10ml 20ml -20℃
使用说明书 1份
4、取BBS solution 100μl,用移液器一边吹打BBS solution,一边逐滴加入DNA-CaCl2
溶液(操作缓慢,一般在1~2min)。
5、室温静置,即为DNA-CaCl2-BBS溶液,此时可能出现极其微小颗粒沉淀。
6、取DNA-CaCl2-BBS溶液底部物质均匀加入到6孔板细胞中,轻轻晃动混匀。
7、置于CO2培养箱培养。
如果培养细胞为CHO、DUKX等,可以DMSO或甘油进行休
克处理,转染效率会大大增加,即培养后,用含10%甘油或20%DMSO的完全培养液替换当前培养液,室温下静置,加PBS摇动混匀。
8、去除培养液,用PBS清洗细胞2次,加入完全培养液继续培养,一般24h后可见转染
细胞的表达。
(二)悬浮细胞转染:
1、低速离心收集悬浮细胞,用PBS洗涤1次。
2、取DNA(体积不宜超过20μl)加入Calcium chloride solution,混匀,即为DNA-CaCl2
溶液。
3、取BBS solution 100μl,用移液器一边吹打BBS solution,一边逐滴加入DNA-CaCl2
溶液(操作缓慢,一般在1~2min)。
4、室温静置,即为DNA-CaCl2-BBS溶液,此时可能出现极其微小颗粒沉淀。
5、每106个细胞沉淀用DNA-CaCl2-BBS溶液重新悬浮,室温放置。
6、6孔板每孔加入不含抗生素的完全培养基,取DNA-CaCl2-BBS溶液底部物质均匀加入
到6孔板中,轻轻晃动混匀。
7、置于37℃5% CO2培养箱培养,去除培养液,用PBS清洗细胞,加入完全培养液继续
培养,一般24h后可见转染细胞的表达。
注意事项:
1、注意无菌操作,尽量避免污染,同时DNA不应含有蛋白和酚。
2、休克处理某些细胞系会使转染效率大大提高,但应注意甘油暴露过久易导致细胞死亡。
3、转染12~24h后,可以加入终浓度为10mmol/L的丁酸钠溶液,可以提高病毒滴度。
4、BBS solution的pH值直接关系到转染效率,尽量避免长时间暴露在空气中,以免被空气中的二氧化碳酸化。
有效期:6个月有效。