稀土离子能级跃迁图
- 格式:ppt
- 大小:233.00 KB
- 文档页数:1


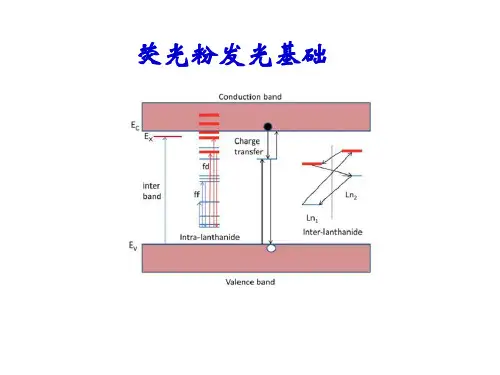



第二讲稀土离子的光谱特性稀土因其特殊的电子层结构,而具有一般元素所无法比拟的光谱性质,稀土发光几乎覆盖了整个固体发光的范畴,只要谈到发光,几乎离不开稀土。
稀土元素的原子具有未充满的受到外层屏蔽的4f5d电子组态,因此有丰富的电子能级和长寿命激发态,能级跃迁通道多达20余万个,可以产生多种多样的辐射吸收和发射,构成众多的发光和激光材料。
稀土化合物的发光是基于它们的4f电子在f—f组态之内或f—d组态之间的跃迁。
具有未充满的4f壳层的稀土原子或离子,其光谱大约有30000条可观察到的谱线,它们可发射从紫外光、可见光到红外光区的各种波长的电磁辐射。
稀土离子丰富的能级和4f电子的跃迁特性,使其成为巨大的发光宝库,从中可发掘出更多新型的发光材料。
第一节稀土元素基态原子的电子层构型及光谱项1、稀土元素的电子层构型稀土元素包括17种元素,即属于元素周期表中ⅢB族的15个镧系元素以及同一族的钪和钇。
钪和钇的电子层构型分别为:Sc 1s22s22p63s23p63d14s2Y 1s22s22p63s23p63d104s24p65s2镧系原子的电子层构型为:1s22s22p63s23p63d104s24p64d104f n5s25p65d n'6s2,n=0-14, n'=0或1。
镧系稀土元素电子层结构的特点是电子在外数第三层的4f轨道上填充,4f轨道的角量子数l=3,磁量子数m可取0、±1、±2、±3等7个值,故4f亚层具有7个轨道。
根据Pauli不相容原理,在同一原子中不存在4个量子数完全相同的两个电子,即一个原子轨道上只能容纳自旋相反的两个电子,4f亚层只能容纳14个电子,从La到Lu,4f电子依次从0增加到14。
形成三价稀土离子时首先失去的是6s和5d电子,使三价稀土离子具有顺序增加的4f n 电子结构,n=0,1,…,14,分别对应于La 3+,Ce 3+,…,Lu 3+离子。





稀土上转换发光及其光电产品推荐目录一、什么是上转换发光?二、镧系掺杂稀土上转换发光的发光原理三、稀土上转换发光材料的应用四、相关光电产品推荐五、几个容易混淆的“上转换”概念一、什么是上转换发光?斯托克斯(Stokes)定律认为材料只能受到高能量的光激发,发射出低能量的光,即经波长短、频率高的光激发,材料发射出波长长、频率低的光。
而上转化发光则与之相反,上转换发光是指连续吸收两个或者多个光子,导致发射波长短于激发波长的发光类型,我们亦称之为反斯托克斯(Anti-Stokes)。
Figure 1.常规发光和上转换发光能级跃迁图Figure 2.样品被绿光激光激发之后产生荧光(左边样品为Stokes emission,右边样品为Anti-stokes emission)上转换发光在有机和无机材料中均有所体现,但其原理不同。
有机分子实现光子上转换的机理是能够通过三重态-三重态湮灭(Triplet-triplet annihilation,TTA),典型的有机分子是多环芳烃(PAHs)。
无机材料中,上转换发光主要发生在镧系掺杂稀土离子的化合物中,主要有NaYF4、NaGdF4、LiYF4、YF3、CaF2等氟化物或Gd2O3等氧化物的纳米晶体。
NaYF4是上转换发光材料中的典型基质材料,比如NaYF4:Er,Yb,即镱铒双掺时,Er做激活剂,Yb作为敏化剂。
本应用文章我们着重讲讲稀土掺杂上转换发光材料(Upconversion nanoparticles,UCNPs)。
二、镧系掺杂稀土上转换发光的发光原理无机材料有三个基本发光原理:激发态吸收(Excited-state absorption, ESA),能量传递上转换(Energy transfer upconversion, ETU)和光子雪崩(Photon avalanche, PA)。
Figure 3.稀土上转换发光材料的发光原理(a)激发态吸收激发态吸收过程(ESA)是在1959年由Bloembergen等人提出,其原理是同一个离子从基态通过连续多光子吸收到达能量较高的激发态的过程,这是上转换发光最基本的发光过程。
实验1-4 荧光谱测量发布时间:2008-06-23实验1-4 荧光谱测量某些物质受到电磁辐射而激发时,它们能重新发射出相同或较长波长的光。
这种现象称为光致发光,荧光是光致发光现象中最常见的类型。
如果停止照射,则荧光很快( 10-6s)地消失。
通常所观察到的荧光现象是指物质吸收了波长较短的紫外光后发出波长较长的可见荧光。
实际上,荧光现象并不限于上述情况。
有些物质吸收了紫外光,仍然发出波长稍长的紫外荧光。
有些物质吸收了比紫外光波长短得多的X射线,然后发出波长比所吸收的X射线的波长稍长的X射线荧光,据此而建立了X射线荧光分析法。
通过测量荧光的强度,可用于定量测定许多无机和有机物质,它已成为一种很有用的分析方法,特别在生物化学方面有着广泛的应用。
通过实验学习和掌握荧光光度计测定物质荧光光谱的原理和方法;熟悉荧光分光光度计的结构及使用方法;测量物质的荧光光谱一、实验原理发光物质因引起发光的原因不同可分为:热致发光、光致发光、电场致发光、阴极射线发光、高能粒子发光及生物发光等多种发光方式。
光致发光的原理是分子在吸收了光能后,从基能态跃迁到高能态,在它们再从高能态返回基能态时,以光能的形式向外释放之前吸收的外来能量,即光致发光所发生的光。
(一)荧光的产生物质吸收光能后所产生的光辐射称之为荧光和磷光单重态和三重态。
分子中的电子运动包括分子轨道运动和分子自旋运动,分子中的电子自旋状态,可以用多重态2S+1描述,S为总自旋量子数。
若分子中没有未配对的电子,即S=0,则2S+1=1,称为单重态;若分子中有两个自旋方向平行的未配对电子,即S=1,则2S+1=3,称为三重态。
大多数分子在室温时均处在电子基态的最低振动能级,当物质分子吸收了与它所具有的特征频率相一致的光子时,由原来的能级跃迁至第一电子激发态或第二电子激发态中各个不同振动能级,其后,大多数分子常迅速降落至第一电子激发态的最低振动能级,在这一过程中它们和周围的同类分子或其他分子撞击而消耗了能量,因而不发射光。
3.1.2稀土离子的吸收光谱稀土离子吸收光谱的产生可归因于三种情况:来自f组态内的能级间的跃迁,即f→f跃迁;组态间的能级跃迁,即f→d跃迁;电荷跃迁,配体向金属离子的电荷跃迁。
1.f→f跃迁光谱指f组态内的不同J能级间跃迁所产生的光谱。
它的特点是:(1) f→f 跃迁是宇称选择规则禁阻的; 因此不能观察到气态的稀土离子的f→f跃迁光谱,由于配体场微扰,溶液和固态化合物虽能观察到相应的光谱,但相对于d-d跃迁来说,也是相当弱的,摩尔消光系数ε≈0.5lmol·cm,振动强度为10~10(指主要的跃迁类型--电偶极跃迁,这将在配合物光谱中述及)。
(2) f→f跃迁光谱是类线性的光谱。
谱带的尖锐原因是处于内层的4f电子受到5s、5p电子的屏蔽,因此受环境的影响较小,所以自由离子光谱是类原子的线性光谱,甚至在溶液和固体化合物中,也是这样的,尤其在低温条件下更为明显。
这点与d区过渡元素的d→d跃迁光谱有所区别。
d区过渡元素离子的d电子是外层电子,易受环境的影响,因而谱带变宽。
稀土离子的f→f跃迁谱带的分裂为100左右,而过渡元素的d→d跃迁的谱带分裂在1000~3000。
(3) 谱带的范围较广。
在近紫外,在可见区和近红外区内都能得到稀土离子(III)的光谱。
其中Sc、Y、La、Lu是封闭壳层结构,从基态跃迁至激发态需要较高的能量,因而它们在200-1000nm(50000~10000cm)的范围内无吸收,所以它们是无色的。
Ce、Eu、Gd、Tb虽在200~1000nm 范围内有特征的吸收带,但大部或全部吸收带均在紫外区内。
Yb的吸收带在近红外区内出现,所以Ce、Eu、Gd、Tb和Yb也是无色的。
Pr、Nd、Pm、Sm、Dy、Ho、Er、Tm有的吸收带存在于可见区内,因而它们是有色的。
RE的主要吸收峰及其消光系数列在表3.3中。
稀土离子(III)的谱带和颜色已列在表3.4中。
其中f和f组态的有相同或相近的颜色,La~Gd的颜色变化和由Gd~Lu的情况是相似的,只有Pm和Ho(f)的例外。
第二讲稀土离子的光谱特性稀土因其特殊的电子层结构,而具有一般元素所无法比拟的光谱性质,稀土发光几乎覆盖了整个固体发光的范畴,只要谈到发光,几乎离不开稀土。
稀土元素的原子具有未充满的受到外层屏蔽的4f5d电子组态,因此有丰富的电子能级和长寿命激发态,能级跃迁通道多达20余万个,可以产生多种多样的辐射吸收和发射,构成众多的发光和激光材料。
稀土化合物的发光是基于它们的4f电子在f—f组态之内或f—d组态之间的跃迁。
具有未充满的4f壳层的稀土原子或离子,其光谱大约有30000条可观察到的谱线,它们可发射从紫外光、可见光到红外光区的各种波长的电磁辐射。
稀土离子丰富的能级和4f电子的跃迁特性,使其成为巨大的发光宝库,从中可发掘出更多新型的发光材料。
第一节稀土元素基态原子的电子层构型及光谱项1、稀土元素的电子层构型稀土元素包括17种元素,即属于元素周期表中ⅢB族的15个镧系元素以及同一族的钪和钇。
钪和钇的电子层构型分别为:Sc 1s22s22p63s23p63d14s2Y 1s22s22p63s23p63d104s24p65s2镧系原子的电子层构型为:1s22s22p63s23p63d104s24p64d104f n5s25p65d n'6s2,n=0-14, n'=0或1。
镧系稀土元素电子层结构的特点是电子在外数第三层的4f轨道上填充,4f轨道的角量子数l=3,磁量子数m可取0、±1、±2、±3等7个值,故4f亚层具有7个轨道。
根据Pauli不相容原理,在同一原子中不存在4个量子数完全相同的两个电子,即一个原子轨道上只能容纳自旋相反的两个电子,4f亚层只能容纳14个电子,从La到Lu,4f电子依次从0增加到14。
形成三价稀土离子时首先失去的是6s和5d电子,使三价稀土离子具有顺序增加的4f n 电子结构,n=0,1,…,14,分别对应于La 3+,Ce 3+,…,Lu 3+离子。