【VIP专享】西南交通大学大学物理AII NO.11热力学第一定律参考答案
- 格式:pdf
- 大小:380.67 KB
- 文档页数:6


姓名 班级 序号热力学第一定律1. 定量理想气体,从同一初态出发,体积V1膨胀到V 2,分别经历三种过程,(1)等压;(2)等温;(3)绝热。
其中吸收热量最多的是 [ ](A )等压;(B )等温;(C )绝热;(D )无法判断。
解:在p-V 图上绝热线比等温线要陡,所以图中中间的曲线表示的应该是等温过程。
图中三种过程的起始态和终止态的体积分别相同,因为在p-V 图上,曲线所围成的面积等于该过程对外所做的功,所以等压过程中对外所做的功最大,等温过程次之,绝热过程最小。
根据理想气体内能2iU RT ν=,三种过程的起始温度一样,但图中所示的等压过程的末态温度最高,等温过程次之,绝热过程最小。
所以等压过程的内能增加最多。
根据热力学第一定律Q U A =∆+,既然等压过程的内能增加最多,对外所做的功也最大,等压过程从外界吸收的热量也最多,故本题答案为A 。
2.一圆柱形汽缸的截面积为222.510m -⨯,内盛有0.01kg 的氮气,活塞重10kg ,外部大气压为5110Pa ⨯,当把气体从300K 加热到800K 时,设过程进行无热量损失,也不考虑摩擦,问(1)气体做功多少?(2)气体容积增大多少?(3)内能增加多少? 解:(1)系统可以看成等压准静态过程,21VV A pdv p V ==∆⎰由理想气体状态方程m pV RT M=,得 3030.018.31(800300) 1.4810J 2810m A p V R T M -=∆=∆=⨯⨯-=⨯⨯ (2)50/ 1.0410Pa p M g S p =+=⨯活塞由状态方程0m pV RT RT M ν==(2N m M ν=),得231.4210m R T V Pν-∆∆==⨯;(3)氮气的自由度为5,由理想气体内能公式2iU RT ν=得,内能增加 33.710J 2iU R T ν∆=∆=⨯3、 一定量的某种理想气体,开始时处于压强、体积、温度分别为60102.1⨯=p P a ,3301031.8m V -⨯=,K T 3000=的初态,后经过一等容过程,温度升高到K T 4501=,再 经过一等温过程,压强降低到0p p =的末态,已知该理想气体的定压摩尔热容量和定容摩尔热容量之比35=V P C C ,求:(1)该理想气体的定压摩尔热容量P C 和定容摩尔热容量V C ;(2)气体从始态变到末态的全过程中从外界吸收的热量。

热力学第一定律课后习题一、是非题下列各题中的叙述是否正确?正确的在题后括号内画“√”,错误的画“⨯”。
1.在定温定压下,CO2由饱和液体转变为饱和蒸气,因温度不变,CO2的热力学能和焓也不变。
( )2. d U = nC V,m d T这个公式对一定量的理想气体的任何pVT过程均适用。
( )3. 一个系统从始态到终态,只有进行可逆过程才有熵变。
( )4. 25℃时H2(g)的标准摩尔燃烧焓等于25℃时H2O(g)的标准摩尔生成焓。
( )5. 稳定态单质的∆f H(800 K) = 0。
( )二、选择题选择正确答案的编号,填在各题后的括号内:1. 理想气体定温自由膨胀过程为:()。
(A)Q > 0;(B)∆U < 0;(C)W <0;(D)∆H = 0。
2. 对封闭系统来说,当过程的始态和终态确定后,下列各项中没有确定的值的是:( )。
( A ) Q;( B ) Q+W;(C ) W( Q = 0 );( D ) Q( W = 0 )。
3. pVγ = 常数(γ = C p,m/C V,m)适用的条件是:( )(A)绝热过程;( B)理想气体绝热过程;( C )理想气体绝热可逆过程;(D)绝热可逆过程。
4. 在隔离系统内:( )。
( A ) 热力学能守恒,焓守恒;( B ) 热力学能不一定守恒,焓守恒;(C ) 热力学能守恒,焓不一定守恒;( D) 热力学能、焓均不一定守恒。
5. 从同一始态出发,理想气体经可逆与不可逆两种绝热过程:( )。
( A )可以到达同一终态;( B )不可能到达同一终态;( C )可以到达同一终态,但给环境留下不同影响。
6. 当理想气体反抗一定的压力作绝热膨胀时,则:( )。
( A )焓总是不变;(B )热力学能总是增加;( C )焓总是增加;(D )热力学能总是减少。
7. 已知反应H2(g) +12O2(g) ==== H2O(g)的标准摩尔反应焓为∆r H(T),下列说法中不正确的是:()。

©物理系_2014_09《大学物理AII 》作业 No.11 热力学第一定律班级 ________ 学号 ________ 姓名 _________ 成绩 _______一、判断题:(用“T ”和“F ”表示)[ F ] 1.物体的温度愈高,所含热量愈多。
解:热量是热运动传递的能量,不是物体所含有的能量。
[ F ] 2.平衡过程就是无摩擦力作用的过程。
解:平衡过程就是准静态过程,准静态过程是指每一个中间态都可视为平衡态,是个理想过程,与是否存在摩擦无关。
一般说来,只要过程进行得无限缓慢,我们就可将该过程看成是准静态过程。
[ T ] 3.在p -V 图上任意一线段表示系统经历的准静态过程。
解:相图上一个点表示一个平衡态,一条线表示一个准静态过程。
[ T ] 4.理想气体经历绝热自由膨胀过程,初态和末态温度相等。
解:绝热自由膨胀过程中Q = 0,A = 0,由热力学第一定律,有 0=∆E ,膨胀前后T 不变。
[ F ] 5.气体的内能是温度的单值函数。
解:一般说来,气体的内能时温度和体积的函数。
对于理想气体,由于忽略了分子间的相互作用,没有分子势能,所以理想气体的内能只是温度的单值函数。
二、选择题:1. 一个绝热容器,用质量可忽略的绝热板分成体积相等的两部分。
两边分别装入质量相等、温度相同的H 2和O 2。
开始时绝热板P固定,然后释放之,板P 将发生移动(绝热板与容器壁之间不漏气且摩擦可以忽略不计)。
在达到新的平衡位置后,若比较两边温度的高低,则结果是:[ B ] (A) H 2比O 2温度高 (B) O 2比H 2温度高(C) 两边温度相等, 且等于原来的温度 (D) 两边温度相等, 但比原来的温度降低了 解:开始时,由理想气体RT MpV μ=知:绝热板两边体积V 、温度T 、质量相等的H 2和O 2气体,摩尔质量μ小的压强p 大,所以22O H p p >。
释放绝热板后,H 2膨胀而O 2被压缩,两边压强相等达到新的平衡。

第七章 热力学第一定律一 选择题1. 图为质量一定的某理想气体由初态a 经两过程到达末状态c ,其中abc 为等温过程,则 ( ) A . adc 也是一个等温过程B . adc 和abc 过程吸收的热量相等C . adc 过程和abc 过程做功相同D . abc 过程和adc 过程气体内能变化相同 解:热量和功均是过程量,内能是状态量。
故答案选D 。
2. 有两个相同的容器,容积不变,一个盛有氦气,另一个盛有氢气,(看成刚性分子),它们的压强和温度都相等,现将5J 的热量传给氢气,使氢气的温度升高,如果使氦气也升高同样的温度,则应向氦气传递热量是 ( )A . 6J B. 5J C. 3J D. 2J解:氦气是单原子分子,自由度为3,氢气是双原子分子,自由度为5。
根据理想气体的状态方程,两种气体的摩尔数相同。
容器容积不变,气体吸收的热量全部转化为内能。
再根据理想气体的内能公式,使氦气也升高同样的温度,应向氦气传递热量是3J 。
答案选C 。
3. 1mol 的单原子分子理想气体从状态A 变为状态B ,如果不知是什么气体,变化过程也不知道,但A 、B 两态的压强、体积和温度都知道,则可求出 ( )A.气体所作的功B.气体内能的变化C.气体传给外界的热量D.气体的质量解 答案:B4. 已知系统从状态A 经某一过程到达状态B ,过程吸热10J ,系统内能增量为5J 。
现系统沿原过程从状态B 返回状态A ,则系统对外作功是 ( )A. -15JB. -5JC. 5JD. 15J解 热力学第一定律的表达式W U Q +∆=,系统从A 态经某一过程到达B 态时系统做的功为5510=-=∆-=U Q W J 。
因此当系统沿原过程从B 态返回A 态时,系统对外做功为-5J 。
因此答案选B 。
5. 用公式T C U V ∆=∆m ,ν计算理想气体内能增量时,此式 ( )A. 只适用于准静态的等体过程B. 只适用于一切等体过程C. 只适用于一切准静态过程D. 适用于一切始末态为平衡态的过程选择题1图解 答案选D6. 对于室温下的双原子分子理想气体,在等压膨胀的情况下,系统对外所作的功与从外界吸收的热量之比W / Q 等于 ( )A. 2/3B.1/2C.2/5D.2/7解 答案选 D7. 理想气体初态的体积为V 1,经等压过程使体积膨胀到V 2,则在此过程中,气体对外界作 ( )A .正功,气体的内能增加B .正功,气体的内能减少C .负功,气体的内能增加D .负功,气体的内能减少解 等压膨胀过程系统对外作正功,由于压强不变体积增加,所以温度升高,因此气体的内能增加。
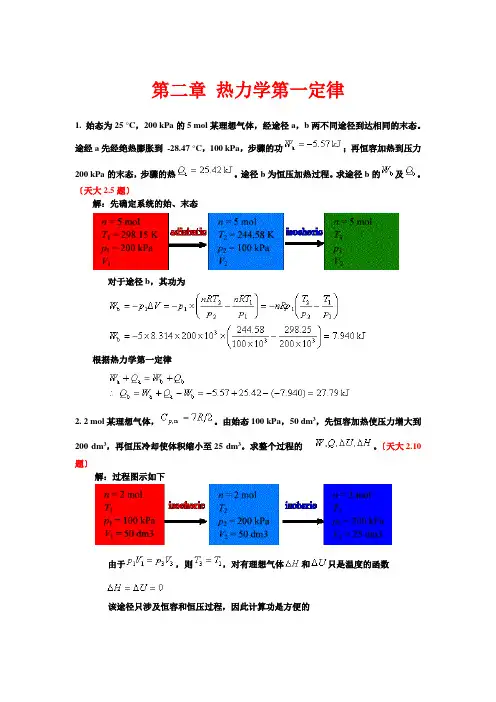
第二章热力学第一定律1. 始态为25 °C,200 kPa的5 mol某理想气体,经途径a,b两不同途径到达相同的末态。
途经a先经绝热膨胀到-28.47 °C,100 kPa,步骤的功;再恒容加热到压力200 kPa的末态,步骤的热。
途径b为恒压加热过程。
求途径b的及。
〔天大2.5题〕解:先确定系统的始、末态对于途径b,其功为根据热力学第一定律2. 2 mol某理想气体,。
由始态100 kPa,50 dm3,先恒容加热使压力增大到200 dm3,再恒压冷却使体积缩小至25 dm3。
求整个过程的。
〔天大2.10题〕解:过程图示如下由于,则,对有理想气体和只是温度的函数该途径只涉及恒容和恒压过程,因此计算功是方便的根据热力学第一定律3. 单原子理想气体A与双原子理想气体B的混合物共5 mol,摩尔分数,始态温度,压力。
今该混合气体绝热反抗恒外压膨胀到平衡态。
求末态温度及过程的。
〔天大2.18题〕解:过程图示如下分析:因为是绝热过程,过程热力学能的变化等于系统与环境间以功的形势所交换的能量。
因此,单原子分子,双原子分子由于对理想气体U和H均只是温度的函数,所以4. mol〔单原子分子〕理想气体,由、300K按以下两种不同的途径压缩到、300K,试计算并比较两途径的Q、W、ΔU及ΔH。
(1〕等压冷却,然后经过等容加热;(2)等容加热,然后经过等压冷却。
解:C p,m=2.5R, C V,m〔1〕、、、300K30.09858 dm30.09858 dm3Q=Q1+Q2××××(300-119.8)=-3745+2247=-1499(J)W=W1+W2×103×(0.09858-0.2470)+0=1499(J)ΔU=Q+W=0ΔH=ΔU+Δ(pV)××0.2470=0〔2〕、、、300K330.09858 dm3Q=Q1+Q2××××(300-751.6)=5632-9387=-3755(J)W=W1+W2×103×(0.09858-0.2470) =3755(J)ΔU=Q+W=0ΔH=ΔU+Δ(pV)××0.2470=0计算结果说明,Q、W与途径有关,而ΔU、ΔH与途径无关。


《大学物理AII 》作业No.11热力学第一定律一、选择题1.置于容器内的气体,如果气体内各处压强相等,或气体内各处温度相同,则这两种情况下气体的状态[B](A)一定都是平衡态。
(B)不一定都是平衡态。
(C)前者一定是平衡态,后者一定不是平衡态。
.(D)后者一定是平衡态,前者一定不是平衡态。
解:气体内各处压强相等或温度相等,都不一定是平衡态。
2.一定量的理想气体,开始时处于压强、体积、温度分别为1p 、1V 、1T 的平衡态,后来变到压强、体积、温度分别为2p 、2V 、2T 的终态,若已知12V V >,且12T T =,则以下各种说法中正确的是:[D](A)不论经历的是什么过程,气体对外所做的净功一定为正值。
(B)不论经历的是什么过程,气体从外界所吸的净热量一定为正值。
(C)若气体从始态变到终态经历的是等温过程,则气体吸收的热量最少。
(D)如果不给定气体所经历的是什么过程,则气体在过程中对外所做的净功和从外界吸热的正负皆无法判断。
解:∫=21d V V V p A 只适用于准静态过程,对于任意过程,无法只根据12V V >,12T T =判断A 和Q 的正负。
3.一定量的理想气体,经历某过程后,它的温度升高了。
则根据热力学定律可以断定:(1)该理想气体系统在此过程中吸了热。
(2)在此过程中外界对该理想气体系统做了正功。
(3)该理想气体系统的内能增加了。
(4)在此过程中理想气体系统既从外界吸了热,又对外做了正功。
以上正确的断言是:[C ](A)(1)、(3)。
(B)(2)、(3)。
(C)(3)。
(D)(3)、(4)。
(E)(4)解:内能是温度的单值函数,温度升高只能说明内能增加了,而功和热量都与过程有关,不能只由温度升降而判断其正负。
4.热力学第一定律表明:[C ](A)系统对外做的功不可能大于系统从外界吸收的热量。
(B)系统内能的增量等于系统从外界吸收的热量。
(C)不可能存在这样的循环过程,在此循环过程中,外界对系统做的功不等于系统传给外界的热量。

热力学第一定律习题一、单选题1) 如图,在绝热盛水容器中,浸入电阻丝,通电一段时间,通电后水及电阻丝的温度均略有升高,今以电阻丝为体系有:( )A. W =0,Q <0,U <0B. W <0,Q <0,U >0C. W <0,Q <0,U >0D. W <0,Q =0,U >02) 如图,用隔板将刚性绝热壁容器分成两半,两边充入压力不等的空气(视为理想气体),已知p右> p左,将隔板抽去后: ( )A. Q=0, W =0, U =0B. Q=0, W <0, U >0C. Q >0, W <0, U >0D. U =0, Q=W03)对于理想气体,下列关系中哪个是不正确的:( )A. (∂U/∂T)V=0B. (∂U/∂V)T=0C. (∂H/∂p)T=0D. (∂U/∂p)T=04)凡是在孤立孤体系中进行的变化,其U 和H 的值一定是:( )A. U >0, H >0B. U =0, H=0C. U <0, H <0D. U =0,H 大于、小于或等于零不能确定。
5)在实际气体的节流膨胀过程中,哪一组描述是正确的: ( )A. Q >0, H=0, p < 0B. Q=0, H <0, p >0C. Q=0, H =0, p <0D. Q <0, H =0, p <06)如图,叙述不正确的是:( )A.曲线上任一点均表示对应浓度时积分溶解热大小B.H1表示无限稀释积分溶解热C.H2表示两浓度n1和n2之间的积分稀释热D.曲线上任一点的斜率均表示对应浓度时HCl的微分溶解热7)H=Q p此式适用于哪一个过程: ( )A.理想气体从101325Pa反抗恒定的10132.5Pa膨胀到10132.5sPaB.在0℃、101325Pa下,冰融化成水C.电解CuSO4的水溶液D.气体从(298K,101325Pa)可逆变化到(373K,10132.5Pa )8) 一定量的理想气体,从同一初态分别经历等温可逆膨胀、绝热可逆膨胀到具有相同压力的终态,终态体积分别为V1、V2。

热力学第一定律习题及答案1、某绝热系统在接受了环境所做的功之后,其温度()?A、一定升高(正确答案)B、不一定改变C、一定不变D、一定降低2、对于理想气体的热力学能有下述四种理解:(1)状态一定,热力学能也一定;(2)对应于某一状态的热力学能是可以直接测定的;(3)对应于某一状态,热力学能只有一个数值,不可能有两个或两个以上的数值;(4)状态改变时,热力学能一定跟着改变。
其中都正确的是()?A、(1),(2)B、(3),(4)C、(2),(4)D、(1),(3)(正确答案)3、将某理想气体从温度T1加热到T2,若此变化为非恒容途径,则其热力学能的变化△U应为何值()?A、△U=0B、△U不存在C、(正确答案)D、△U等于其他值4、理想气体向真空绝热膨胀后,温度将()?A、不变(正确答案)B、降低C、不一定D、升高5、在373.15K、标准压力下1mol水向真空蒸发成373.15K、标准压力的水蒸气。
该过程的Q为何值()?A、Q=0B、Q=nRTC、Q=ΔHD、Q=ΔH–nRT(正确答案)6、下列过程中,系统内能变化不为零的是()?A、不可逆循环过程B、两种理想气体的混合过程C、可逆循环过程D、纯液体的真空蒸发过程(正确答案)7、关于焓的性质,下列说法中正确的是()?A、焓的增量只与系统的始末态有关(正确答案)B、焓是系统内含的热能,所以常称它为热焓C、焓是能量,它遵守热力学第一定律D、系统的焓值等于内能加体积功8、封闭体系发生的下列过程:①等温化学反应过程②理想气体等温过程③理想气体自由膨胀过程④可逆相变过程⑤气体节流膨胀过程,属于ΔU=0的有()?A、②③(正确答案)B、②⑤C、③④D、①④9、把一杯热水放在热容为10J/K的箱子中,若把箱中空气和杯中的水作为体系,则体系应为()?A、封闭体系(正确答案)B、敞开体系C、孤立体系D、绝热体系10、下述物理量中,①U;②P;③H;④V;⑤T,具有强度性质的是()?A、①⑤B、②④C、①②D、②⑤(正确答案)11、对于双原子分子理想气体Cp/Cv应为()?A、1.07B、1.40(正确答案)C、1.00D、1.2512、1mol理想气体从0℃恒容加热至100℃和从0℃恒压加热至100℃,二者的ΔU、ΔH、Q、W相同的量有()?A、ΔU、QB、ΔU、ΔH(正确答案)C、ΔU、WD、ΔH、W13、公式ΔH=Qp适用于下列过程中的哪一个()?A、298K、101.325kPa下电解CuSO4水溶液B、273K、101.325kPa下冰融化成水(正确答案)C、气体从状态Ⅰ等温可逆变化到状态ⅡD、理想气体从1013.25kPa反抗恒定的外压101.325kPa膨胀14、是()A、-1006.61kJ·mol-1B、675.05kJ·mol-1(正确答案)C、1006.61kJ·mol-1D、-675.05kJ·mol-115、()?A、B、C、D、(正确答案)16、没有非体积功条件下,系统的焓变∆H等于等压热。

高三物理热力学第一定律试题答案及解析1.(5分)关于一定量的理想气体,下列说法正确的是 (填正确答案标号。
选对1个得2分,选对2个得4分,选对3个得5分,每选错1个扣3分,最低得分为0分).A.气体分子的体积是指每个气体分子平均所占有的空间体积B.只要能增加气体分子热运动的剧烈程度,气体的温度就可以升高C.在完全失重的情况下,气体对容器壁的压强为零D.气体从外界吸收热量,其内能不一定增加E. 气体在等压膨胀过程中温度一定升高。
【答案】BDE【解析】每个气体分子平均所占有的空间体积比气体分子的体积要大得多,选项A 错误;温度是分子平均动能的标志,则只要能增加气体分子热运动的剧烈程度,气体的温度就可以升高,选项B正确;气体的压强不是由气体的重力产生的,所以在完全失重的情况下,气体对容器壁的压强也不为零,选项C错误;根据热力学第一定律,气体从外界吸收热量,若同时对外做功,则其内能不一定增加,选项D 正确;根据可知气体在等压膨胀过程中温度一定升高,选项E 正确。
【考点】温度;气体的压强;热力学第一定律;气态方程。
2.如图所示,用销钉固定的导热活塞把水平放置的导热汽缸分隔成容积相同的两部分,分别封闭着A、B两部分理想气体:A部分气体压强为pAO =2.5×105 Pa,B部分气体压强为pBO=1.5×105Pa.现拔去销钉,待活塞重新稳定后.(外界温度保持不变,活塞与汽缸间摩擦可忽略不计,整个过程无漏气发生)①求此时A部分气体体积与原来体积之比;②判断此过程中A部分气体是吸热还是放热,并简述理由.【答案】①5∶4. ②吸热 A部分气体由于温度不变,所以内能不变;体积膨胀,对外做功,由热力学第一定律可知,一定从外界吸收热量.【解析】①设A部分气体原来体积为V,由玻意耳定律得p A0V=pA(V+ΔV)p B0V=pB(V-ΔV)又pA =pB由以上各式可解得ΔV=V,因此,A部分气体此时体积与原来体积之比为5∶4.②吸热.A部分气体由于温度不变,所以内能不变;体积膨胀,对外做功,由热力学第一定律可知,一定从外界吸收热量.【考点】本题考查1气体状态方程和热力学第一定律。
《热力学第一定律》习题及答案选择题1.热力学第一定律ΔU=Q+W 只适用于()(A) 单纯状态变化 (B) 相变化 (C) 化学变化 (D) 封闭物系的任何变化答案:D2.关于热和功, 下面的说法中, 不正确的是(A) 功和热只出现于系统状态变化的过程中, 只存在于系统和环境间的界面上(B) 只有在封闭系统发生的过程中, 功和热才有明确的意义(C) 功和热不是能量, 而是能量传递的两种形式, 可称之为被交换的能量(D) 在封闭系统中发生的过程中, 如果内能不变, 则功和热对系统的影响必互相抵消答案:B2.关于焓的性质, 下列说法中正确的是()(A) 焓是系统内含的热能, 所以常称它为热焓 (B) 焓是能量, 它遵守热力学第一定律(C) 系统的焓值等于内能加体积功 (D) 焓的增量只与系统的始末态有关答案:D。
因焓是状态函数。
3.涉及焓的下列说法中正确的是()(A) 单质的焓值均等于零 (B) 在等温过程中焓变为零 (C) 在绝热可逆过程中焓变为零(D) 化学反应中系统的焓变不一定大于内能变化答案:D。
因为焓变ΔH=ΔU+Δ(pV),可以看出若Δ(pV)<0则ΔH<ΔU。
4.下列哪个封闭体系的内能和焓仅是温度的函数()(A) 理想溶液(B) 稀溶液(C) 所有气体(D) 理想气体答案:D5.与物质的生成热有关的下列表述中不正确的是()(A) 标准状态下单质的生成热都规定为零 (B) 化合物的生成热一定不为零 (C) 很多物质的生成热都不能用实验直接测量(D) 通常所使用的物质的标准生成热数据实际上都是相对值答案:A。
按规定,标准态下最稳定单质的生成热为零。
6.dU=CvdT及dUm=Cv,mdT适用的条件完整地说应当是()(A) 等容过程 (B)无化学反应和相变的等容过程 (C) 组成不变的均相系统的等容过程(D) 无化学反应和相变且不做非体积功的任何等容过程及无反应和相变而且系统内能只与温度有关的非等容过程答案:D7.下列过程中, 系统内能变化不为零的是()(A) 不可逆循环过程 (B) 可逆循环过程 (C) 两种理想气体的混合过程 (D) 纯液体的真空蒸发过程答案:D。
热力学第一定律习题答案热力学第一定律习题答案热力学第一定律是热力学中最基本的定律之一,也被称为能量守恒定律。
它表明能量在系统中的转化过程中,能量的增减等于能量的输入减去能量的输出。
在热力学中,我们经常会遇到一些与热力学第一定律相关的习题。
下面,我将为大家提供一些常见习题的答案,希望对大家的学习有所帮助。
习题1:一个物体的内能增加了100 J,同时对外做了60 J的功,该物体从外界获得了多少热量?答案:根据热力学第一定律,能量的增减等于能量的输入减去能量的输出。
因此,物体从外界获得的热量等于内能的增加减去对外做的功。
即热量 = 内能增加 - 对外做的功 = 100 J - 60 J = 40 J。
习题2:一个系统吸收了200 J的热量,同时对外做了100 J的功,系统的内能发生了什么变化?答案:根据热力学第一定律,能量的增减等于能量的输入减去能量的输出。
因此,系统的内能的变化等于系统吸收的热量减去对外做的功。
即内能的变化 = 吸收的热量 - 对外做的功 = 200 J - 100 J = 100 J。
习题3:一个物体从初始状态A经过一系列过程后回到了状态A,系统对外做的功为-200 J,系统从外界吸收的热量为-300 J,系统的内能发生了什么变化?答案:根据热力学第一定律,能量的增减等于能量的输入减去能量的输出。
在这个问题中,系统对外做的功和从外界吸收的热量都是负值,表示系统向外界做功和向外界释放热量。
因此,系统的内能的变化等于系统吸收的热量减去对外做的功。
即内能的变化 = 吸收的热量 - 对外做的功 = -300 J - (-200 J) = -100 J。
习题4:一个系统吸收了200 J的热量,同时对外做了100 J的功,系统的内能发生了什么变化?答案:根据热力学第一定律,能量的增减等于能量的输入减去能量的输出。
因此,系统的内能的变化等于系统吸收的热量减去对外做的功。
即内能的变化 = 吸收的热量 - 对外做的功 = 200 J - 100 J = 100 J。
第二章 热力学第一定律2-1 1mol 理想气体于恒定压力下升温1℃,试求过程中气体与环境交换的功W 。
解:体系压力保持恒定进行升温,即有P外=P ,即反抗恒定外压进行膨胀,JT nR nRT nRT pV pV V V p W amb 314.8)(121212-=∆-=+-=+-=--=2-2 系统由相同的始态经过不同途径达到相同的末态。
若途径a 的Q a =2.078kJ ,W a = -4.157kJ ;而途径b 的Q b = -0.692kJ 。
求W b 。
解:应用状态函数法。
因两条途径的始末态相同,故有△U a =△U b ,则 b b a a W Q W Q +=+ 所以有,kJ Q W Q W b a a b 387.1692.0157.4078.2-=+-=-+=2-3 4mol 某理想气体,温度升高20℃,求△H -△U 的值。
解: 方法一: 665.16J208.3144 )20()( 2020,,20,20,=⨯⨯=-+==-=-=∆-∆⎰⎰⎰⎰++++T K T nR nRdT dT C C n dTnC dT nC U H K T TKT Tm V m p KT Tm V K T T m p方法二:可以用△H=△U+△(PV)进行计算。
2-4 某理想气体, 1.5V m C R =。
今有该气体5 mol 在恒容下温度升高50℃,求过程的W ,Q ,△H 和△U 。
解:恒容:W=0; kJJ K nC T K T nC dT nC U m V m V K T Tm V 118.33118503145.823550 )50(,,50,==⨯⨯⨯=⨯=-+==∆⎰+kJJ KR C n T K T nC dT nC H m V m p KT Tm p 196.55196503145.8255 50)()50(,,50,==⨯⨯⨯=⨯+==-+==∆⎰+根据热力学第一定律,:W=0,故有Q=△U=3.118kJ2-5 某理想气体, 2.5V m C R =。
第一章热力学第一定律习题参考答案选择题1.[答](B)2.[答](A)因为整个刚性绝热容器为体系,与环境无功和热的传递。
3.[答(D)4.[答](B)5.[答](A )6.[答](c)7.[答](B)8.[劄(B) 9.[答](D) 10.[答](D) 11.[答](B) 12.[答](B)13.[劄(C) 14.[答](C) 15.[答](B) 16.[答](D)17.[劄(D) △ U=Cv △ T=(3/2)R{(P 仃1/P 2)-T 1 18.[答](B)19.[劄(D)20.[答](C) 21.[答](A ) 填空题1. [答]一定大于(因为H = U + PV); 一定大于;因为△ H = △ U + ( △ n)RT,而△ n为正。
2. [答]△ U = 0 △ H = 03. [答]波义耳(Boyle's) 零4. [答](A ) = (b) = (c) > (d) >5. [答]0 ; P2V2- P 1V16. [答]Q v- Q p= △ nRT = -4988 J7. [答]△ r H m = Q p= Q v+ △ nRT_1△ c H m = (1/2) △ r H= -285.7 kJ.mol8. [答]△ r U m= -4816 kJ.mol -1△ r H m = -4826 kJ.mol -19. [答]△ G= ( E C P,B) (生成物)- (E C P,B) (反应物)10. [答]改变分子的能级;改变在分子能级上分布的分子数三.问答题:1. [答]只能看作绝热体系2. [答]前句不对。
(例:绝热膨胀,温度有变化但不吸热)后句也不对。
(例:相变过程,温度可以不变,但有热量变化)3. [答]错。
因为:(1) Q V为恒容条件下传递的能量,总是与过程伴随着的物理量。
(2) 当存在非体积功时,△ U = Q V- W f,△ U K Q V4. [答]不会沸腾。