药物不良反应登记表
- 格式:doc
- 大小:32.00 KB
- 文档页数:1

药物副作用登记表(模板)药物信息
- 药物名称:[药物名称]
- 批准使用途径:[口服/注射/外用等]
- 剂量:[每次剂量]
- 使用频率:[每天/每周等]
- 使用期限:[持续使用时间]
病人信息
- 姓名:[病人姓名]
- 年龄:[病人年龄]
- 性别:[病人性别]
- 病史:[是否有相关病史]
副作用登记
备注
[添加任何额外信息或观察记录]
请注意:药物副作用登记表旨在记录病人在使用特定药物时可能出现的副作用。
还请同时记录病人可能的过敏史、用药史、家族病史等相关信息,以便更全面地评估副作用的发生及严重程度。
如果病人出现严重的副作用或过敏反应,请停止使用药物并尽快咨询医生或专业人士。

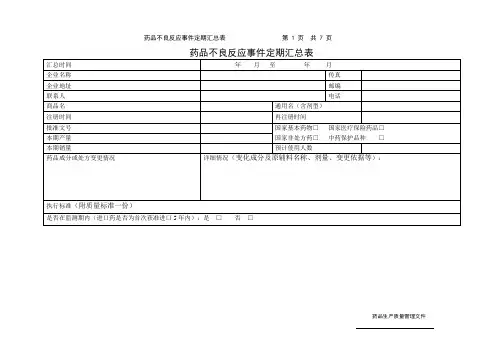
附表1
药品不良反应 / 事件报告表
首次报告□跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
(注:文档可能无法思考全面,请浏览后下载,供参考。
可复制、编制,期待你的好评与关注)。

附表1
药品不良反应 / 事件报告表
首次报告□跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
精品
欢迎您的下载,资料仅供参考。
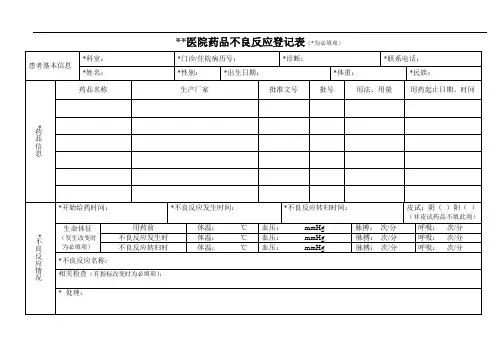

附表1药品不良反应/事件报告表首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□患者姓名:性别:男□女□出生日期:年月日或年龄:民族:体重(kg):联系方式:原患疾病:医院名称:既往药品不良反应/事件:有□无□不详□病历号/门诊号:家族药品不良反应/事件:有□无□不详□相关重要信息:吸烟史□饮酒史□妊娠期□肝病史□肾病史□过敏史□其他□药品批准文号商品名称通用名称(含剂型)生产厂家生产批号用法用量(次剂量、途径、日次数)用药起止时间用药原因怀疑药品并用药品不良反应/事件名称:不良反应/事件发生时间:年月日不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页):不良反应/事件的结果:痊愈□好转□未好转□不详□有后遗症□表现:死亡□直接死因:死亡时间:年月日停药或减量后,反应/事件是否消失或减轻?是□否□不明□未停药或未减量□再次使用可疑药品后是否再次出现同样反应/事件?是□否□不明□未再使用□对原患疾病的影响:不明显□病程延长□病情加重□导致后遗症□导致死亡□关联性评价报告人评价:肯定□很可能□可能□可能无关□待评价□无法评价□签名:报告单位评价:肯定□很可能□可能□可能无关□待评价□无法评价□签名:联系电话:职业:医生□药师□护士□其他□报告人信息电子邮箱:签名:报告单位信息单位名称:联系人:电话:报告日期:年月日生产企业请填写信息来源医疗机构□经营企业□个人□文献报道□上市后研究□其他□备注严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:1)导致死亡;2)危及生命;3)致癌、致畸、致出生缺陷;4)导致显著的或者永久的人体伤残或者器官功能的损伤;5)导致住院或者住院时间延长;6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
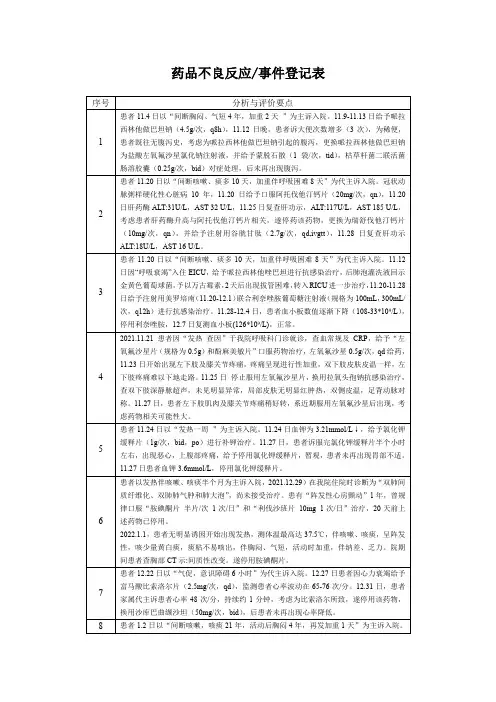

药物副作用及药害事件登记表概述本文档是为了记录和管理药物副作用及药害事件而制定的登记表。
该登记表旨在帮助医疗机构和相关部门收集、分析和跟踪药物使用过程中发生的任何副作用或药害事件。
通过及时记录和分析这些事件,我们可以及早发现和解决药物安全问题,保障患者的健康和安全。
登记表格登记内容登记表包括以下重要信息:1. 患者信息* 患者姓名* 患者性别* 患者年龄* 患者联系方式2. 药物信息* 药品名称* 药品批号* 药品厂家* 药物剂量和使用频率3. 副作用描述* 副作用的性质和症状* 副作用开始时间* 副作用严重程度(轻微、中等、严重)4. 医疗机构信息* 医疗机构名称* 医疗机构联系方式* 登记人员姓名5. 其他相关信息* 患者病史* 其他正在使用的药物* 是否曾经发生过类似副作用* 是否停止使用该药物登记程序以下是药物副作用及药害事件的登记程序:1. 当医务人员或患者发现药物副作用或药害事件时,立即将事件记录下来。
2. 医务人员将登记表格填写完整,并确保所有必要的信息都被准确记录。
3. 登记表格应尽快提交给医疗机构内的药事服务部门或负责药物安全管理的部门。
4. 药事服务部门或药物安全管理部门将对登记表格进行审核和分析。
他们可能与医务人员进一步沟通,以了解更多细节。
5. 登记表格中所记录的副作用和事件将被用于药物安全的评估和监测过程。
数据保密登记表格中的个人身份信息和医疗机构信息应当被妥善保密。
只有授权人员在合法的情况下才能访问这些信息。
医疗机构应采取相应的措施来确保数据的安全和隐私。
总结药物副作用及药害事件登记表是一个重要的工具,用于收集和管理药物使用过程中出现的副作用和药害事件。
通过及时记录和分析这些事件,我们可以提高药物安全水平,确保患者的健康和安全。
医务人员和药品管理部门应共同努力,保障登记程序的顺利进行,并对登记的信息保密性负责。


药物不良反应登记本
药物不良反应
登记本
XXX
1
注:每本50页,印100本
药品不良反应报告管理制度
一、药品不良反应、医疗器械不良事件的报告范围:
1、上市5年以内的药品、医疗器械和列入国家重点检测的药品、医疗器械,引起的所有不良反应事件
2、上市5年以内的药品、医疗器械,引起的严重、罕见的或新的不良反应。
二、药品不良反应主要包括药品已知和未知作用引起的副作用、毒性反应及过敏反应等。
三、一经发现可疑药品不良反应需详细记录、调查,按规定要求对典型病例详细填写《药品不良反应情况登记表》,并按规定报告。
四、应定期收集、汇总、分析药品不良反应信息,每季度直接向当地药品不良反应检测中心报告,严重、罕见的或新的药品、医疗器械(事件)不良反应病例,最迟不得超过15个工作日。
药品副作用登记表项目信息
- 药品名称: [填写药品名称]
- 通用名: [填写药品通用名]
- 生产厂商: [填写生产厂商]
- 批号: [填写药品批号]
- 规格: [填写药品规格]
患者信息
- 姓名: [填写患者姓名]
- 性别: [填写患者性别]
- 年龄: [填写患者年龄]
- 身高: [填写患者身高]
- 体重: [填写患者体重]
副作用描述
请在下面的表格中填写与该药品相关的副作用信息:
就诊信息
- 就诊医院: [填写就诊医院]
- 就诊科室: [填写就诊科室]
- 就诊时间: [填写就诊时间]
- 诊断结果: [填写诊断结果]
其他信息
请在下面的文本框中填写其他与该药品副作用相关的信息:
[填写其他信息]
注意:请确保填写的信息准确无误,并在每项信息后面添加相应的内容。
如需进一步详细信息,建议与医生或药店咨询。
提交
请将填写完整的药品副作用登记表提交给相关的医疗机构或药店,以确保副作用信息得到适当的记录和处理。