循环伏安法测定亚铁氰化钾的浓度
- 格式:docx
- 大小:328.43 KB
- 文档页数:4

[实验目的]1) 学习固体电极表面的处理方法。
2) 掌握循环伏安仪的使用技术。
3) 了解扫描速率和浓度对循环伏安图的影响。
[实验原理]铁氰化钾离子-亚铁氰化钾离子:])([])([6463CN Fe K CN Fe K ⇔氧化还原电对的标准电极电位:V 36.00=ϕ峰电流方程: 循环伏安法产生氧化电流。
为了使液相传质过程只受扩散控制,应在加入电解质和溶液处于静止下进行电解。
实验前电极表面要处理干净。
在0.10 mol.L -1 NaCl 溶液中[Fe(CN)6]的扩散系数为0.63×10-5 cm.s -1;电子转移速率大,为可逆体系(1.0 mol.L -1 NaCl 溶液中,25℃时,标准反应速率常数为5.2×10-2 cm ·s -1)。
[注意事项和问题]1.实验前电极表面要处理干净。
2. 扫描过程保持溶液静止。
3. 若实验中测得的条件电极电位和与文献值有差异,说明其原因。
53/21/21/2p 2.6910i n ACD v =⨯i —E 曲线[实验步骤]1. 指示电极的预处理铂电极用Al 2O 3粉末(粒径0.05 µm)将电极表面抛光,然后用蒸馏水超声清洗3min.。
2.配制溶液配制2⨯10-2、2⨯10-3 、8⨯10-4、2⨯10-4 mol ·L -1的K 3[Fe(CN)6]溶液。
3. 不同扫描速率K 3[Fe(CN)6]溶液的循环伏安图先对10-3mol·L -1K 3 [Fe(CN)6]溶液(含支持电解质KNO 3浓度为0.50 mol·L -1, 通氮气除氧5min )以20mV/s 在+0.8至-0.2V 电位范围内扫描循环伏安图。
再对上述溶液以10、40、60、80、100、200mV/s ,在+0.8至-0.2V 电位范围内扫描,分别记录循环伏安图。
4. 不同浓度K 3[Fe(CN)6]溶液的循环伏安图在10-4、4⨯10-4、10-2 mol·L -1 K 3[Fe(CN)6]溶液(均含支持电解质KNO 3浓度为0.50 mol·L -1, 通氮气除氧5min )中,以20mV/s ,在-0.2至+0.8V 电位范围内扫描,分别记录循环伏安图。

10循环伏安法测定亚铁氰化钾循环伏安法是一种重要的电化学分析方法,能够对材料的电子结构和化学反应进行表征。
本文将以亚铁氰化钾为例,介绍如何通过循环伏安法来测定其电化学性质。
一、原理循环伏安法通过在两个电极上施加一定电压,并记录电流随时间的变化,从而探测被测试物质的电化学性质。
具体来说,该方法的基本原理如下:当两个电极处于化学反应体系中时,它们之间的电压将导致一些电荷在电解质中移动。
这些移动的电荷会引发电流的变化,在循环伏安曲线中呈现为一系列的红氧电位对(根据溶液pH值,实验时可能使用氢氧化钠和硝酸钾来调节电位)。
此外,伏安法还可以利用氧化还原反应来对化合物进行定量分析。
对于亚铁氰化钾,在伏安曲线上它的还原峰是特别明显的,因此继续对这种化合物进行分析的话,可以对还原峰的参数进行计算。
根据法拉第第一定律,还原峰的面积可以表示还原物质的数量。
进一步地,还原峰的峰高和它的半宽则可以用来推断电极和电解质之间的电荷转移速率和均匀性。
而还原和氧化峰之间的电压差则可以用来计算化学反应的电动势。
二、实验步骤1、制备溶液亚铁氰化钾一般用0.1M的KCl溶液来进行循环伏安实验。
制备KCl溶液时,首先要称取出一定量的KCl,将其加入去离子水中并搅拌,使其充分溶解。
然后,用清水或HCl进行中和,使其pH值达到7左右。
根据需要进行调整,确保连接质心穿过pH中性点。
2.电极的准备在进行实验前,需要先准备电极。
普通的三电极系统通常由工作电极、参比电极和对电极组成,其中工作电极通常是超薄玻碳电极或铂电极。
参比电极一般是Ag/AgCl电极,对电极为铂网电极。
首先,要将工作电极和参比电极分别清洁。
将它们浸入去离子水或酒精中去除表面的沉积物。
如果它们仍然有膜残留,可以使用氨水清洗。
接下来,把工作电极和参比电极放置在酒精和水混合物中,让它们干燥。
然后,在工作电极上沾上一层磨粒,这将帮助均匀分布电极的磨损。
最后,将电极官网在HF溶液中刷洗,这将清除电极的铅,切确地确定表面积。

循环伏安法测定铁氰化钾电极反应过程一、实验目的:(1) 学习固体电极表面的处理方法;(2) 掌握循环伏安仪的使用技术;(3) 了解扫描速率和浓度对循环伏安图的影响二、试验原理循环伏安法(CV)是最重要的电分析化学研究方法之一。
在电化学、无机化学、有机化学、生物化学等研究领域得到了广泛应用。
由于其操作简便、图谱解析直观,因而一般是电分析化学的首选方法。
CV方法是将循环变化的电压施加于工作电极和参比电极之间,记录工作电极上得到的电流与施加电压的关系曲线。
这种方法也常称为三角波线性电位扫描方法。
图1中表明了施加电压的变化方式:起扫电位为+0.8V,反向/起扫电位为-0.2V,终点又回扫到+0.8V,扫描速度可从斜率反映出来,其值为50mV/s。
虚线表示的是第二次循环。
一台现代伏安仪具有多种功能,可方便地进行一次或多次循环,任意变换扫描电压范围和扫描速度。
当工作电极被施加的扫描电压激发时,其上将产生响应电流。
以该电流(纵坐标)对电位(横坐标)作图,称为循环伏安图。
典型的循环伏安图如图2所示。
该图是在1.0mol/L的KNO3电解质溶液中,6×10-3mol/L 的K3Fe(CN)6在Pt工作电极上反应得到的结果。
从图可见,起始电位Ei为+0.8V(a点),电位比较正的目的是为了避免电极铁氰化钾电解。
在一定扫描速率下,从起始电位(0.8V)正向扫描到转折电位(0.181V)期间,溶液中[Fe(CN)6]3-被还原生成[Fe(CN)6]4-,产生阴极电流(b点);随着电位变负,阴极电流迅速增加(bcd曲线),直至电极极表面[Fe(CN)6]3-浓度趋近零,电流在d点达到高峰,然后迅速衰减(def)因为表面附近溶液中的[Fe(CN)6]3-几乎全部转变为[Fe(CN)6]4-而耗尽,即所谓贫乏效应,当电压扫直-0.15v,虽然已经转向开始阳极扫描,但此时电极电位相当负,扩散至电极表面的[Fe(CN)6]3-仍在不断还原,故仍呈阴极电流而不是阳极电流。

循环伏安法测定铁氰化钾电极反应过程一、实验目的:(1) 学习固体电极表面的处理方法;(2) 掌握循环伏安仪的使用技术;(3) 了解扫描速率和浓度对循环伏安图的影响二、试验原理循环伏安法(CV)是最重要的电分析化学研究方法之一。
在电化学、无机化学、有机化学、生物化学等研究领域得到了广泛应用。
由于其操作简便、图谱解析直观,因而一般是电分析化学的首选方法。
CV方法是将循环变化的电压施加于工作电极和参比电极之间,记录工作电极上得到的电流与施加电压的关系曲线。
这种方法也常称为三角波线性电位扫描方法。
图1中表明了施加电压的变化方式:起扫电位为+0.8V,反向/起扫电位为-0.2V,终点又回扫到+0.8V,扫描速度可从斜率反映出来,其值为50mV/s。
虚线表示的是第二次循环。
一台现代伏安仪具有多种功能,可方便地进行一次或多次循环,任意变换扫描电压范围和扫描速度。
当工作电极被施加的扫描电压激发时,其上将产生响应电流。
以该电流(纵坐标)对电位(横坐标)作图,称为循环伏安图。
典型的循环伏安图如图2所示。
该图是在1.0mol/L的KNO3电解质溶液中,6×10-3mol/L 的K3Fe(CN)6在Pt工作电极上反应得到的结果。
从图可见,起始电位Ei为+0.8V(a点),电位比较正的目的是为了避免电极铁氰化钾电解。
在一定扫描速率下,从起始电位(0.8V)正向扫描到转折电位(0.181V)期间,溶液中[Fe(CN)6]3-被还原生成[Fe(CN)6]4-,产生阴极电流(b点);随着电位变负,阴极电流迅速增加(bcd曲线),直至电极极表面[Fe(CN)6]3-浓度趋近零,电流在d点达到高峰,然后迅速衰减(def)因为表面附近溶液中的[Fe(CN)6]3-几乎全部转变为[Fe(CN)6]4-而耗尽,即所谓贫乏效应,当电压扫直-0.15v,虽然已经转向开始阳极扫描,但此时电极电位相当负,扩散至电极表面的[Fe(CN)6]3-仍在不断还原,故仍呈阴极电流而不是阳极电流。

循环伏安法测定铁氰化钾的电极反应过程[实验目的]1) 学习固体电极表面的处理方法。
2) 掌握循环伏安仪的使用技术。
3) 了解扫描速率和浓度对循环伏安图的影响。
[实验原理]铁氰化钾离子-亚铁氰化钾离子:])([])([6463CN Fe K CN Fe K ⇔ 氧化还原电对的标准电极电位:V 36.00=ϕ 峰电流方程:循环伏安法在一定扫描速率下,从起始电位(+0.8V )正向扫描到转折电位(-0.2 V )期间,溶液中[Fe(CN)6]3- -被还原生成[Fe(CN)6]4-,产生还原电流;当负向扫描从转折电位(-0.2 V )变到原起始电位(+0.8 V )期间,在指示电极表面生成的 [Fe(CN)6]4-被氧化生成[Fe(CN)6]3-,产生氧化电流。
53/21/21/2p2.6910i n ACD v =⨯为了使液相传质过程只受扩散控制,应在加入电解质和溶液处于静止下进行电解。
实验前电极表面要处理干净。
在0.10 mol.L -1 NaCl 溶液中[Fe(CN)6]的扩散系数为0.63×10-5 cm.s -1;电子转移速率大,为可逆体系(1.0 mol.L -1 NaCl 溶液中,25℃时,标准反应速率常数为5.2×10-2 cm ·s -1)。
[注意事项和问题]1.实验前电极表面要处理干净。
2. 扫描过程保持溶液静止。
3. 若实验中测得的条件电极电位和与文献值有差异,说明其原因。
i —E曲线循环伏安法测定铁氰化钾的电极反应过程[实验步骤]1. 指示电极的预处理铂电极用Al 2O 3粉末(粒径0.05 µm)将电极表面抛光,然后用蒸馏水超声清洗3min.。
2.配制溶液配制2⨯10-2、2⨯10-3 、8⨯10-4、2⨯10-4 mol ·L -1的K 3[Fe(CN)6]溶液。
3. 不同扫描速率K 3[Fe(CN)6]溶液的循环伏安图先对10-3mol·L -1K 3 [Fe(CN)6]溶液(含支持电解质KNO 3浓度为0.50 mol·L -1, 通氮气除氧5min )以20mV/s 在+0.8至-0.2V 电位范围内扫描循环伏安图。


实验四循环伏安法研究铁氰化钾的电极反应过程一、实验目的(1)学习电化学工作站的使用及固体电极表面的处理方法(2)掌握用循环伏安法判断电极过程的可逆性二、实验原理循环伏安法(CV法)是以等腰三角形的脉冲电压加在工作电极上,在电极上施加线形扫描电压,从设定的起始电压开始扫描,到达设定的终止电压后,再反向回扫至设定的起始电压。
如果前半部分电压由高向低扫描,电活性物质在电极上还原(Ox + n e Red),产生还原波;则后半部分电压由低向高扫描时,还原产物又会在电极上氧化(Red -n e Ox),产生氧化波。
得到的电流~电压曲线(i ~ E曲线)称为循环伏安图(CV图)。
一次三角波扫描,完成一个还原和氧化过程的循环。
Fe(CN)63- + e Fe(CN)64-铁氰化钾(K3Fe(CN)6)的峰电流(i p)与电极表面活度的关系式为:式中,n、c和v分别为电活性物质的电子转移数、浓度和扫描速率。
i p与v1/2、c成正比。
对于可逆体系,氧化峰电流(i pa)与还原峰电流(i pc)之比i pa / i pc≈ 1,氧化峰电位(E pa)与还原峰电位(E pc)之差∆E p = E pa- E pc≈ 0.059/n,条件电位Eө' = (E pa + E pc)/2。
如果电活性物质可逆性差,则氧化波与还原波的高度就不同,对称性也较差,∆E p > 0.059/n,i pa / i pc < 1。
甚至只有一个氧化或还原峰,电极过程即为不可逆。
由此可判断电极反应过程的可逆性。
三、仪器和试剂(1)仪器:CHI620E电化学工作站、三电极系统(玻碳电极、铂丝电极、参比电极)(2)试剂:1.0 × 10-2 mol·L-1 K3Fe(CN)6溶液、1.0 mol·L-1 KNO3溶液四、实验步骤1. 玻碳电极的处理用Al2O3粉将电极表面抛光,用去离子水清洗,超声。

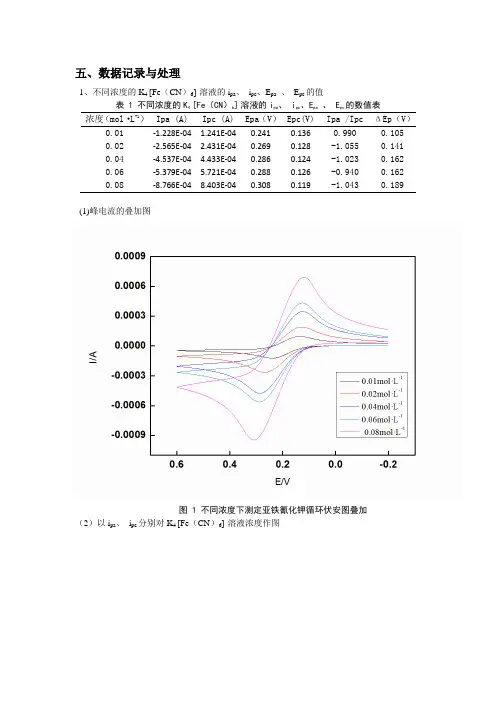
五、数据记录与处理1、不同浓度的K4 [Fe(CN)6]溶液的i pa、i pc、E pa、E pc的值表 1 不同浓度的K4 [Fe(CN)6]溶液的i pa、 i pc、E pa、 E pc的数值表浓度(mol·L-1)Ipa (A) Ipc (A) Epa(V)Epc(V) Ipa /Ipc ΔEp(V)0.01 -1.228E-04 1.241E-04 0.241 0.136 0.990 0.1050.02 -2.565E-04 2.431E-04 0.269 0.128 -1.055 0.1410.04 -4.537E-04 4.433E-04 0.286 0.124 -1.023 0.1620.06 -5.379E-04 5.721E-04 0.288 0.126 -0.940 0.1620.08 -8.766E-04 8.403E-04 0.308 0.119 -1.043 0.189(1)峰电流的叠加图图 1 不同浓度下测定亚铁氰化钾循环伏安图叠加(2)以i pa、i pc分别对K4 [Fe(CN)6]溶液浓度作图图 2 氧化峰电流及还原峰电流与亚铁氰化钾浓度关系图由图知:峰电流与浓度呈线性正比关系2、不同扫描速率下0.04mol/L的氰化亚铁溶液的I pa、I pc、E pa、E pc表2不同扫描速率下0.04mol/L的氰化亚铁溶液的I pa、I pc、E pa、E pc数值表V(V·s-1) V^(1/2) Ipa (A) Ipc (A) Epa(V)Epc(V) Ipa /Ipc ΔEp(V)0.02 0.1414 2.459E-04 2.377E-04 0.265 0.145 1.034 0.1200.04 0.2000 -3.305E-04 3.155E-04 0.278 0.135 -1.048 0.1430.06 0.2449 -3.869E-04 3.662E-04 0.287 0.129 -1.057 0.1580.08 0.2828 -4.290E-04 4.021E-04 0.295 0.122 -1.067 0.1730.10 0.3162 -4.627E-04 4.564E-04 0.301 0.116 -1.014 0.185(1)峰电流的叠加图(2)分别以Ipa 和Ipc对V1/2作图,说明峰电流与扫描速率间的关系图 4 氧化峰电流及还原峰电流与扫描速率的关系图由图可知:峰电流ip与V1/2成正比3.电极的表面积i P=2.69×105n3/2D1/2v1/2Ac其中n为电子转移数,D为扩散系数(cm2/s),v为电位扫描速率(V/s)K4 [Fe(CN)6]的扩散系数D=6.61×10-6 cm2/s,n=1,c=0.04mol/L且由图又有i p=k v1/2k为i p与v1/2关系图的斜率k=1.21×10-3(选取R2较大的斜率)故k=2.69×105AD1/2c则A= k/(2.69×105D1/2c)= 4.3x10-5cm24.从上述数据中均可以看出i pa∕i pc近似等于1,可以判定其为可逆电极,ΔEp 与59mV相差较远,可能原因在于磨电极时处理的ΔEp较大,在100mV以上,故而误差较大。

题目:循环伏安法测定亚铁氰化钾学校:陕西师范大学院系:化学化工学院姓名:党文姣学号: 413072622015年11月29日实验目的1、学习固体电极表面的处理方法。
2、掌握电化学工作站中循环伏安程序的使用技术。
3、了解扫描速率和浓度对循环伏安图的影响实验原理铁氰化钾离子-亚铁氰化钾离子氧化还原电对的标准电极电位为:[Fe(CN)6]3- + e- = [Fe(CN)6]4-= 0.36V (vs.NHE)电极电位与电极表面活度的Nernst方程为:φ=φθ+RTFlnc Oxc Red峰电流与电极表面活度的Cotroll方程i p=2.69×105n3/2AD1/2v1/2c其中:i p为峰电流;n为电子转移数;D为扩散系数;v为电压扫描速度;A为电极面积;c为被测物质浓度。
从循环伏安图可获得氧化峰电流i pa与还原峰电流i pc,氧化峰电位ψpa与还原峰电位ψpc。
对于可逆体系,氧化峰电流i pa与还原峰电流i pc绝对值的比值i pai pc≈1氧化峰电位ψpa与还原峰电位ψpc电位差为::∆ψ=ψpa−ψpc=2.2RTnF≈0.058nV条件电位ψθ为:ψθ‘=ψpa+ψpc2在一定扫描速率下,从起始电位(-0.2 V)正向扫描到转折电位(+0.6 V)期间,溶液中[Fe(CN)6]4-被氧化生成[Fe(CN)6]3-,产生氧化电流;当负向扫描从转折电位(+0.6 V)变到原起始电位(-0.2 V)期间,在指示电极表面生成的[Fe(CN)6]3-被还原生成[Fe(CN)6]4-,产生还原电流。
为了使液相传质过程只受扩散控制,应在加入电解质和溶液处于静止下进行电解。
实验前电极表面要处理干净。
在0.10 mol·L-1NaCl溶液中K[Fe(CN)6]的扩散系数为0.63×10-5cm·s-1;电子转移速率大,为可逆体系(1.0 mol·L-1NaCl溶液中,25℃时,标准反应速率常数为5.2×10-2 cm·s-1)。
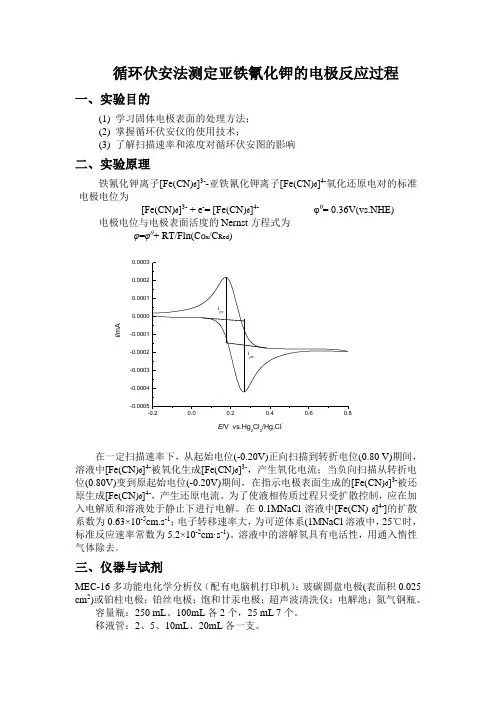
循环伏安法测定亚铁氰化钾的电极反应过程一、实验目的(1) 学习固体电极表面的处理方法; (2) 掌握循环伏安仪的使用技术;(3) 了解扫描速率和浓度对循环伏安图的影响二、实验原理铁氰化钾离子[Fe(CN)6]3--亚铁氰化钾离子[Fe(CN)6]4-氧化还原电对的标准电极电位为[Fe(CN)6]3- + e -= [Fe(CN)6]4- φθ= 0.36V(vs.NHE) 电极电位与电极表面活度的Nernst 方程式为 φ=φθ+ RT/Fln(C Ox /C Red )-0.20.00.20.40.60.8-0.0005-0.0004-0.0003-0.0002-0.00010.00000.00010.00020.0003i pai pcI /m AE /V vs.Hg 2Cl 2/Hg,Cl-在一定扫描速率下,从起始电位(-0.20V)正向扫描到转折电位(0.80 V)期间,溶液中[Fe(CN)6]4-被氧化生成[Fe(CN)6]3-,产生氧化电流;当负向扫描从转折电位(0.80V)变到原起始电位(-0.20V)期间,在指示电极表面生成的[Fe(CN)6]3-被还原生成[Fe(CN)6]4-,产生还原电流。
为了使液相传质过程只受扩散控制,应在加入电解质和溶液处于静止下进行电解。
在0.1MNaCl 溶液中[Fe(CN) 6]4-]的扩散系数为0.63×10-5cm.s -1;电子转移速率大,为可逆体系(1MNaCl 溶液中,25℃时,标准反应速率常数为5.2×10-2cm·s -1)。
溶液中的溶解氧具有电活性,用通入惰性气体除去。
三、仪器与试剂MEC-16多功能电化学分析仪(配有电脑机打印机);玻碳圆盘电极(表面积0.025 cm 2)或铂柱电极;铂丝电极;饱和甘汞电极;超声波清洗仪;电解池;氮气钢瓶。
容量瓶:250 mL 、100mL 各2个,25 mL 7个。
循环伏安法测定亚铁氰化钾的电极反应过程实验目的1.学习固体电极表面的处理方法;2.学会利用MEC-16B多功能电化学分析仪,进行循环伏安法探究物质的电极过程。
3.了解扫描速率和浓度对循环伏安图的影响实验原理1.循环伏安法是将线型扫描电压施加在电极上,控制电极电势以不同的速率,电压与随时间以三角波形一次或多次反复扫描。
如图1使电活性物质在电极上能交替发生不同的还原和氧化反应,记录电流—电势曲线。
根据曲线形状可以判断电极反应的可逆程度,中间体、相界吸附或新相形成的可能性,以及偶联化学反应的性质等。
循环伏安法使用小面积工作电极是静止的固体电极,如铂电极、石墨电极、波碳电极、悬汞电极等。
2.当溶液中存在氧化态物质O时,从起始电压E i沿某一方向扫描到终止电压E S它在电极上还原成还原态物质R, O+ne-→R ;电位方向逆转时,电极上生成的R被氧化为O, R →O+ne-所得极化曲线如图2图1 图2上半波是还原波(阴极支),下半部是氧化波(阳极支)如果物质的电极过程是可逆过程,阳极峰电流i pa与阴极峰电流i pc相等,而且与扫描速度的平方根成正比;可逆电流峰的峰电位与电压扫描速度无关。
阴极峰电位φpc与阳极峰电位φpa差Δφp=56.5∕n (mv 25o),通常Δφp与实验条件有关,其值在55mv —65mv就可确定为可逆电极过程。
3.铁氰化钾离子[Fe(CN)6]3-亚铁氰化钾离子[Fe(CN)6]4-氧化还原电对的标准电极电位为[Fe(CN)6]3-+ e-= [Fe(CN)6]4-φθ= 0.36V电极电位与电极表面活度的Nernst方程式为φ=φθ+ RT/Fln(C Ox/C Red)在一定扫描速度下,从起始电位-02V正向扫描到+0.8V过程中,溶液中的[Fe(CN)6]4-氧化成[Fe(CN)6]3-产生氧化电流,当负相扫描时即从+0.8V到-0.2V 时,[Fe(CN)6]3-被还原产生还原电流。
实验34 循环伏安法测定亚铁氰化钾范西薇4101110010级化学2班【实验目的】(1)学习固体电极表面的处理方法;(2)掌握循环伏安仪的使用技术;(3)了解扫面速率和浓度对循环伏安图的影响。
【实验原理】铁氰化钾离子[Fe(CN)6]3—亚铁氰化钾离子[Fe(CN)6]4—氧化还原电对的标准电极电位为[Fe(CN)6]3- + e- = [Fe(CN)6]4-φθ= 0.36V(vs.NHE)电极电位与电极表面活度的Nernst方程式为φ=φθ’+ RT/Fln(C Ox/C Red)在一定扫描速率下,从起始电位(-0.2V)正向扫描到转折电位(+0.8V)期间,溶液中[Fe(CN)6]4-被氧化生成[Fe(CN)6]3-,产生氧化电流;当负向扫描从转折电位(+0.8V)变到原起始电位(-0.2V)期间,在指示电极表面生成的[Fe(CN)6]3-被还原生成[Fe(CN)6]4-,产生还原电流。
为了使液相传质过程只受扩散控制,应在加入电解质和溶液处于静止下进行电解。
在0.1mol/LKCl溶液中K4[Fe(CN)6]的扩散系数为0.63×10-5cm.s-1;电子转移速率大,为可逆体系(1mol/LKCl溶液中,25℃时,标准反应速率常数为5.2×10-2cm·s-1)。
溶液中的溶解氧具有电活性,用通入惰性气体除去【仪器与试剂】循环伏安仪、铂电极(指示电极)、铂丝电极(辅助电极)、饱和甘汞电极(参比电极)0.1 mol·L-1 NaCl、0.10 mol·L-1K4 [Fe(CN)6]【实验步骤】(1)指示电极的预处理铂电极用Al2O3粉末(粒径0.05µm)将电极表面抛光,然后用蒸馏水清洗。
(2)支持电解质的循环伏安图在电解池中放入0.1 mol·L-1NaCl溶液,插入电极,以新处理的铂电极为指示电极,铂丝电极为辅助电极,饱和甘汞电极为参比电极,进行循环伏安仪设定,扫描速率为100mV/s;起始电位为-0.2V;终止电位为+0.8V。
铁氰化钾溶液的循环伏安法研究铁氰化钾溶液的循环伏安法研究1、实验⽬的(1)学习固体电极表⾯的处理⽅法。
(2)掌握循环伏安仪的使⽤技术。
(3)了解电位扫描速率和电活性物质浓度对循环伏安图的影响。
2、实验原理铁氰化钾离⼦[Fe(CN)6]3-/亚铁氰化钾离⼦[Fe(CN)6]4-氧化还原电对的电极反应为:电极电位与电极表⾯电活性物质浓度间的关系符合Nernst⽅程式。
在⼀定扫描速率下,从起始电位(+0.8 V)负向扫描到转折电位(-0.2 V)时,⼯作电极表⾯的[Fe(CN)6]3-被还原⽣成[Fe(CN)6]4-,产⽣还原电流;当反向扫描从转折电位(-0.2 V)变化到起始电位(+0.8 V)时,在⼯作电极表⾯⽣成的[Fe(CN)6]4-被氧化⽣成[Fe(CN)6]3-,产⽣氧化电流。
为了使溶液相传质过程只受扩散控制,应加⼊⽀持电解质并在溶液处于静⽌状态下进⾏电解。
25℃时,在0.10 mol/L KCl 溶液中K3[Fe(CN)6]的扩散系数约为6.3×10-6 cm2 s-1,标准电极反应速率常数约为5.2×10-2 cm s-1,电⼦转移速率⼤,为可逆体系。
3、仪器与试剂天津兰⼒科LK9805电化学分析仪;玻碳盘电极(Φ3 mm);铂辅助电极;饱和⽢汞电极;超声波清洗仪;电解池。
K3[Fe(CN)6]溶液:1.0 mmol/L(含0.10 mol/L KCl)。
KCl溶液:0.10 mol/L。
4、实验步骤1)玻碳盘⼯作电极的预处理:⽤Al2O3粉末(粒径0.05 µm)将电极表⾯抛光,然后在蒸馏⽔中超声波清洗,再⽤蒸馏⽔清洗,待⽤。
2)K3[Fe(CN)6]溶液的循环伏安图:(1)不同扫描速率下K3[Fe(CN)6]溶液的循环伏安图取1.0 mmol/L K3[Fe(CN)6]溶液20 mL置于电解池中,放⼊玻璃碳圆盘电极、饱和⽢汞电极及铂辅助电极(玻璃碳圆盘电极为⼯作电极,铂丝电极为辅助电极,饱和⽢汞电极为参⽐电极),设置起始电位为+0.8 V,终⽌电位为-0.2 V,扫描速率(v)分别为10、25、50、75、100、150、200、250、500 mV s-1,进⾏循环伏安扫描,记录下循环伏安图中氧化峰、还原峰的峰电位和峰电流(i pa、i pc、E Pa、E Pc)。
循环伏安法测定铁氰化钾王燕燕 40507224一、实验目的1、学习固体电极的处理方法2、掌握循环伏安仪的使用技术3、了解扫描速率和浓度对循环伏安图的影响二、实验原理铁氰化钾离子[Fe(CN)6]3-—亚铁氰化钾离子[Fe(CN)6]4-氧化还原电对的标准电极电位为[Fe(CN)6]3- + e-= [Fe(CN)6]4-φθ= 0.36 V(vs.NHE) 电极电位与电极表面活度的Nernst方程式为φ=φθ+ RT/Fln(C Ox/C Red)在一定扫描速率下,从起始电位(-0.2 V)正向扫描到转折电位(+0.8 V)期间,溶液中[Fe(CN)6]4-被氧化生成[Fe(CN)6]3-,产生氧化电流;当负向扫描从转折电位(+0.8 V)变到原起始电位(-0.2 V)期间,在指示电极表面生成的[Fe(CN)6]3-被还原生成[Fe(CN)6]4-,产生还原电流。
为了使液相传质过程只受扩散控制,应在加入电解质和溶液处于静止下进行电解。
在1 M NaCl 溶液中[Fe(CN)6]的扩散系数为0.63×10-5 cm.s-1;电子转移速率大,为可逆体系(1 M NaCl溶液中,25℃时,标准反应速率常数为5.2×10-2 cm·s-1)。
溶液中的溶解氧具有电活性,用通入惰性气体除去。
三、仪器和药品LK98B型循环伏安仪,X-Y记录仪,银电极,铂丝电极,饱和甘汞电极,电解池,移液管等。
0.10 Mol*L-1 K3[Fe(CN)6], 1.00 Mol*L-1 NaCl四、实验步骤(1)指示电极的预处理铂电极用Al2O3粉末(粒径0.05 µm)将电极表面抛光,然后用蒸馏水清洗。
(2)支持电解质的循环伏安图在电解池中放入30 mL 1,0 mol·L-1 NaCl溶液,插入电极,以新处理的铂电极为指示电极,铂丝电极为辅助电极,饱和甘汞电极为参比电极,进行循环伏安仪设定,扫描速率为50 mV/s;起始电位为-0.2 V;终止电位为+0.8 V。
齐齐哈尔大学实验报告题目:循环伏安法测定亚铁氰化钾的电极反应过程学校:_齐齐哈尔大学___专业班级:_______学生姓名:__________同组者姓名:成绩:___________[实验目的]1学习固体电极表面处理方法;2掌握循环伏安仪的使用技术;3了解扫描速率和浓度对循环伏安图的影响[实验原理]铁氰化钾离子[Fe(CN6)]3—亚铁氰化钾离子[Fe(CN6)]4-氧化还原电对的标准电极电位为[Fe(CN6)]3- + e- = [Fe(CN6)]4-=0.36V(vs.NHE)电极电位与电极表面活度的Nerst方程为φ=θφ+RT/Fln(Co x/C Red)在一定扫描速率下,从起始电位(-0.2V)正向扫描到转折电位(0.8V)期间,溶液中[Fe(CN6)]4-被氧化生成[Fe(CN6)]3- 产生氧化电流;当负向扫描从转折电位(0.181V)变到原起始电位(0.110V)期间,在指示电极表面生成的[Fe(CN6)]3-被还原生成[Fe(CN6)]4-,产生还原电流。
为了使液相传质过程只受扩散控制,应在加入电解质和溶液处于静止下进行电解。
溶液中的溶解氧具有电活性,用通入惰性气体除去。
[仪器与试剂]MEC-16多功能电化学分析仪(配有电脑机打印机);铂电极(表面积0.025cm2);铂丝电极;饱和甘汞电极;超声波清洗仪;微量注射器;电解池。
1.00mol/LK4[Fe(CN6)]; 1mol/LKNO3;A2O3粉末。
[实验步骤]1 指示电极的预处理玻碳圆盘电极:用A2O3粉末配置成糊状将电极表面抛光,然后在蒸馏水中超声波清洗,再用蒸馏水洗,待用。
2 K4[Fe(CN6)]溶液的循环伏安图分别作0.01mol/L、0.02mol/L、0.04mol/L、0.06mol/L、0.08mol/L的K4[Fe(CN6)]溶液(均含支持电解质KNO3浓度为0.2mol/L)循环伏安图。
3不同扫描速率K4[Fe(CN6)]溶液中,以10mV/s、20mV/s、50mV/s、100mV/s、150mV/s、200mV/s,在-0.2V至0.8V电位范围内扫描,分别记录循环伏安图。