血液检测试剂(酶联免疫核酸试剂)
- 格式:doc
- 大小:26.00 KB
- 文档页数:1

酶联免疫诊断试剂的质量控制【摘要】酶联免疫吸附试验(elisa)是免疫检验中最常用的方法,由于这种方法具有灵敏性高、特异性强、重复好(精密度)、操作方便、试剂稳定等优点,已成为免疫检验中的主要技术。
尽管如此,若想用elisa方法得到准确的结果那就必须要严格按照试剂的说明书进行标准操作,并且进行全面的质量控制。
以下是个人针对酶联免疫诊断试剂质量控制的几点体会和实际操作过程中需要注意的地方。
【关键词】质量控制;酶联免疫;灵敏度;特异性;精密度;符合率国家对hbsag、hcv、hiv、tp四项酶联免疫诊断试剂采取“批批检”的严格审查,并且强制要求对献血者进行上述四个项目的检测,被称为血筛类检测。
由于批次不同和生产厂家的不同,导致在实际的工作过程中遇到试剂批内、批间重复性差和不同厂家试剂不一致结果[1],以及试剂盒在存储以及运输的过程中的质量安全等问题,对购买的试剂进行质量控制是非常有必要的。
使用前,要对试剂进行批批检查并且综合进行评价,选择灵敏度高、特异性强的试剂,以供献血者进行筛查,来控制并且减少上述四类疾病的输血传播。
1 试剂检测前的质量控制1.1 试剂的选用在选择的试剂上必须是经卫生部批准的有生产许可证厂家生产的通过国家“批批检”批次的试剂。
1.2 试剂的准备在实验开始前,先将试剂盒从冰箱中拿出,在室温中放置30分钟后再进行检测,使试剂盒在使用前与室温平衡,以确保满足反应微孔内的温度要求。
开始实验前需要查看试剂盒中反应板的密封性和各组分渗漏情况,发现反应板不密封或者试剂渗漏时,应采取更换试剂盒的措施。
为了配合实验过程中常规的洗板过程,洗涤液需要用新鲜的蒸馏水进行配制。
蒸馏水的质量十分关键,它有可能造成实际空白值和阴性本底的上升。
2 试剂的性能检测的质量控制对试剂的性能检测的要求:从检测结果和预期的结果计算其灵敏度、特异性、精密度、符合率等指标来判断试剂是否符合实验室的检测要求。
除了一些国家参考品外,建议各实验室确定一个或多个标准物质,用来控制检测试剂的批内和批间差异,以达到质量控制的目的。


酶联免疫分析法生工121 徐娜酶联免疫分析法是目前分析化学领域中的前沿课题,它是一种特殊的试剂分析方法,是在免疫酶技术的基础上发展起来的一种新型的免疫测定技术,特别是在食品和饲料中有毒有害物质的检测应用极为广泛。
酶联免疫分析法是把抗原抗体的免疫反应和酶的高效催化作用原理有机地结合起来的一种检测技术。
该技术的原理主要有三点:第一、抗原或抗体能结合到固相载体的表面仍具有其免役活性;第二、抗体或抗原与酶结合所形成的结合物仍保持免疫活性和酶的活性;第三,结合物与相应的抗原或抗体反应后,结合的酶仍能催化底物生成有色物质,而颜色的深浅可定量抗体或抗原的含量。
酶联免疫法在医药、食品加工业、农牧渔业等领域有着广泛的应用:如乙型肝炎、莱姆病,急性心肌梗死的早期诊断,定量检测内毒素,HIV抗体初筛,SARS 病毒的快速检测;检测食品中的病毒,残留农药,微生物及其其它成分;检测香蕉有关病毒,小麦黄花叶病毒,检测水产品中氯霉素的残留量,禽脑脊髓抗体等。
一、医学临床中的应用医学中,检测各种抗原和抗体,为临床疾病的辅助诊断和早期诊断提供了特异性、敏感性强的试验基础。
1、乙型肝炎、原发性肝癌的血清学检测:用血清学方法检测肝炎病毒的抗原或抗体,一直受到各级医疗卫生机构检验科室的高度重视。
尤其是对乙型肝炎,甲型肝炎,丙型肝炎的血清学检测,更因为试剂盒的推出而得到广泛开展。
上述各种肝炎病毒抗原或抗体的检测方法,绝大部分都是酶联免疫分析法。
2、简化莱姆病的诊断:由于在作出博氏疏螺旋体感染诊断前要进行双重测试,因此莱姆病的测试可能花费很长时间。
采用由关键的疏螺旋体抗原决定簇构成的重组蛋白开发出一种新的酶联免疫测定方法。
该测试比最常用的商业全细胞酶联免疫测定法特异,而敏感性相同,并且在20分钟就会产生结果。
3、急性心肌梗死的早期诊断:急性心肌梗死为一多发病,病情严重。
目前对此病的策略是尽早的确诊并迅速积极的治疗。
约有四分之一或更多的患者,在初诊时心电图并不显示典型心肌梗死心电图异常,无Q波。

人C肽定量检测试剂盒(酶联免疫法)说明书V7.0 即用10-1136-0196人份试剂由瑞典Mercodia AB制造用于标签上的标识的说明预期用途C肽定量检测试剂盒(酶联免疫法)提供了一种人血清、血浆、尿液样本中C肽的定量检测方法。
本试验综述和说明胰岛β细胞功能的定性与定量评估不仅用于糖尿病自然历史的诊前和诊后研究,也在临床上作为选择正确疗法的导向。
外周胰岛素不能用于评估β细胞功能,鉴于门静脉循环使得肝脏吸收的大量化和复杂化,并且胰岛素试验不能区分内源性胰岛素和外源性胰岛素。
胰岛β细胞内的胰岛素原可裂解为1分子的C肽和1分子的胰岛素,C肽以和胰岛素等摩尔浓度量释放到循环中,相比胰岛素而C肽最低限度被肝脏吸收,因此,外周C肽浓度更能反映β细胞的分泌量,比胰岛素更准确。
尿液中C肽含量与血浆中C肽含量相关,但个体内和人体间存在很高的差异性,所以测定β细胞功能不够精确。
检测程序的原理C肽检测试剂盒(酶联免疫法)是一种固相双表位酶联免疫试剂。
它基于双夹心技术,两单克隆抗体分别结合在C肽分子的抗原决定簇上。
在孵育过程中,样本中的C肽与结合在微孔(板)中的C肽抗体和酶标C肽抗体反应。
洗涤移去非结合的酶标抗体。
结合的偶联物(标记物)通过与3,3’,5,5’-四甲基联苯胺(TMB)反应而被检测到。
加入酸后反应终止,然后通过分光光度计(酶标仪)读取反应的终点。
警告与注意事项●用于体外诊断。
●不能让反刍动物或猪接触到本试剂盒的内容物及其残余物。
●本试剂盒的终止溶液含有0.5M的硫酸。
按常规预防措施处理危险化学品。
●所有的患者样本都应按潜在传染物处理。
要求但未提供的材料●配备相应的移液管(重复移取加入酶结合物溶液、试验缓冲液、TMB底物和终止溶液)●用于试剂制备的试管、烧杯和量筒●重蒸水●磁力搅拌器●涡轮混合器●酶标仪(含450nm滤光片)●平板振荡器(建议速率700-900循环/分钟,轨道运动)●微孔板(酶标板)洗涤设备试剂各Mercodia胰岛素ELISA检测试剂盒(10-1128-01)都包含96孔的试剂,足够用于双份测试的42个样本、1个校准曲线。

酶联免疫检测技术与核酸检测技术在血液筛检中的对比分析危燕芬【摘要】目的探讨酶联免疫检测技术(ELISA)与核酸检测技术(NAT)在血液筛检中的应用效果.方法选取2016年1月-2017年8月本地区11234例无偿献血者的血液样本作为检测对象,均实施酶联免疫检测技术与核酸检测技术检测.结果 11234份血液样本中ELISA检测结果为阳性258份(2.30%),其中HBsAg 241份,抗HCV12份,抗HIV 5份,阴性10976份(97.70%);NAT检测结果:EIA(+)258份中HBV NAT阳性238份(2.11%),EIA(-)HBV NAT(+)6份(0.05%),阴性10990份(97.83%),HCV和HIV均为NAT(-);EIA(-)HBV NAT(+)6份(0.05%)HBV DNA定量检测结果均<3×102拷贝/ml.结论酶联免疫检测技术和核酸检测技术对血液筛检均具有临床意义,但是核酸检测技术能够缩短血液病毒检测的“窗口期”,直接对病毒本身检测,因此NAT检测技术能进一步降低输血传播病毒的风险.【期刊名称】《泰山医学院学报》【年(卷),期】2018(039)007【总页数】3页(P763-765)【关键词】酶联免疫检测技术;核酸检测技术;血液筛检【作者】危燕芬【作者单位】广州血液中心花都区血站,广东广州510800【正文语种】中文【中图分类】R446.6目前采血机构重点监测的项目是血液传染病,也是病人输血安全的最后一道基本的防线,以往主要采用酶联免疫吸附(ELISA)测定法筛检血液样本,在很长时间内通过该检测方法降低了输血途径传播病毒的风险[1]。
近年来,随着检验技术的不断发展,核酸检测技术(NAT)在临床上得到了广泛的应用,使血液感染病毒检测的“窗口期”显著缩短,但是检验准确性和方式尚未统一[2]。
为了进一步优化血液筛查的顺利开展,本研究旨在探讨酶联免疫检测技术与核酸检测技术在血液筛检中的应用效果,现报告如下。

世界最新医学信息文摘 2019年 第19卷 第55期367投稿邮箱:zuixinyixue@·临床荟萃·探讨核酸检测与酶联免疫吸附试验技术在血液筛查工作中的应用黄戌燕(北京市密云区医院 输血科,北京 101500)0 引言输血传播感染性疾病的防控是确保临床输血安全性的有效措施。
能够有效处理病毒感染的窗口期问题,已经成为血液筛查技术的关键内容。
核酸检测和酶联免疫吸附试验是当前临床上血液筛查的有效措施,能够全面确保输血安全性,并且提升输血质量[1]。
此次研究主要是探讨分析探讨核酸检测与酶联免疫吸附试验技术在血液筛查工作中的应用,现将此次研究报告作如下汇报。
1 资料与方法1.1 一般资料。
选取2016年1月至2018年12月XXX 血站的10571例无偿献血患者,其中有6273例为男性血液标本,4298例女性血液标本,年龄23-56岁,平均(36.12±3.74)岁。
采集无偿献血者血液并且留取两管血液标本,用于进行核酸检测和酶联免疫吸附试验。
将血液标本进行离心处理,并且在4摄氏度上进行保存待检,在72h 内检测。
所有献血者均签署无偿献血协议,本研究已经获得本站伦理委员会批准。
1.2 仪器与试剂1.2.1 仪器:全自动混样仪,全自动核酸提取,扩增检测系统,核酸扩增检测仪,核酸提取仪,酶联免疫吸附试验分析仪。
1.2.2 试剂:酶联免疫吸附试验试剂:HBsAg ,抗-HCV ,抗-HIV 。
HBV-DNA ,HIV-RNA ,HCV-RNA ,三联合提取试剂和检测试剂[2]。
1.3 方法。
①酶联免疫吸附试验技术:使用两个不同生产厂家酶联免疫吸附试剂盒,并且按照试剂盒说明进行平行检测;阳性标准:使用两种试剂对标本进行HBsAg ,抗-HCV ,抗-HIV 的检测结果均表示为阳性;阴性标准:两种试剂对标本进行HBsAg ,抗-HCV ,抗-HIV 的检测结果均表示为阴性[3]。
②核酸检测:按照试剂盒说明书和仪器实行HBV-DNA ,HIV-RNA ,HCV-RNA 检测。
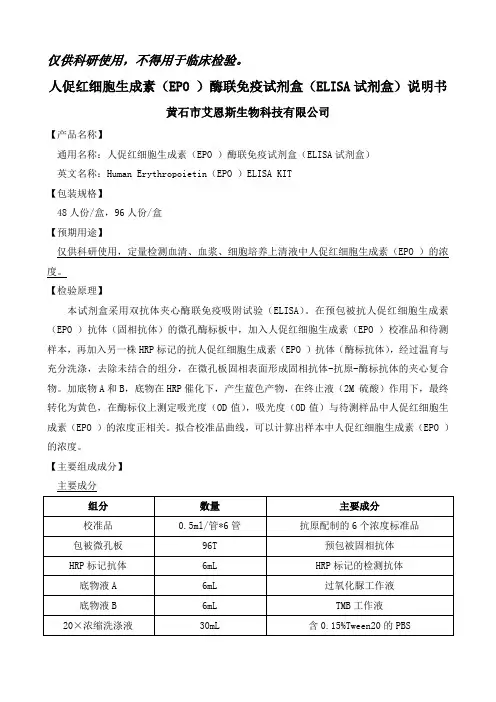
仅供科研使用,不得用于临床检验。
人促红细胞生成素(EPO )酶联免疫试剂盒(ELISA试剂盒)说明书黄石市艾恩斯生物科技有限公司【产品名称】通用名称:人促红细胞生成素(EPO )酶联免疫试剂盒(ELISA试剂盒)英文名称:Human Erythropoietin(EPO )ELISA KIT【包装规格】48人份/盒,96人份/盒【预期用途】仅供科研使用,定量检测血清、血浆、细胞培养上清液中人促红细胞生成素(EPO )的浓度。
【检验原理】本试剂盒采用双抗体夹心酶联免疫吸附试验(ELISA)。
在预包被抗人促红细胞生成素(EPO )抗体(固相抗体)的微孔酶标板中,加入人促红细胞生成素(EPO )校准品和待测样本,再加入另一株HRP标记的抗人促红细胞生成素(EPO )抗体(酶标抗体),经过温育与充分洗涤,去除未结合的组分,在微孔板固相表面形成固相抗体-抗原-酶标抗体的夹心复合物。
加底物A和B,底物在HRP催化下,产生蓝色产物,在终止液(2M 硫酸)作用下,最终转化为黄色,在酶标仪上测定吸光度(OD值),吸光度(OD值)与待测样品中人促红细胞生成素(EPO )的浓度正相关。
拟合校准品曲线,可以计算出样本中人促红细胞生成素(EPO )的浓度。
【主要组成成分】主要成分校准品检测范围:47-3000pg/ml。
校准品已经通过测试,结果表明HBs抗原阴性,HIV1、HIV2和HCV抗体阴性,由于不存在一种试验方法能够完全保证没有这些物质,本品必须按照具有潜在的感染性进行处理,处理过程应当遵循通用的安全措施。
需要但未提供的材料及耗材1、酶标仪2、精密移液器及一次性吸头3、蒸馏水4、洗瓶或者自动洗板机5、37℃水浴锅或恒温箱6、500ml量筒7、无粉一次性乳胶手套【储存条件及有效期】1、2-8℃保存,切勿冷冻,有效期6个月。
2、开封使用后,包被微孔板放入带有干燥剂的自封袋中,密闭自封袋,并将全部试剂放回2-8℃冰箱。


我国第四代HIV血液筛查试剂的质量评价宋爱京 许四宏 李秀华 聂建辉 赵晨燕 刘强 黄维金* 王佑春*中国食品药品检定研究院艾滋病性病病毒疫苗室卫生部生物技术产品检定方法及其标准化重点实验室,北京100050【摘要】目的 评价我国第四代HIV血液筛查试剂的质量 方法 利用HIV-1 p24抗原国家参考品和HIV抗体国家参考品,对2012年3月至2013年3月间7个厂家生产的33批第四代HIV抗原抗体联合检测试剂进行评价,分析其对高、中、低浓度样品检测的批间变异系数和低浓度样品S/CO值变化趋势,计算比较不同试剂的最低检出量理论值。
结果 各试剂均符合国家参考品的要求,除A(进口)和C试剂外均有非特异阳性出现。
高、中、低浓度样品的批间变异系数均不高于25%,A(进口)试剂的批间精密性优于国产同类试剂。
趋势分析表明国内外试剂检测结果均较稳定,未见超过±3SD的异常情况。
进口试剂的批间变异系数和最低检出量理论值均优于国产试剂(P<0.01)。
70%(23/33)的试剂优于HIV抗体最低检出量国家标准要求;p24抗原参考品最低检出量均值为3.2IU/ml,82%(27/33)试剂优于国家标准要求。
结论 2012年3月-2013年3月期间我国第四代HIV酶联免疫检测试剂均符合国家现行标准,但与进口试剂相比国产第四代HIV酶免试剂在最低检出量和批间精密性上尚有提高的空间。
【关键词】人类免疫缺陷病毒;抗体;抗原;酶联免疫试剂Analysis on Quality of the Fourth Generation of HIV Screening Reagents in ChinaSONG Ai-jing*, XU Si-hong, LI Xiu-hua et al (*National Institute for the Food and Drug Control, Beijing 100050, China)【Abstract】Objective To analyze the fourth generation of HIV screening reagents from March 2012 to March 2013 in China Methods 33 batches of the fourth generation reagents used for screening HIV in blood samples from March 2012 to March 2013 in China were analyzed by using national reference panels of HIV antibody and HIV p24 antigen. Results All reagents were consistent with the requirements of the national reference. Non-specific positive reactions were found in all manufacturers’ reagents except two reagents. The interassay coefficient of variation was no more than 25%. Interassay coefficient of variation of A imported reagent was lower than the similar domestic reagents. Trend analysis suggested that the results of both domestic and imported reagents were relatively stable with no abnormal results more than ± 3SD. 70% (23/33) reagents, whose detection limit of HIV antibody were higher than the acceptable criteria of national reference panel. The基金项目: “艾滋病和病毒性肝炎等重大传染病防治”国家科技重大专项(2012ZX10004701-001)作者单位:中国食品药品检定研究院,卫生部生物技术产品检定及标准化重点实验室,北京,100050通讯作者:黄维金,E-mail:*********************.cn,王佑春,E-mail:****************.cnaverage detection limit of detecting p24 antigen was 3.2IU/ml, and 82%(27/33)reagents were higher than the acceptable criteria of national reference panel. Conclusion The quality of reagents for screening HIV in blood samples from March 2012 to March 2013 in China met the current national requirements. However, the inter-variation coefficient and detection limit of the fourth domestic generation HIV ELISA should be further improved compared with the imported reagent.【Key words】HIV; Antibody; Antigen; ELISA艾滋病于1981年被首次发现,现已成为重大公共卫生问题。

总IgE检测试剂盒(酶联免疫法)说明书[产品名称][通用名称] 总IgE检测试剂盒(酶联免疫法)[英文名称] Total IgE ELISA适应症:过敏性疾病、蠕虫病、湿疹性或非湿疹性皮炎、IgE骨髓瘤等。
临床意义:1)>100 IU/ml水肿Churg-2)IgE ∙∙∙∙∙T∙2∙∙∙在下列疾病中可有IgE缺陷:∙X-染色体相关低丙种球蛋白血症;∙严重的联合免疫缺陷(SCID);∙毛细管扩张性运动失调;∙肺纤维化疾病;∙极少数的健康人。
[检验原理] 试剂盒中每个微孔板条有8个可拆分的包被有抗人IgE多克隆抗体的微孔。
第一次温育时,稀释后的样本在微孔中反应。
如果样本阳性,特异性IgE与抗体结合。
为了检测结合的IgE,加入能发生颜色反应的酶标抗人IgE抗体(酶结合物)进行第二次温育。
然后加入酶底物,发生颜色反应。
通过标准品1-4绘制的标准曲线来确定IgE浓度。
效。
1.包被有抗原的微孔板:自第一次开封后,抗原包被的微孔板在干燥的2-8?C的环境中保存4个月。
2.清洗缓冲液:稀释后的缓冲液于2-8?C最多可稳定4周。
[样本要求]样本:人血清或EDTA、肝素、柠檬酸盐抗凝的血浆。
稳定性:待测患者样本于2-8?C可储存14天,稀释后的样本需在同一个工作日检测。
样本稀释:患者样本用样本缓冲液1:10稀释。
例如,可取100μl血清用900μl样本缓冲液稀释并使用混匀器混匀(加样枪不适合于混匀)。
注意:标准品和对照品已经稀释,直接使用,勿需再稀释![检验方法]试剂的准备和稳定性注意:所有试剂在使用前均应在室温(18-25?C)平衡约30分钟。
试剂首次开封后,在无污染的情况下,于2-8?C保存,可稳定至所标示的有效期。
- 抗原包被的微孔:直接使用。
在外包装密封线咬合部的上端剪开保护袋,为防止板条受潮,只有当微孔板平衡到室温后才可打开包装。
剩余板孔应立即放回保护袋并封好(保留干燥剂)。
从第一次打开保护袋起,抗原包被的微孔可在干燥的2-8?C的环境中保存4个月。

体外诊断试剂分类标准体外诊断试剂是指用于体外检验的试剂和设备,主要用于检测人体液体、细胞、组织等样本中的生化成分、细胞形态和结构、免疫学指标等,以帮助临床医生进行疾病诊断、预防和治疗。
根据其用途和原理的不同,体外诊断试剂可以分为不同的分类,本文将对体外诊断试剂的分类标准进行详细介绍。
一、按用途分类。
1. 临床化学试剂,用于检测人体液体中的生化成分,如血糖、血脂、肝功能、肾功能等指标。
2. 免疫学试剂,包括免疫测定、免疫分析和免疫组化试剂,用于检测人体液体和细胞中的免疫学指标,如抗体、抗原、免疫球蛋白等。
3. 微生物学试剂,用于检测人体液体、组织和分泌物中的微生物,如细菌、病毒、真菌等。
4. 分子诊断试剂,用于检测人体细胞和组织中的基因、蛋白质和核酸等分子生物学指标。
5. 血液学试剂,用于检测人体血液中的血液学指标,如血细胞计数、血红蛋白浓度、凝血功能等。
二、按原理分类。
1. 免疫测定试剂,包括酶联免疫吸附试验(ELISA)、放射免疫测定(RIA)、免疫荧光法(IFA)等,基于抗体与抗原相互作用原理进行检测。
2. 生化分析试剂,包括酶法、光度法、电化学法等,基于生化反应原理进行检测。
3. 分子生物学试剂,包括聚合酶链式反应(PCR)、核酸杂交、基因芯片等,基于分子生物学原理进行检测。
4. 微生物学试剂,包括培养基、快速检测试剂等,基于微生物学原理进行检测。
5. 血液学试剂,包括血细胞计数仪、血液凝血分析仪等,基于血液学原理进行检测。
三、按产品形式分类。
1. 试剂盒,包括预包装的试剂、标准品、质控品等,便于实验室直接使用。
2. 仪器设备,包括免疫分析仪、生化分析仪、PCR仪等,用于自动化检测和分析。
3. 检测试纸,包括尿液检测试纸、血糖试纸等,便于临床现场快速检测。
以上是对体外诊断试剂的分类标准进行的详细介绍,通过对体外诊断试剂按用途、原理和产品形式进行分类,可以更好地指导临床医生选择合适的试剂进行临床检测,提高疾病诊断的准确性和效率。
谷氨酸脱羧酶抗体检测试剂盒(酶联免疫法)说明书【产品名称】通用名称: 谷氨酸脱羧酶抗体检测试剂盒(酶联免疫法)英文名称: Test Kit for Antibody to Glutamic Acid Decarboxylase (ELISA)【包装规格】48人份/盒。
【预期用途】本试剂盒用于体外定性检测人血清中谷氨酸脱羧酶(GAD)抗体水平。
GAD抗体是Ⅰ-型糖尿病特异性标志性抗体之一。
用于Ⅰ-型糖尿病、缓进型或称隐匿型Ⅰ-型糖尿病(LADA)辅助诊疗 [8]。
【检验原理】本试剂盒应用间接酶联免疫吸附试验原理。
在微孔板预包被GAD抗原, 加入样本稀释液及待检样本进行温育, 样本中存在GAD抗体与包被抗原形成“包被抗原-抗体”复合物, 洗板去除不与包被抗原结合物质; 加入酶结合物(辣根过氧化物酶标识抗人IgG抗体)进行第二次温育, 酶标二抗将与“包被抗原-抗体”复合物结合, 形成“包被抗原-IgG抗体-酶标二抗”复合物; 再次洗板后加入显色剂, 复合物上连接HRP催化显色剂反应, 生成蓝色产物。
终止反应后, 变为黄色。
若样本中无GAD抗体, 不显色或很浅色。
【关键组成成份】表1. 谷氨酸脱羧酶抗体检测试剂盒(酶联免疫法)组成成份【储存条件及使用期】1. 储存条件: 2~8℃避光贮存。
2. 使用期: 12个月。
3. 打开后包被板条用自封袋密封, 2~8℃避光贮存不超出2周。
【适用仪器】含波长450nm酶标仪。
【样本要求】1. 本试剂使用样本为人血清。
2. 不能检测含有叠氮钠样本, 因叠氮钠抑制辣根过氧化物酶活性; 不能检测含有悬浮纤维蛋白或聚集物、重度溶血样本。
3. 样本中应无微生物。
无菌分离样本可在2~8℃贮存1周, 低于-18℃贮存三周, 避免反复冻融。
4. 使用前请将样本置于室温(10~30℃)平衡30分钟以上, 冷冻样本试验前需解冻至室温(10~30℃)并混匀。
【检验方法】1. 配液: 用蒸馏水或去离子水将1瓶浓缩洗涤液全部稀释至450ml。
人类免疫缺陷病毒抗体诊断试剂盒酶联免疫法试剂厂家:英科新创(厦门)科技有限公司本试剂盒采用抗原夹心两步法检测人血清或血浆中的HIV1/HIV2型抗体。
在微孔板预包被基因重组HIV(1+2)抗原,当加入的待检测样本中存在HIV抗体时,将反应形成抗原抗体复合物,再与加入的酶标记基因工程HIV(1+2)抗原反应,最后形成“固相HIV抗原-HIV抗体-酶标记HIV 抗原”的免疫,复合物,加入底物后形成显色反应。
标本要求;1采用血清或血浆样本,血浆样本可以使用常规用量的肝素,枸橼酸钠或者EDTA抗凝。
2样本不能用叠氮钠防腐,以免抑制酶的活性。
3样本保存在2-8C。
如需长期保存,需置-15-20C冻存,并避免样本反复冻融。
4高血脂,高胆红素及溶血样本可能会影响试验结果的准确性,建议不使用。
检验方法:1.平衡:将试剂合各组分从盒中取出,平衡至室温(18-25℃),微孔板开封后,余者即时以自封袋封存。
2配液:浓缩洗涤液配前充分摇匀(如有晶体应充分溶解),浓缩洗涤液和蒸馏水或去离子水按1:19稀释后使用。
3.编号:取所需数量微孔条固定于支架,按序编号。
4.加样:按顺序分别在相应孔中加入50ul待测样本及阴.阳性对照。
5.温育:覆上封板膜,置37℃温育60分钟。
6.洗涤:用洗涤液充分洗涤5次,洗涤后扣干(每次应保持30-60秒的浸泡时间)。
7.加酶:分别在每孔中加酶标抗原30分钟。
8.温育:覆上封板膜,置37℃温育30分钟。
9.洗涤:用洗涤液充分洗涤5次,洗涤后扣干(每次应保持30-60秒的浸泡时间)。
10.显色:每孔加底物A,B和50ul,轻拍混匀,37℃暗置30分钟。
11.终止:每孔加入终止液50ul,混匀。
12测定:用酶标仪单波长450nm或双波长450/630nm测定各孔OD值(用单波长测定时,需用空白对照孔调零),并记录结果。
结果判定;1.样本OD值S/CO≧1者为HIV抗体反应初筛阳性样本OD值<1者,为HIV抗体反应阴性。
HBsAg酶免四种试剂性能情况比较分析摘要:目的通过对质控品和血清盘的平行检测,评估四种HBsAg酶联免疫吸附(ELISA)试剂的各项性能情况。
方法采用四种HBsAg酶联免疫吸附(ELISA)试剂同时检测HBsAg质控品(浓度为0.2IU/mL)和乙型肝炎病毒表面抗原(HBsAg)血清盘,将实验室近三次室间质评HBsAg有反应样本再次用四种试剂进行比对。
结果 1)检测血清盘的结果中四种试剂检测结果的一致性较好,准确率均较高,但在检测样本编号为40,参考浓度为:0.5IU/ML时,试剂三未检出。
2)试剂一的批内精密度CV为7.70%-7.71%,批间精密度CV为10.32%-12.21%;试剂二的批内精密度CV为5.52%-5.56%,批间精密度CV为11.76%-11.78%;试剂三的批内精密度CV为5.05%-5.08%,批间精密度CV为18.90%-18.92%;试剂四的批内精密度CV为8.99%-9.02%,批间精密度CV为14.42%-16.42%。
3)试剂二和试剂三是实验室用的试剂,较上报结果无较大差异,试剂一和试剂四在阳性较强的样本中没有太大区别,阳性偏弱的结果相对比较低。
结论试剂二各方面性能指标稳定,其他试剂需加强验证。
关键词:乙型肝炎表面抗原(HBsAg);酶联免疫吸附试验(ELISA);性能指标乙型肝炎病毒(hepatitis B virus,HBV)是引起肝脏炎症性反应的主要病原体之一,其主要传播途径是血液传播(输血和血制品)、母婴传播和性传播。
HBV呈世界性流行,据世界卫生组织(WHO)报道,全球约20亿人正在感染HBV或曾经感染过HBV,2.57亿人是乙肝慢性携带者,乙肝在我国传染率较高,我国慢性乙肝感染者约为9000万人,占全球慢性感染者总数的30%。
使用酶联免疫吸附试验(ELISA)检测乙型肝炎病毒表面抗原HBsAg是血液筛查实验室有效检出乙肝病毒(HBV)感染的重要方法之一。
体外诊断试剂分类体外诊断试剂是指用于人体样本体外检测的试剂、试剂盒、校准品、质控品等产品,用于疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中。
这些试剂可以单独使用,也可以与仪器、器具、设备或者系统组合使用。
根据产品风险程度由低到高,体外诊断试剂分为第一类、第二类、第三类产品。
根据检测原理和方法将其分为四大类:生化试剂、免疫诊断、分子诊断、微生物诊断。
生化试剂是指在临床急诊生化项目的检测中使用的试剂。
这些试剂可以检测血常规、尿常规、肝功能、肾功能等,以及激素、微量蛋白、肿瘤标志物和药物微量物质测定。
生化试剂分为干化学和其他两种类型。
干化学生化试剂成本低,技术成熟,但操作复杂,耗时长。
其他生化试剂成本低,灵敏度高,但操作复杂,有污染。
生化试剂的优点是快速,缺点是定性。
免疫诊断是指利用抗原抗体反应进行检测的试剂。
免疫诊断分为放射免疫、酶联免疫、胶体金、乳胶比浊和荧光免疫五种类型。
放射免疫将放射性同位素测量的高度灵敏性、精确性和抗原抗体反应的特异性相结合的体外测定技术。
酶联免疫是指酶与样本反应,依据颜色变化程度确定结果。
胶体金和乳胶比浊都是利用抗原抗体反应形成复合物,胶体金标记和乳胶颗粒发生凝集,从而进行检测。
荧光免疫是一种结合免疫学方法和荧光标记技术的体外测定技术,可以用来研究特异蛋白抗原在细胞内分布的方法。
免疫诊断的优点是成本低,技术成熟,缺点是操作复杂,耗时长。
分子诊断是指利用分子生物学技术进行检测的试剂。
分子诊断分为PCR、原位杂交(ISH)、基因芯片测序和基因测序四种类型。
PCR是指利用高温变成单链、低温互补配对的原理进行检测。
ISH是指利用标记的已知测序核酸为探针与细胞或组织切片中核酸进行杂交,从而对特定核酸进行精确定量定位的过程。
基因芯片测序原理是杂交测序技术,在一块基片表面固定了序列已知的靶核苷酸的探针,互补匹配确定序列。
基因测序是指从血液或唾液中分析测定基因全序列,预测多种疾病的可能性。
血液核酸检测与酶免检测的误区分析作者:邓群华黄友珍来源:《中外医学研究》2019年第04期【摘要】目的:分析核酸检测与酶联免疫检测在血液病毒检验中的应用误区,探讨提高病毒检测的准确性的方法。
方法:在血站血液样本检测中心选取600份血液样本进行检测,样本来自2016年6月-2018年6月来血站献血的志愿者,分别对600份血液样本进行核酸检测和酶免检测,通过比较两种检测方式数据,分析不同方法检测的利弊。
结果:酶联免疫法两种试剂检测对乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)和人类免疫缺陷病毒(HIV-1/2型)的检测阳性率分别为:2.33%、1.67%、2.17%,在检测结果上均存在一定程度的误区,有一定比例的漏检,其检测合格样本在经过核酸检测后又检出HBV-DNA、HCV-RNA、HIV1/2的比率分别为0.51%、0.34%、0.68%。
结论:核酸检测和酶免检测两种方法各有优缺点,在检测准确性上对比并无明显差距,而核酸检测的成本较高,故而通常情况下血站检测以酶免检测优先,但在实际的病毒检测应用中,可根据两种方法的各自的优势灵活选用。
【关键词】核酸检测; 酶免检测; 血液; 误区doi:10.14033/ki.cfmr.2019.04.036 文献标识码 B 文章编号 1674-6805(2019)04-00-02输血能够通过静脉注入的方式为患者补充合适类型的血液,挽救患者的生命,自20世纪初期发现ABO血型规律后,成为一种常用的治疗方法。
输血模式发展到现代,已经形成了固定的规模,每个城市都设有血站,血液来源为无偿献血志愿者所提供,医院根据实际需求与血站建立联系[1]。
然而,人体的血液中含有许多致病菌和病毒,其中以病毒的威胁性最高,常见的致病致死率较高的病毒如乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)和人类免疫缺陷病毒(HIV)等,在血液采集时需要进行检测。
为了减少因输血而感染疾病的风险,从根源上切断输血性病毒感染,多年来医学界一直致力于血液病毒的检测技术的完善,自第三代酶免检测技术(ELISA)问世以来,为血液病毒的检测带来了较大的便利,同时,核酸检测计数(NAT)亦可以通过对血液中DNA、RNA的扩增来检测是否含有病毒核酸从而检测到病毒[2-3]。