胃蛋白酶原II测定试剂盒(酶联免疫吸附法)产品技术要求meikang
- 格式:docx
- 大小:36.55 KB
- 文档页数:2

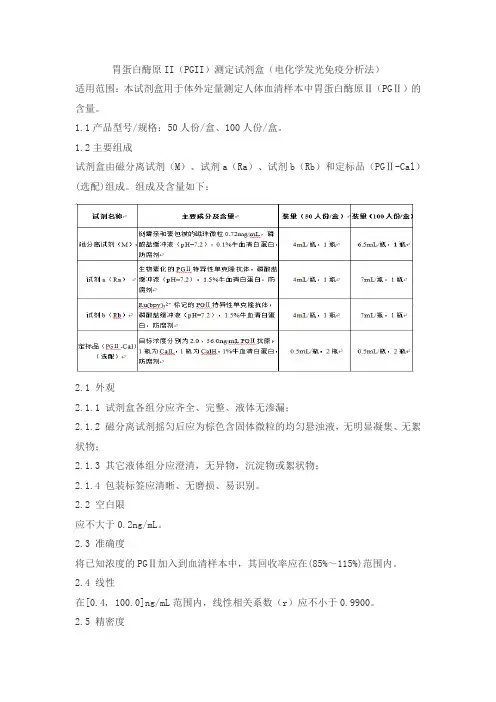
胃蛋白酶原II(PGII)测定试剂盒(电化学发光免疫分析法)
适用范围:本试剂盒用于体外定量测定人体血清样本中胃蛋白酶原Ⅱ(PGⅡ)的含量。
1.1产品型号/规格:50人份/盒、100人份/盒。
1.2主要组成
试剂盒由磁分离试剂(M)、试剂a(Ra)、试剂b(Rb)和定标品(PGⅡ-Cal)(选配)组成。
组成及含量如下:
2.1 外观
2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;
2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;
2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;
2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限
应不大于0.2ng/mL。
2.3 准确度
将已知浓度的PGⅡ加入到血清样本中,其回收率应在(85%~115%)范围内。
2.4 线性
在[0.4, 100.0]ng/mL范围内,线性相关系数(r)应不小于0.9900。
2.5 精密度
2.5.1 重复性
在试剂盒的线性范围内,测定高低两个水平的的样品,检测结果的变异系数(CV)应不大于8%。
2.5.2 批间差
在试剂盒的线性范围内,用3个批号试剂盒分别检测高低两个水平的的样品,检测结果的变异系数(CV)应不大于15%。
2.6 效期末稳定性
本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求。
2.7 溯源性
依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,定标品溯源至深圳新产业的PGⅡ定标液。

胃蛋白酶原试剂盒说明书一、产品简介胃蛋白酶原试剂盒是一种用于检测胃蛋白酶原水平的试剂盒。
胃蛋白酶原是一种消化酶,在胃中起到分解蛋白质的重要作用。
该试剂盒通过测量样品中胃蛋白酶原的含量,可以帮助医生评估胃黏膜功能和炎症程度,辅助诊断和监测相关疾病。
二、试剂盒组成本试剂盒包含以下组分: 1. 胃蛋白酶原检测试剂:用于检测样品中的胃蛋白酶原。
2. 样品稀释液:用于稀释样品,以确保浓度在检测范围之内。
3. 阳性对照液:含有已知浓度的胃蛋白酶原,用于验证试剂盒的准确性。
4. 阴性对照液:不含胃蛋白酶原,用于验证试剂盒的特异性。
三、使用方法1. 样品准备•收集患者的胃液样品,并将其转移至干净的离心管中。
•如样品浑浊或含有颗粒物,可先进行离心分离。
•如样品量不足,可使用样品稀释液进行适当稀释。
2. 试剂配置•打开胃蛋白酶原检测试剂瓶盖,取出所需量的试剂。
•按照试剂瓶上标示的比例,将试剂与样品混合均匀。
3. 反应孵育•将混合好的样品和试剂放置于恒温水浴中孵育一定时间。
•孵育时间和温度应根据试剂盒说明书中的要求进行设定。
4. 测量结果•在设定的反应时间后,取出孵育好的样品。
•使用本试剂盒所提供的分析仪器或读板器,按照仪器操作说明进行测量。
•记录测量结果,并根据说明书中提供的参考范围判断胃蛋白酶原水平是否正常。
四、注意事项1.本试剂盒仅供专业医务人员使用,请遵循相关操作规范。
2.所有试剂和样品均需避免直接接触皮肤和黏膜,如不慎接触,请立即用大量清水冲洗。
3.试剂盒的保存温度应符合说明书中的要求,避免高温或低温存放。
4.使用过程中,请勿混用不同批次的试剂盒,以免影响检测结果的准确性。
5.未使用完的试剂盒应密封保存,避免受到污染或湿气。
五、质量控制1.每次进行检测时,应同时使用阳性对照液和阴性对照液进行质量控制。
2.根据说明书中提供的质量控制范围,判断检测结果是否符合要求。
3.若阳性对照液和阴性对照液的检测结果超出质量控制范围,则表示本次检测结果可能不准确,需重新进行检测。

人chemerin酶联免疫分析试剂盒使用说明书本试剂盒仅供研究使用预期应用ELISA法定量测定人血清、血浆或其它相关液体中chemerin含量。
实验原理本试剂盒应用双抗体夹心酶标免疫分析法测定标本中chemerin水平。
用纯化的抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入chemerin抗原、生物素化的抗人chemerin抗体、HRP标记的亲和素,经过彻底洗涤后用底物TMB显色。
TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的chemerin呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),计算样品浓度。
试剂盒组成及试剂配制1.酶联板:一块(96孔)2.标准品(冻干品):2瓶,每瓶临用前以样品稀释液稀释至1ml,盖好后静置10分钟以上,然后反复颠倒/搓动以助溶解,其浓度为20,000pg/ml,做系列倍比稀释后,分别稀释10,000pg/ml,5,000pg/ml,2,500pg/ml,1,250pg/ml,625pg/ml,312.5pg/ml,156pg/ml,样品稀释液直接作为标准浓度0pg/ml,临用前15分钟内配制。
如配制10,000pg/ml标准品:取0.5ml20,000pg/ml的上述标准品加入含有0.5ml样品稀释液的Eppendorf管中,混匀即可,其余浓度以此类推。
3.样品稀释液:1×20ml/瓶。
4.检测稀释液A:1×10ml/瓶。
5.检测稀释液B:1×10ml/瓶。
6.检测溶液A:1×120ul/瓶(1:100)临用前以检测稀释液A1:100稀释,稀释前根据预先计算好的每次实验所需的总量配制(每孔100ul),实际配制时应多配制0.1-0.2ml。
如1ul检测溶液A加99ul检测稀释液A的比例配制,轻轻混匀,在使用前一小时内配制。
7.检测溶液B:1×120ul/瓶(1:100)临用前以检测稀释液B1:100稀释。

2.性能指标
2.1外观
试剂盒各组分应齐全、完整,液体无渗漏,试剂架无损坏;
晰,易识别。
2.2检出限
PGII检出限应不高于0.8ng/mLa
2.3线性
该试剂盒样本检测的线性区间为[1.5〜200]ng/mL,其相关系数R应不低于
0.9900=
2.4准确度
回收率应在85.0%〜115.0%范围内。
2.5精密度
2.5.1批内精密度
在试剂盒的剂量-反应曲线范围内,设置2个不同浓度的质控品,全自动操作试剂盒测定结果的变异系数(CV)应不高于8.0%o
2.5.2批间精密度
在3个不同批次产品之间,在试剂盒的剂量-反应曲线范围内,设置2个不同浓度的质控品,测定结果的的变异系数(CV)应不高于15.0%o
2.6特异性
PGII测定浓度不低于100ng/mLPGI样本,其测定结果应不高于0.5ng/mL。

胃蛋白酶原Ⅰ/胃蛋白酶原Ⅱ(PGⅠ/PGⅡ)二合一测定试剂盒(荧光免疫层析法)
1.性能指标
2.1 外观
2.1.1试剂盒外观应整洁,文字符号标识清晰,封装无破损,内容物齐全。
2.1.2检测卡的外观应符合下列要求:外观平整、色泽均匀、边缘无毛刺,不能有色斑或污渍。
2.2物理检测
试纸条宽度均为4.0±0.5mm。
2.3液体移行速度
应不小于10.0mm/min。
2.4 空白限
PGⅠ空白限应不高于2ng/mL;
PGⅡ空白限应不高于2ng/mL。
2.5准确度
在试剂盒线性区间内,检测两个不同浓度的工作校准品,测定值与标示值的相对偏差应不超过±15%。
2.6线性
PGⅠ:在线性范围(2~150)ng/mL内,试剂盒的线性相关系数r≥0.990,在(2~10)ng/mL区间内测定的线性绝对偏差不超过±1ng/mL,在(10~150)ng/mL区间内测定的线性相对偏差应不超过±15%。
PGⅡ:在线性范围(2~80)ng/mL内,试剂盒的线性相关系数r≥0.990,在(2~10)ng/mL区间内测定的线性绝对偏差不超过±1 ng/mL,在(10~80)ng/mL区间内测定的线性相对偏差应不超过±15%。
2.7 重复性
用同一批号试剂盒测定两个不同浓度的内部参考品,要求变异系数CV≤15%。
2.8批间差
使用3个不同批号的试剂盒测定高、低两个浓度的参考品,要求批间变异系数CV≤15%。
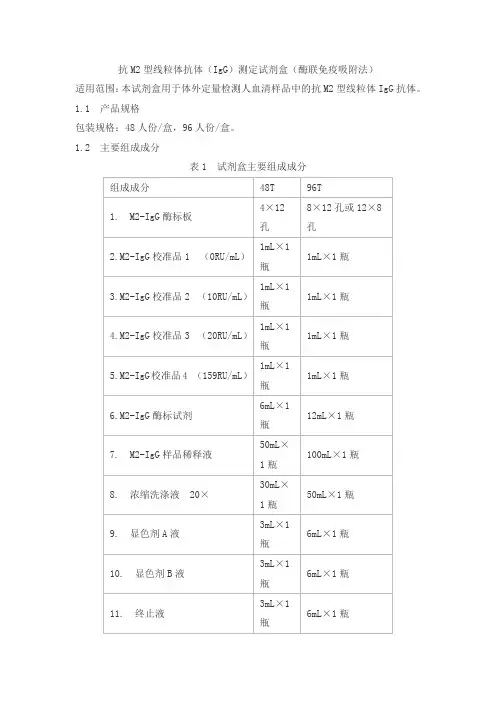
抗M2型线粒体抗体(IgG)测定试剂盒(酶联免疫吸附法)适用范围:本试剂盒用于体外定量检测人血清样品中的抗M2型线粒体IgG抗体。
1.1 产品规格包装规格:48人份/盒,96人份/盒。
1.2 主要组成成分表1 试剂盒主要组成成分各组份主要组成:酶标板:包被有M2抗原;酶标试剂:辣根过氧化物酶标记的抗人IgG抗体;样品稀释液:含PBS的缓冲液;M2-IgG校准品:含4水平的M2-IgG;浓缩洗涤液:含表面活性剂的缓冲液;显色剂A液:含浓度不低于0.3g/L的过氧化物溶液;显色剂B液:含浓度不低于0.2g/L的TMB溶液;终止液:含浓度不高于2mol/L的硫酸溶液。
2.1 外观试剂(盒)各组份应齐全、完整,液体无渗漏;标签应清晰,易识别。
2.2 准确度回收实验:回收率应在100%±20%范围内。
2.3 空白限应不高于5.0 RU/mL。
2.4 测量系统的线性本检测系统的线性范围为[10,159]RU/mL,在[10,159]RU/mL范围内,线性相关系数r应不低于0.9900。
2.5 重复性检测低、高两个浓度重复性参考品CV1和CV2,变异系数CV(%)应均不超过15%。
2.6 批间差用3个批号试剂盒检测重复性参考品CV2,变异系数CV(%)应不超过20%。
2.7 稳定性效期稳定性:将2℃~8℃放置6个月的试剂盒检测2.1~2.5各项,应符合各项目规定的要求。
2.8 溯源性校准品溯源性应符合GB/T 21415-2008有关规定,可溯源至企业的工作校准品,并经与已上市产品比对赋值。

胃蛋白酶原I/胃蛋白酶原II测定试剂盒(荧光免疫层析法)适用范围:用于体外定量测定人全血、血浆、血清中胃蛋白酶原Ⅰ、胃蛋白酶原Ⅱ的含量。
1.1 包装规格1人份/盒、5人份/盒、20人份/盒、25人份/盒、50人份/盒、100人份/盒。
1.2 主要组成成分每种包装规格含相应人份数的检测卡、标记管、干燥剂、样品缓冲液及1个校准信息卡。
2.1外观2.1.1 检测卡使用铝塑单个密封包装,标签应完整清晰,内容物齐全,卡壳应整洁、无破损,扣合紧密;2.1.2 缓冲液为无色或淡黄色透明液体,不得有任何沉淀及絮状悬浮物。
2.2宽度试纸条宽度为4.0±0.2mm。
2.3装量样品缓冲液装量偏差应不大于±10%。
2.4移行速度液体移行速度不低于10mm/min。
2.5 空白限胃蛋白酶原Ⅰ的空白限不大于1ng/mL。
胃蛋白酶原Ⅱ的空白限不大于1ng/mL。
2.6线性—1 —胃蛋白酶原Ⅰ在[10,200] ng/mL范围内,线性相关系数应满足r≥0.990。
胃蛋白酶原Ⅱ在[5,100] ng/mL范围内,线性相关系数应满足r≥0.990。
2.7重复性用高浓度质控品(PGⅠ[100,200] ng/mL、PGⅡ[50,100] ng/mL)、低浓度质控品(PGⅠ[20,100]ng/mL、PGⅡ[10,50] ng/mL)为样本重复测定10次,其测定值的变异系数(CV)应不大于15%。
2.8准确度以胃蛋白酶原I,胃蛋白酶原II纯品配制的溶液对本试剂盒做回收试验,其回收率应在85%~115%范围内。
2.9批间差用3个不同批号的试剂盒分别测试样本,所得结果的相对极差(R)应不大于15%。
2.10 稳定性包装的试剂盒在2℃~30℃贮存,有效期为18个月。
在有效期满后六个月以内的试剂盒,分别检测2.1,2.2,2.3,2.4,2.5,2.6,2.7,2.8项,结果应符合各项目的要求。
2.11 溯源性根据GB/T 21415-2008及有关规定,提供校准曲线的赋值过程及不确定度等内容,溯源至企业工作校准品并与已上市产品比对赋值。

可溶性生长刺激表达基因2蛋白测定试剂盒(荧光免疫层析法)适用范围:用于体外定量测定人全血、血浆、血清中可溶性生长刺激表达基因2蛋白(ST2)的含量。
1.1包装规格1人份/盒、5人份/盒、20人份/盒、25人份/盒、50人份/盒、100人份/盒。
1.2主要组成成分每种包装规格含相应人份数的检测卡、加样枪头、干燥剂、样本缓冲液及1个校准信息卡。
不同批号试剂盒中各组分不可互换。
2.1外观1)检测卡使用铝塑单个密封包装,标签应完整清晰,内容物齐全,卡壳应整洁、无破损,扣合紧密;2)缓冲液为无色或淡黄色透明液体,不得有任何沉淀及絮状悬浮物。
2.2装量样本缓冲液装量偏差应不大于±10%。
2.3宽度试纸条宽度为4.0±0.2mm。
2.4移行速度液体移行速度不低于10mm/min。
2.5空白限试剂盒的空白限不大于1.0ng/ml。
2.6线性在[5,200]ng/ml 范围内,线性相关系数应满足r≥0.990。
2.7重复性用高浓度[100,200]ng/ml、低浓度[10,50]ng/ml两水平样本重复测定10次,其测定值的变异系数(CV)应不大于15%。
2.8准确度用本试剂盒做回收试验,其回收率应在85%~115%范围内。
2.9特异性取不含可溶性生长刺激表达基因2蛋白的样本,加入以下物质平行检测3次,结果均应不大于1.0 ng/ml。
表1特异性2.10溯源性根据GB/T 21415-2008及有关规定,提供校准曲线的赋值过程及不确定度等内容,溯源至企业工作校准品并与已上市产品比对赋值。
2.11批间差用3个不同批号的试剂盒分别测试样本,所得结果的相对极差(R)应不大于15%。
2.12稳定性原包装的试剂盒在2℃~30℃贮存,有效期为12个月。
在有效期满后六个月以内的试剂盒,分别检测2.1,2.2,2.3,2.4,2.5,2.6,2.7,2.8,2.9项,结果应符合各项目的要求。


慢性胃部病变与血清胃蛋白酶原变化的临床研究目的探讨慢性胃部病变的血清胃蛋白酶原变化。
方法选择2014年1月~2016年12月在我院就诊的慢性胃部疾病患者216例为研究对象,其中浅表性胃炎54例,糜烂性胃炎30例,萎缩性胃炎44例,胃溃疡36例,十二指肠溃疡40例,胃癌12例。
比较各组PGⅠ、PGⅡ以及PGⅠ/ PGⅡ水平,比较Hp阳性与Hp阴性患者PGⅠ、PGⅡ以及PGⅠ/ PGⅡ水平。
结果糜烂性胃炎、胃溃疡、十二指肠溃疡PGⅠ显著高于对照组,萎缩性胃炎以及胃癌显著低于对照组,差异有统计学意义(P<0.05);浅表性胃炎、糜烂性胃炎、胃溃疡、十二指肠溃疡PGⅡ水平显著高于对照组,差异有统计学意义(P<0.05);胃溃疡、十二指肠溃疡PGⅠ/ PGⅡ水平显著高于对照组,胃癌PGⅠ/ PGⅡ水平显著低于对照组,差异有统计学意义(P<0.05)。
消化性溃疡患者Hp阳性PGⅠ、PGⅡ显著高于Hp 阴性患者,差异有统计学意义(P<0.05);萎缩性胃炎Hp阳性患者PGⅡ显著高于Hp阴性患者,PGⅠ/ PGⅡ显著低于Hp阴性患者,差异有统计学意义(P<0.05)。
结论血清胃蛋白酶对初步筛查慢性胃部病变具有一定的临床意义。
[Abstract] Objective To discuss changes of serum pepsinogen in patients with chronic gastric diseases. Methods 216 cases with chronic gastric diseases from Jan 2014 to Dec 2016 were selected as subjects,among them,54 cases of superficial gastritis,30 cases of erosive gastritis,44 cases of atrophic gastritis,36 cases of gastric ulcer,40 cases of duodenal ulcer,12 cases of gastric cancer. PGⅠ,PG Ⅱand PGⅠ/ PGⅡlevels of difference groups were compared,and PGⅠ,PG Ⅱand PGⅠ/ PGⅡlevels of Hp+ and Hp- patients were compared. Results PGⅠlevels of erosive gastritis,gastric ulcer,duodenal ulcer were higher than those of control group,and atrophic gastritis and gastric cancer was lower than those of control group,which showed significant difference(P<0.05). PGⅡlevels of superficial gastritis,erosive gastritis,gastric ulcer,duodenal ulcer were higher than those of control group,which showed significant difference(P<0.05). PGⅠ/ PGⅡlevels of gastric ulcer,duodenal ulcer were higher than that of control group,and gastric cancer was lower than that of control group,which showed significant difference(P<0.05). PGⅠand PGⅡlevels of peptic ulcer with Hp+ were higher than Hp-,which showed significant difference(P<0.05). PGⅡlevel of atrophic gastritis with Hp+ was higher than Hp-,and PGⅠ/ PG was lower than Hp-,which showed significant difference(P<0.05). Conclusion Serum pepsin has some clinical significance in screening chronic gastric diseases.[Key words] chronic gastric diseases;serum pepsinogen;changes;Erosive gastritis慢性胃病是临床常见病,常见的包括慢性胃炎、潰疡、胃癌等,致病因素复杂,与感染、遗传、环境、免疫、生物等多种因素有关,而幽门螺杆菌(Helicobacter pylori,Hp)感染是慢性胃病的主要原因。
胃蛋白酶原(PG)I/II检测试剂盒(标记免疫分析法)1 范围本标准规定了胃蛋白酶原I/Ⅱ测定试剂盒的分类、要求、试验方法、标签和使用说明书、包装、运输和贮存。
本标准适用于进行胃蛋白酶原I和胃蛋白酶原Ⅱ测定试剂盒(以下简称PGI/Ⅱ试剂盒)。
包括以摩标记、化学发光标记等标记方法免疫分析试剂盒。
本标准不适用于胶体金标记或其他方法标记的半定量测定PG I/Ⅱ试剂(如;试纸条等);用125I等放射性同位素标记的各类放射免疫或免疫放射试剂盒。
2规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 191—2008包装储运图示标志。
GB/T 29791.2 体外诊断医疗器械制造商提供的信息(标示) 第2部分:专业用体外诊断试剂。
3分类按照标记方法不同可以分为酶标记、(电)化学发光标记、(时间分辨)荧光标记等;根据固相载体不同可以分为微孔板式、管式、磁颗粒、微球珠和塑料珠等;根据操作过程的不同可分为手工操作法和仪器自动操作法。
4要求4.1外观制造商应根据自己产品的包装特点规定适当的外观要求,一般应有试剂盒各组分组成、性状;内外包装、标签清晰等的要求。
4.2 检出限4.2.1PGI试剂盒检测限不高于2.5ng/mL。
4.2.2 PG II试剂盒检测限不高于1.4ng/mL。
4.3线性在制造商给定的线性区间内(PG I下限不高于 3 ng/mL,上限不低于200 ng/mL;PG II下限不高于1.5 ng/mL,上限不低于100 ng/mL),相关系数(r)应不低于0.9900。
4.4准确度准确度应符合如下要求之一:a)在试剂金规定的线性区间内,检测胃蛋白酶原I/Ⅱ国家(或国际)标准品,测定结果的相对偏差应在士15.0%范围内b) 回收率应在85.0%~115.0%范围内。
4.5准确度4.5.1 批内精密度在试剂盒的剂量-反应曲线范围内,设置2个~3个不同浓度的质控品,手工操作试剂盒测定结果的变异系数(CV)应不高于10.0%,全自动操作试剂盒测定结果的变异系数(CV)应不高于8.0%。
胃蛋白酶原II(PGII)测定试剂盒(胶乳免疫比浊法)适用范围:用于体外定量测定人血清中胃蛋白酶原Ⅱ的含量。
1.1 产品型号包装规格为:规格1:试剂1:25ml,试剂2:5ml;规格2:试剂1:50ml,试剂2:10ml。
具体装量见表1:表1组成装量主要成分及含量试剂150ml/瓶、25ml/瓶磷酸盐缓冲液(PH7.4):50mmol/L;生物防腐剂:0.05%试剂210ml/瓶、5ml/瓶抗人PGII单克隆抗体的乳胶溶液:(0.2-1.2)g/L;磷酸盐缓冲液(PH7.4):50mmol/L说明书1份/盒/2.1外观:试剂盒各组份应齐全、完整,液体无渗漏;中文包装标签应清晰,无磨损;试剂1无色透明液体,试剂2 乳白色胶体溶液。
2.2 净含量:试剂的净含量不少于标示值。
2.3 试剂空白:用校准品稀释液作为空白样品进行测试,试剂空白吸光度值应小于0.02。
2.4分析灵敏度:以4.8ug/L的胃蛋白酶原II(PGII)为检测样本,吸光度变化率在0.0040-0.1376/min之间。
2.5线性:2.5.1试剂盒的线性范围为[2.0,107.8]ug/L,线性相关系数r不低于0.9900;2.5.2 [2.0,10.0]ug/L,绝对偏差不超过±1ug/L;(10.0,107.8]ug/L ,相对偏差在±10%范围内。
2.6 重复性:分别对浓度为5.4ug/L的低浓度控制血清和浓度为17.5ug/L高浓度的控制血清重复检测10次,变异系数(CV)应不大于10%。
2.7准确性:回收率在85%-115%;2.8分析特异性:检测浓度为245.0ug/L的胃蛋白酶原I中的胃蛋白酶原II的浓度,计算交叉反应率,应小于10%。
2.9批间差:相对偏差不大于10%。
2.10稳定性:2℃~8℃保存,有效期12个月,有效期末分别检测2.3~2.7项,其结果应符合各项要求。
ELISA残留酶联免疫检测试剂盒成品质量标准一、适用范围本标准规定了ELISA酶联免疫检测试剂盒的外观要求、技术要求、试验方法、检验规则、抽样和判定准则、保存和有效期。
本标准适用于茶叶、水果及蔬菜类样本中ELISA检测的农药酶联免疫检测试剂盒半成品。
二、外观要求要求:试剂盒外观完整,密封,无漏液,内装试剂齐全。
三、技术要求 1.灵敏度 1.1 IC 50IC 50范围在1.1-2.8μg/L 之间。
1.2 相关系数标准曲线的相关系数应在0.9930以上。
1.3 抑制率范围标准品1 OD 值/标准品2 OD 值的抑制率范围在69-85%之间。
1.4 曲线拐点数 应≤2个拐点。
1.5 0ppb 标准品的OD 值 应在1.5~2.1范围内。
2.精密度3.标准曲线标准品工作液浓度为0μg/L、0.6μg/L 和1.8μg/L 的变异系数小于6%;4.烟叶样本添加浓度为100μg/kg 、300μg/kg ,的变异系数应小于20%。
5.检测限对烟叶样品的检测限不大于100μg/kg 。
6.准确度对样本进行不同浓度的药物添加,各点添加回收率范围如下:5.稳定性将半成品进行老化试验,各周期测得参数满足以下要求:6.特异性对ELISA交叉反应率为100%。
四、试验方法1.试剂和材料1.1ELISA残留酶联免疫检测试剂盒1.2试剂:去离子水、乙醇2.溶液配制依据本试剂盒说明书中“七、溶液的配制”进行各溶液的配制。
3.样品前处理依据本试剂盒说明书中“八、样本前处理步骤”进行样本的前处理。
4.测定依据本试剂盒说明书中“九、检测步骤”进行样本的检测。
5 结果判定5.1百分吸光率的计算标准品或样本的百分吸光率等于标准品或样本的平均吸光度值(双孔)除以第一个标准品(0 标准)的平均吸光度值,再乘以100%,即:百分吸光率(%)=B / B0×100%B—标准品或样本溶液的平均吸光度值B0—0μg/L标准溶液的平均吸光度值5.2标准曲线的绘制与计算以标准品百分吸光率为纵坐标,以标准品浓度(μg/L)的对数为横坐标,绘制标准曲线图。
医疗器械产品技术要求:
胃蛋白酶原Ⅰ和胃蛋白酶原Ⅱ质控品
1.产品型号/规格及其划分说明
1.1结构组成
本质控品为液体,含有重组抗原的胃蛋白酶原Ⅰ和胃蛋白酶原Ⅱ,储存于添加了牛血清白蛋白为稳定剂的PBS缓冲液中。
防腐剂为Proclin300。
1.2型号规格
低值:2×2.0mL,高值:2×2.0mL。
1.3适用范围
本质控品与PGⅠ和PGⅡ试剂盒配套使用,用于胃蛋白酶原Ⅰ和胃蛋白酶原Ⅱ(PG Ⅰ和PGⅡ)项目检测时的室内质量控制。
2.性能指标
1.外观
质控品应为澄清的液体,无沉淀、无悬浮物、无絮状物。
外包装应完好无破损;标签内容应完整、准确、清晰易辨认。
2.装量
质控品装量应不少于标示值。
3.预期结果
测试结果应在靶值范围之内。
4.瓶内均一性
质控品瓶内均一性应满足变异系数CV≤10%。
5.瓶间均一性
质控品瓶间均一性应满足变异系数CV≤10%。
胃蛋白酶原I测定试剂盒(酶联免疫法)适用范围:本试剂盒用于体外定量测定人血清中的胃蛋白酶原I含量。
1.1 包装规格注:校准品(A~F)靶值为批特异,质控品(QL、QH)靶值范围为批特异,详见靶值表。
2. 性能指标:2.性能指标2.1.外观组分齐全、完整,液体无渗漏,包被板的包装袋无破损、漏气现象;标签应清晰,易识别。
2.2.装量液体装量应不少于标示值。
2.3.准确度在剂量反应曲线检测范围内,用已知浓度的纯品做回收试验,其回收率应在85~115%范围内。
2.4.线性在线性范围[2,200]ng/mL内,剂量反应曲线相关系数(r)的绝对值应不低于0.99。
2.5.空白限应不大于1.75ng/mL。
2.6 重复性同一次试验中分别重复检测浓度为50±10ng/mL和100±20ng/mL的质控品10次,变异系数(CV)应不大于10%。
2.7.批间差用3个批号的试剂分别重复检测浓度为50±10ng/mLL和100±20ng/mL的质控品10次,批间变异系数(CV)应不大于15%。
2.8. 分析特异性测定浓度为200ng/mL人胃蛋白酶原II,交叉反应率不大于5%。
2.9.pH值样本稀释液pH应在[5.5,5.9]范围内。
2.10.稳定性产品在2℃~8℃条件下保存有效期为12个月。
取过效期产品在2个月内进行检测,检测结果应满足2.3~2.6,2.8~2.9项要求。
2.11.溯源性根据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,提供所用校准品的来源、溯源的赋值过程和相应要求、以及不确定度等内容,溯源到本公司工作校准品,工作校准品通过已上市产品比对赋值。
胃蛋白酶原II测定试剂盒(酶联免疫吸附法)
适用范围:用于体外定量检测人血清中胃蛋白酶原II的含量。
1.1 包装规格
包装规格为:48人份/盒、96人份/盒、192人份/盒、480人份/盒。
1.2 主要组成成分
2.1外观
试剂盒各组份应齐全、完整,液体无渗漏,包装标签应清晰。
2.2 净含量
液体试剂的净含量不少于标示值。
2.3 线性
线性范围为[1.0,43]μg/L,线性相关系数r≥0.9900。
2.4 空白检测限
不高于1.0μg/L。
2.5重复性
检测高、低两个浓度的样本,变异系数(CV)应不大于15% 。
2.6准确度
回收率在85%~115%。
2.7特异性
测定PGI浓度为200μg/L校准品中PGII的浓度,计算交叉反应率,应小于10%。
2.8批间差
检测一个高浓度的样本,批间变异系数(CV)应不大于15%。
2.9稳定性
2℃~8℃保存,有效期12个月,有效期末分别检测2.3~2.7项,其结果应符合各项要求。
2.10 校准品溯源性
试剂盒校准品按照GB/T 21415-2008 《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,溯源到本公司工作校准品,工作校准品通过芬兰biohit公司试剂盒比对赋值。