人教版高中化学第一册必修极性分子和非极性分子
- 格式:doc
- 大小:64.00 KB
- 文档页数:4


如果分子中所有的化学键都是非极性的,那么价电子就被键合原子相等地共用。
因而,在分子中电子是呈对称均匀分布的。
这种均匀分布的发生与化学键的数目和它们在空间的伸展方向无关。
具有这种特性的分子叫做非极性分子。
如H2,Cl2,N2,O2等。
像HCl和HBr这类双原子分子只有一对电子形成化学键,并且是极性键。
其电子云分布是不对称、不均衡的,被叫做极性分子。
如果分子含有多个极性键,从分子的整体来看,它可能是极性的,也可能是非极性的,这取决于分子中化学键的空间排布。
如果分子中的极性键都相同,从分子的极性的总体来说,它只取决于化学键的空间排布。
以上的看法可以从用带静电荷的棒来靠近细水流及四氯化碳流所发生的现象来证实,细的水流受到吸引而四氯化碳流不受影响。
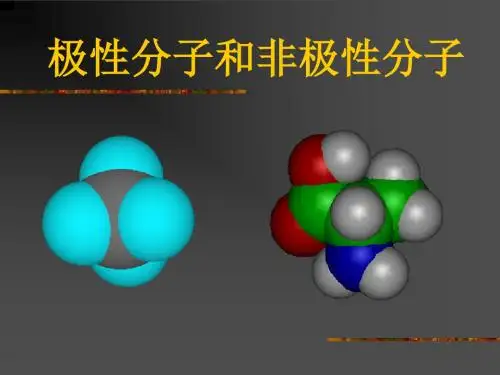
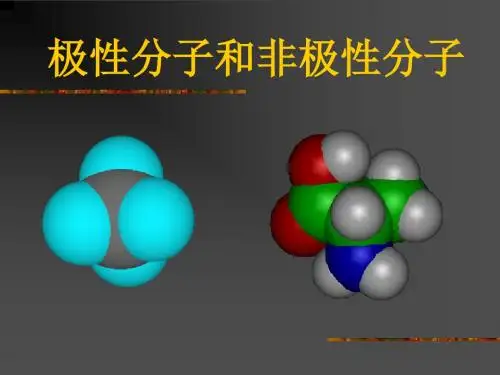
可以说明水分子是极性分子,而四氯化碳分子尽管是由4个极性键构成但因为其排布均匀,就其总体来说是非极性分子,具有类似结构的还有CH4、C2H6等。




第五节非极性分子和极性分子【知识结构】键的极性:按照原子间共用电子对是否偏移,共价键分为非极性键和极性键。
⑴非极性键:由同种原子形成的共价键,两个原子吸引电子的能力相同,共用电子对不偏向任何一个原子,这样的共价键叫非极性共价键,简称非极性键。
⑵极性键:由不同种原子形成的共价键,两个原子吸引电子的能力不同,共用电子对偏向吸引电子能力强的一方,这样的共价键叫极性共价键,简称极性键。
极性分子和非极性分子⑴非极性分子①非极性键结合的双原子分子。
如:O2、N2、X2等。
②对称排列的以极性键结合的多原子分子,如CO2、CH4、CCl4等⑵极性分子①极性键结合的双原子分子,如:HCl②排列不对称的以极性键结合的多原子分子,如H2O、NH3等⑶常见的非极性分子和极性分子非极性分子:双原子单质分子:H2、O2、N2、X2;多原子分子CO2、CS2、CH4、CCl4。
极性分子:HX、H2O、H2S、NH3。
分子间作用力⑴分子间作用力又称范德华力,能量比化学键弱得多。
分子间作用力的大小,对由分子构成的物质的熔点、沸点、溶解度等有影响。
*⑵分子间的作用力的大小与分子的极性和相对分子质量的大小等因素有关。
如组成和结构相似的物质随着相对分子质量的增大,分子间的作用力也增大,表现在熔、沸点的升高上。
如F2、Cl2、Br2、I2。
⑶相似相溶原理极性分子易溶于极性溶剂。
如HCl易溶于水。
非极性分子易溶于非极性溶剂。
如Br2、I2易溶于CCl4、苯、汽油、酒精等有机溶剂【例题解析】下列叙述中,错误的是A.离子化合物中不可能存在非极性键B.离子键只存在于离子化合物中,不存在于共价化合物中C.由极性键结合的分子不一定是极性分子D.极性分子中一定不含非极性键[分析]本题可用反例法确定叙述是否正确。
Na2O2为含非极性键的离子化合物,H2O2为含有非极性键的极性分子,CCl4是由极性键结合的非极性分子。
[答案]A、D下列各组分子中,都是由极性键构成的极性分子的是A.CH3Cl与Cl2B.NH3和H2OC.H2S和CS2D.CO2和HI[分析] 如果从整个分子看,分子里电荷分布是对称的,也就是其正电荷中心与负电荷中心是重合的,则这样的分子属于非极性分子。
极性分子和非极性分子
教学目标
知识技能:使学生初步掌握非极性键、极性键、非极性分子和积极性分子的概念;通过对几种简单非极性分子、极性分子结构的分析,了解键的极性与分子极性的关系;使学生初步了解分子间作用力的概念。
能力培养:培养学生的自学能力、抽象思维能力、逻辑思维能力和表达能力。
科学思想:通过揭示物质之间的普遍联系,培养学生运用辩证唯物主义观点分析化学现象。
科学品质:培养学生严谨、求实、合作、进取的优良品质。
科学方法:通过引导学生观察、实验和抽象思维,向学生进行由微观到宏观、由现象到本质的科学方法的渗透。
重点、难点判断极性分子和非极分子,键的极性分子极性之间的关系。
1.(B) (E) (H)
2.(C) (D) (G) (I) (J)
3.(D) (G)
4.(A) (F)。


第五节非极性分子和极性分子教学目标:知识目标:1.使学生了解非极性键、极性键、非极性分子和极性分子概念。
2.使学生了解化学键的极性民分子极性的关系。
3.使学生了解分子间作用力的概念,以及它的作用力对物质熔点沸点和溶解度的影响。
能力目标:培养实践能力和空间想象能力。
教学重点:非极性分子和极性分子。
教学难点:分子结构与分子极性的关系。
(第一课时)教学过程:[复习引入](1)离子键、共价键的本质有何不同?(2)写出HCl、CO2、H2O的电子式,并指出HCl、CO2、H2O分子结构中电子对分别偏向什么原子?为什么?(3)为什么在氢气分子结构中,电子对不偏向任何一个原子?由问题引出课题,边讨论边板书。
[板书] 第五节非极性分子和极性分子一、非极性键和极性键1.非极性键:相同原子间的共价键(A—A型)2.极性键:不同原子间的共价键(A—B型)A和B对电子吸引力相差越大,极性就越强。
小结:离子键非极性键化学键共价键极性键金属键课堂练习:1.下列物质中,含有非极性共价键的化合物是()A Na2O2B Cl2C Na2SO4D HI2.下列共价键中,极性最强的是()A HFB HClC HBrD HI[过渡]分子是否有极性呢?[板书]二、非极性分子和极性分子分别以H2、Cl2、HCl、H2O为例分析非极性分子和极性分子的概念。
[板书]1.非极性分子:如果分子内电子云颁均匀,没有部分显正负电的现象,这种分子叫做非极性分子。
(整个分子里电荷分布是对称的)2.极性分子:如果分子内电子云分布不均匀,就有部分显正负电的现象,这样的分子叫做极性分子。
(整个分子里电荷分布不对称)[讲述]分子是否有极性,决定于整个分子内电子云分布是否均匀,而电子云均匀与否,则由化学键的性质和分子结构的对称性来决定。
极性分子和非极性分子
教学目标
知识技能:使学生初步掌握非极性键、极性键、非极性分子和积极性分子的概念;通过对几种简单非极性分子、极性分子结构的分析,了解键的极性与分子极性的关系;使学生初步了解分子间作用力的概念。
能力培养:培养学生的自学能力、抽象思维能力、逻辑思维能力和表达能力。
科学思想:通过揭示物质之间的普遍联系,培养学生运用辩证唯物主义观点分析化学现象。
科学品质:培养学生严谨、求实、合作、进取的优良品质。
科学方法:通过引导学生观察、实验和抽象思维,向学生进行由微观到宏观、由现象到本质的科学方法的渗透。
重点、难点判断极性分子和非极分子,键的极性分子极性之间的关系。
1.(B) (E) (H)
2.(C) (D) (G) (I) (J)
3.(D) (G)
4.(A) (F)。