单萜吲哚类生物碱结构修饰
- 格式:ppt
- 大小:1.29 MB
- 文档页数:65

长春花萜类吲哚生物碱生物合成与调控研究长春花含有多种具有重要药理活性的萜类吲哚生物碱(TIA)。
TIA的生物合成与调控及其合成生物学研究受到广泛关注。
3α (S)异胡豆苷是TIA生物合成的重要节点,由裂环马钱子苷和色胺缩合而成。
前者通过环烯醚萜途径生成;后者通过吲哚途径生成。
由3α (S)异胡豆苷分别经过多步酶促反应生成文多灵和长春质碱,然后两者缩合生成α3,4脱水长春碱,进而生成长春碱和长春新碱。
AP2/ERF和WRKY等多种转录因子参与了TIA合成的调控。
长春花TIA 生物合成途径的逐步解析为其合成生物学研究奠定了基础。
目前已在酿酒酵母实现了3α (S)异胡豆苷和文多灵等的异源合成。
长春花TIA生物合成与调控的研究将为TIA类药物的生产和研发提供支撑。
标签:长春花;萜类吲哚生物碱;代谢调控;合成生物学Advance in biosynthesis of terpenoid indole alkaloids andits regulation in Catharanthus roseusKUANG Xuejun1,WANG Caixia2,ZOU Liqiu1,ZHU Xiaoxuan1,SUN Chao1*(1. Institute of Medicinal Plant Development,China Academy of Medical Sciences and Peking Union Medical College,Beijing 100193,China;2. Institute of Chinese Materia Medica,China Academy of Chinese Medical Sciences,Beijing 100700,China)[Abstract] Catharanthus roseus can produce a variety of terpenoid indole alkaloids (TIA),most of which exhibit strong pharmacological activities. Hence,biosynthesis and regulation of TIA have received recent attention. 3α (S)strictosidine is an important node in TIA biosynthesis,which is a condensation product of secologanin and tryptamine. The former is produced in iridoid pathway,and the latter is produced in indole pathway. Vindoline and catharanthine,which are produced respectively by 3α (S)strictosidine via multistep enzymatic reaction,can form α3,4anhydrovinblastine by the condensation reaction. Then,vinblastine and vincristine are generated from α3,4anhydrovinblastine. Many transcription factors are involved in the regulation of TIA synthesis,such as AP2/ERF and WRKY. Illumination of biosynthetic pathway has laid a foundation for the study of synthetic biology. Today,3α (S)strictosidine and vindoline have been synthesized in heterologous hosts Saccharomyces cerevisiae.Research about synthetic biology and the regulation mechanisms will provide a guidance for the production and development of TIA drugs in C. roseus.[Key words] Catharanthus roseus;terpenoid indole alkaloids (TIAs);metabolic regulation;synthetic biologydoi:10.4268/cjcmm20162208长春花Catharanthus roseus为夹竹桃科长春花属多年生草本植物,体内含有130多种生物碱,大多数为萜类吲哚生物碱(terpenoid indole alkaloids,TIA)[12]。

目录摘要 (1)Abstract: (2)1.概述 (3)2.分类 (3)2.1 单萜吲哚生物碱 (3)2.1.1.重排单萜吲哚生物碱 (4)2.1.2.非重排单萜吲哚生物碱 (5)2.2双聚单萜吲哚生物碱 (5)2.3与单萜吲哚碱相关的生物碱 (5)3.单萜吲哚生物碱的化学合成 (7)3.1柯南因-的士宁碱类的合成 (7)3.1.1.士的宁的合成 (8)3.1.2 最新的柯南因类生物碱的合成方法 (14)3.2白坚木碱类 (16)3.3双吲哚类生物碱的合成 (17)3.3.1.长春碱的合成 (17)3.3.2.马钱子碱的合成 (20)3.3.2.1.Mangus,P.小组的合成策略 (20)3.3.2.2.Overman小组的合成策略 (21)3.3.2.3.Mori小组的合成策略 (22)3.3.2.4.Tobru Fukuyama,小组的合成策略 (23)3.4.灯台碱类 (24)参考文献 (26)摘要:生物碱是自然界中种类繁多且拥有生物活性的一类物质,因为其显著的生物活性,近年来有关生物碱的研究异常活跃,这些研究在医学研究与生物化学领域有着重要的地位。
在生物碱中,单萜吲哚生物碱因其优异而广泛的生物活性又是其中十分重要的一类。
本文综述了吲哚生物碱的分类和生物活性以及一些重要的单萜吲哚生物碱的合成,如柯南因-士的宁碱类、白坚木碱类、灯台碱类与长春碱、马钱子碱等重要双吲哚类生物碱的合成。
并介绍了Mangus.P小组、Overman小组、Mori小组与Tobru Fukuyama小组的合成策略。
Abstract:Alkaloid compounds that are numerous in the nature have remarkable biological activities giving rise to the hyperactive studies of alkaloids in recent years. These studies have an important position in the medical research and biological chemistry field .Among the alkaloids,Monoterpenoid Indole Alkaloid is an significant one because of its excellent and extensive biological activity. This paper reviewed the classification and biological activities of indole alkaloids and some important synthesis of Monoterpenoid indole alkaloids,such as Strychnine,Aspidosperma,Echitamine , vinblastine and Stychnine。

依波加明类单萜吲哚生物碱的不对称集群合成研究依波加明类单萜吲哚生物碱的不对称集群合成研究引言:依波加明类单萜吲哚生物碱是一类天然产物,具有广泛的生物活性和药用潜力。
这些化合物的合成方法一直是有机化学领域的研究热点之一。
其中不对称集群合成是一种有效且高效的方法,可以实现对多种结构复杂的依波加明类单萜吲哚生物碱的合成。
本文将对最近研究中关于不对称集群合成的方法和策略进行综述。
一、不对称集群合成方法的发展不对称集群合成方法是指利用手性配体催化剂对非手性准极性羰基亲核反应进行催化,通过控制连位/全位条件,实现手性诱导的构造反应。
随着有机合成的发展,不对称集群合成方法也得到了广泛应用。
研究者发现,通过钌催化的以碳氧偶极物为底物的不对称集群合成可以有效地实现吲哚生物碱的合成。
此外,还发现了利用其他过渡金属催化剂的方法,如钼、钯、铑等。
二、策略一:手性配体催化剂的设计与合成不对称集群合成的关键在于手性诱导,而手性配体催化剂的选择和设计成为影响不对称集群合成效果的主要因素之一。
近年来,研究者通过确定催化反应中的限速步骤,并借助密度泛函理论计算,设计出一系列具有高催化活性和手性诱导活性的手性配体催化剂。
这些催化剂可以选择性地催化亲核试剂与底物的反应,从而实现所需产物的不对称合成。
三、策略二:连位/全位控制在不对称集群合成中,连位/全位控制是实现手性诱导的关键步骤。
通过合理选择催化剂和底物结构,可以实现连位/全位控制,进而实现所需手性产物的合成。
在最近的研究中,研究者发现通过引入取代基或合理设置底物的立体位阻等手段,可以实现连位/全位控制,提高反应的立体选择性。
四、应用实例及进展利用不对称集群合成方法合成依波加明类单萜吲哚生物碱的实例也越来越多。
例如,研究者利用以环丙基取代的吲哚底物和以钌为催化剂的不对称集群合成方法合成了一种新型依波加明类生物碱。
该方法通过设计合理的底物结构和手性配体催化剂,实现了高立体选择性和产率的合成,为该类化合物的合成提供了新的思路。

2010年第30卷有机化学V ol. 30, 2010第9期, 1305~1313 Chinese Journal of Organic Chemistry No. 9, 1305~1313jlliu@E-mail:*Received December 17, 2009; revised March 27, 2010; accepted May 27, 2010.国家自然科学基金(Nos. 20872118, 30070905)、教育部博士点基金(No. 20070697012)、陕西省重大科技专项(No. 2008ZDKG-67)和陕西省重点实验室基金(No. 08JZ74)资助项目.1306有 机 化 学 V ol. 30, 2010到的一种单萜吲哚生物碱[8], 它对2种人类癌细胞MOR-P 和COR-L23呈现出细胞毒性[9], 具有抗癌药开发前景. 经确定其结构如1所示[10]: 由五环构成, 主环为氮杂二环[3,3,1]壬烷并吲哚, 分子式为C 21H 24N 2O 2, 1具有与 Macroline (2)相同的骨架结构, 因此在分类上归于Macroline 类生物碱[11]. 又因其结构特异、生物活性好, 加上天然含量极少, 因而其合成工作一直吸引着化学家. 从1969年结构鉴定至今, 有很多出色的合成工作已经研究成功. 本文按照成环的关键反应就其合成方法进行综述, 以促进相关研究的进步.1 基于Pictet-Spengler 反应的合成方法Pictet-Spengler 反应是合成单萜吲哚生物碱的常用方法. 以D -(+)-色氨酸(3)为原料, 经过N-甲基化及羧基酯化反应得4. 4经过还原胺化、苄基保护N 得5. 5与2-酮戊二酸(6)经过Pictet-Spengler 反应得到三环化合物7. 最后经过Dieckmann 缩合得到四环酮的衍生物8. 8用盐酸和醋酸脱羧基得四环酮9. 反应路线如Scheme 1所示, 经过7步反应, 总收率为47%[10]. 用该方法[12]首次在实验室成功地合成出大约100 g 的9.Yu 等[13]在此基础上做了一些改进, 用色氨酸甲酯代替色氨酸, 避免了使用Na/NH 3 (l)的反应. 同时把五步反应放在两个反应容器中进行, 大大缩短了分离时间, 使效率得以提高. 反应如Scheme 2所示. 从目前来看, 四环酮类化合物的合成常采用色氨酸为原料经过数步反应得到. 其原料易得路线成熟, 是合成Macroline 类生物碱的重要中间体[11].以上述得到的9与三氟甲磺酸甲酯反应, 然后催化氢解得到N 甲基取代的14, 再经过两步反应得到α,β-不饱和醛15. 以LiAlH 4选择性还原15得到烯丙醇16, 然后经过Micheal 加成反应得到17, 接着发生分子内重排得到二羰基化合物18. 用NaBH 4还原得到二醇19, 进一步对其进行环外双键的硼氢化氧化得到三醇20. 把20环化得到醇21, 最后经温和的Swern [14]氧化得到目标产物1 (Scheme 3). 该课题组首次合成出天然产物Alstonerine, 并确定了其立体构型[15].Yu 课题组[16]采用类似的方法以化合物13经两步反应得到不饱和醛22, 然后与由E -1-溴-2-戊烯衍生的钡盐反应得到1,2加成产物23, 氧杂Cope 重排得到24a 和24b 的混合物. 将该混合物长时间地放置于碱性环境中, 24a 将全部转化为24b . 24b 经N 甲基化并还原羰基得到25, 接着氧化关环得到五环化合物26, 脱水得27, 用N -苯硒代邻苯二甲酰亚胺进行硒加成得到28, 然后氧化、消除、重排经中间体29得到醇30. 再经过Swern 氧化得31, 最后经甲氧基消除、N 甲基化通过中间产物32得到目标产物1(Scheme 4).Scheme 1Scheme 2No. 9周华凤等: 单萜吲哚生物碱Alstonerine 的合成研究进展1307Scheme 3Scheme 41308有 机 化 学 V ol. 30, 2010上述合成方法都是在Pictet-Spengler 反应的基础上得到四环酮, 进一步通过氧化、还原、Claisen 重排、环合等完成对目标产物的合成. 合成路线步骤较多, 总产率仅4%左右. 该课题组还用同样的方法对Alstophylline [17]进行了全合成. 另外, Craig 课题组[18]报道了一种类似于Pictet-Spengler 反应合成1的方法. 以4,4-二(苯磺酰基)环戊烯(33)为原料, 与萘基锂作用得到34, 34与L -色氨酸的氮丙啶衍生物35反应得到36, 然后氧化双键得到邻二醇37, 37通过氧化、酸化经二醛中间体发生分子内Pictet-Spengler 反应关环得到38. 38进一步反应得到烯醇醚39. 39与甲醛进行氧杂-Diels-Alder 反应得五环化合物40, 由40到终产物的研究在进行中(Scheme 5). 该方法以Pictet-Spengler 反应、氧杂-Diels- Alder 反应为主要手段得到合成1的中间体, 利用比较简单的转化构建出氮杂二环化合物.2 基于Fisher 反应的合成方法Fisher 反应是合成吲哚生物碱的主要方法, 该方 法[19,20]是以双环氧化物41为原料, 与苄胺反应得到两个二环化合物42和43. 二者混合物在三氟乙酸酐的作用下发生构型转化得到[3.3.1]二环化合物43, 进一步与氯化叔丁基二甲基硅反应得到6位羟基被保护的醚44, 保护基转换得到45, 经Swern 氧化, 去掉保护基得环酮46. 46与N -甲基苯肼(47)发生Fisher 反应关环合成吲哚衍生物48, 氧化得到外消旋体9 (Scheme 6). 本方法是先形成[3,3,1]二环化合物, 然后再形成吲哚, 产率为25%, 后面的合成步骤与Scheme 3中9到1的方法相同.3 基于[4+2]环加成的合成方法用溴代乙酸乙酯(49)与乙氧羰基亚甲基三苯基膦Scheme 5Scheme 6No. 9周华凤等: 单萜吲哚生物碱Alstonerine 的合成研究进展1309(50)反应得到膦盐51, 然后与乙酰氯反应得到累积二烯烃52. 同时, N -甲基-吲哚-2-甲醛(53)与邻硝基苯磺酰胺反应得到亚胺54. 52与54进行[4+2]环加成得非对映异构体混合物55, 在酸性条件下发生分子内傅克酰基化反应得到四环化合物56, 经Fukuyamas 试剂脱磺酰基得到57, 然后经过三步反应得到合成Alstonerine 的关键中间体16. 后面的合成步骤与Scheme 3中16到1的方法相同. 该方法[21]首次将[4+2]环加成用于Macroline 型吲哚生物碱的合成. 与分子内傅克酰基化反应结合起来很好地构建出桥环结构(Schemes 7, 8). 共9步反应, 总收率为31%.4 基于Pauson-Khand 反应的合成方法以L -色氨酸(60)为原料, 一步反应得到二氢咔啉 61[22]. 61与苄氧羰基氯反应得到62, 接着与烯丙基三甲基硅(63)反应得到化合物64(其中顺∶反=5.5∶1, 经过柱色谱分离得到). 64经过二异丁基铝氢还原, 再发生Witting 反应得到烯炔65[23], 然后发生Pauson-Khand 反应得到五环中间体66[24]. 为了进一步验证66与目标产物立体结构的一致性, 将66中N 上的氢用叔丁基取代得到晶体67, 进行X 衍射分析确定其与1具有相同的立体构型. 在Karsted 催化剂作用下67转化为烯醇醚化合物68 (Scheme 9).Scheme 7Scheme 8Scheme 91310有 机 化 学 V ol. 30, 2010用化学计量的OsO 4氧化68然后用H 2S 还原得到α-羟基酮的消旋体69, 再在MeOH 中与Pb(OAc)4反应经醛酯中间体还原得到羟基酯70, 内酯化后得到71(Scheme 10).Scheme 10上述实验中OsO 4和铅试剂的用量较大, 考虑到环境和经济因素, 该课题组改进为: 在NaIO 4存在下用催化量的OsO 4氧化68得到醛酯72, 再进一步还原、酸化关环得到内酯71 (Scheme 11).Scheme 1171脱羰基成为二氢吡喃73, 对其进行傅克酰基化反应, 并脱去两个N 上的保护基团, 通过中间产物74, 75得到76, 进一步用不同的方法对N 进行甲基化得到1 (Scheme 12). 该合成方法首次将Pause-Khand 反应用来制备N -杂双环化合物, 高产率、高立体选择性地构建出环戊烯酮结构, 从 L -色氨酸出发, 经过十几步反应得到终产物, 总收率为4.4%[25].Scheme 125 以天然产物为起始原料的半合成方法单萜吲哚生物碱具有多样性结构, 它们之间也可以进行结构转化, 即半合成. 5.1 以Ajamline 为原料的合成Ajamline (77)于1931年从Rauwolfia serpentina 的根部分离得到的, 具有良好的抗心律失常作用[26]. 该合成方法[27]以此为原料, 在Schotten-Baumann 条件下77与苄氧羰基氯反应保护21位的羟基, 得到碳酸酯78. 用等物质的量的Pb(OAc)4氧化得到79, 79与DBU 在干燥的THF 中被异构化成80. 接着用NaBH 4还原得到醇81, 断裂N(4)-C(21)键, 羟基与C(21)形成半缩醛82. 为了在C(19)和C(20)位之间引入双键, 把82与溴苯硒反应得到缩醛83, 氧化得到84a 和84b 的混合物. 再氧化84a 中的双键得到仲醇85a 和85b , 直接经Swern 氧化得86, 从缩醛脱去甲醇形成双键得到终产物1 (Scheme 13).5.2 以Affinisine 及其对映体异构体为原料的合成Affinisine (97)是最早从Alstonia macrophylla 中分离得到的, 具有延迟意向震颤的作用. 97及其对映体异构体92都可以被转化为1及其对映异构体96, Cook 课题组[28]以四环酮9的异构体87为起始原料在K 2CO 3存在下与Z -1-溴-2-碘-2-丁烯(88)反应得到酮89, 分子内环化得90. 90经过Witting 反应转化成91, 还原得到天然产物Affinisine 的对映异构体92. 以此为原料经叔丁基二甲基硅保护得到醚93, 硼氢化氧化得到仲醇94, 经过No. 9周华凤等: 单萜吲哚生物碱Alstonerine 的合成研究进展1311Scheme 13Swern 氧化得到95. 95可以通过已知步骤[29]得到产物1的对映异构体96 (Scheme 14).在上述合成的基础上该课题组对合成方法进行了一些改进[30], 如下图所示从天然产物97开始, 保护羟基得醚98, 双键经硼氢化氧化为99a 和99b , 氧化羟基得酮100, 进一步转化得到101, 101发生Tsuji-Wacker 氧化[31]得到1(Scheme 15).Scheme 141312有 机 化 学 V ol. 30, 2010Scheme 156 仿生合成1属于单萜吲哚生物碱中的Macroline (2)组, 尽管2还没有从天然产物中分离得到, 但它仍被认为是这组生物碱的重要中间体. 和其他单萜吲哚生物碱一样, 这组生物碱也是由色胺(102)和裂环马钱素(103)缩合形成Strictosidine (104), 并经过下述过程衍生而来(Scheme 16)[33]. 那么, 把2在温和的条件下经过111和112转变成1就自然被认为是仿生合成[32](Scheme 17).Scheme 16Scheme 17No. 9 周华凤等: 单萜吲哚生物碱Alstonerine的合成研究进展13137 展望单萜吲哚生物碱因其结构多样性和重要的生物活性, 多年来一直吸引着天然产物化学家、合成化学家、药物化学家等对其进行深入广泛的研究. 对这些生物碱的合成研究不仅能够得到多样性的化合物, 为生物活性评价及构效关系研究提供样品, 为理解这些化合物的生物合成机制提供信息, 同时也能促进有机合成方法的进步, 进而可能发现简便经济的方法为此类化合物的应用打下基础. 因此, 这仍然是一个很有吸引力的研究领域.References1Liu, J.-L. Chin. J. Org. Chem.2003, 23, 784 (in Chinese).(刘建利, 有机化学, 2003, 23, 784.)2Lee, C. C.; Houghton, P. J. Ethnopharmacol.2005, 100, 237.3Kam, T.-S.; Iek, I.-H.; Choo, Y.-M. Phytochemistry1999, 51, 839.4Ratnayake, C. K.; Arambewela, L. S. R.; De Silva, K. T. D.Phytochemistry 1987, 26, 868.5Kam, T.-S.; Choo, Y.-M. Phytochemistry 2004, 65, 603.6Macabeo, A. P. G.; Krohn, K.; Gehle, D.; Read, R. W.; Bro-phy, J. J.; Cordell, G. A.; Franzblau, S. G.; Aguinado, A. M.Phytochemistry 2005, 66, 1158.7Keawpradub, N.; Kirby, G. C.; Steele, J. C. P.; Houghton, P.J. Planta Med. 1999, 65, 690.8Cook, J. M.; Quesne, P. W. L.; Elderfield, R. C. Chem.Commun. 1969, 1306.9Keawpradub, N.; Eno-Amooquay, E.; Burke, P. J.; Hough-ton, P. J. Planta Med. 1999, 65, 311.10Zhang, L.-H.; Cook, J. M. J. Am. Chem. Soc.1990, 112, 4088.11Lewis, S. E. Tetrahedron2006, 62, 8655.12Zhang, L.-H.; Bi, Y.-Z.; Yu, F.-X.; Menzia, G.; Cook, J. M.Heterocycles 1992, 34, 517.13Yu, P.; Wang, T.; Yu, F.; Cook, J. M. Tetrahedron Lett.1997,38, 6819.14Mancuso, J.; Huang, S.-L.; Swern, S. J. Org. Chem. 1978, 43, 2480.15Bi, Y.-Z.; Zhang, L.-H.; Hamaker, L. K.; Cook, J. M. J. Am.Chem. Soc. 1994, 116, 9027.16Yu, P.; Wang, T.; Li, J.; Cook, J. M. J. Org. Chem. 2000, 65, 3173.17Liu, X.-X.; Deschamp, J. R.; Cook, J. . Lett. 2002, 20, 3339.18Cox, P.; Craig, D.; Ioannidis, S.; Rahn, V. S. Tetrahedron Lett.2005, 46, 4687.19Michel, P.; Rassat, A. J. Org. Chem. 2000, 65, 2572.20Gennet, D.; Michel, P.; Rassat, A. Synthesis2000, 447.21Tran, Y. S.; Kwon, O. Org. Lett.2005, 7, 4289.22Martin, S. F.; Chen, K. X.; Eary, C. T. Org. Lett.1999, 1,79.23Neipp, C. E.; Martin, S. F. J. Org. Chem. 2003, 68, 8867.24Miller, K. A.; Martin, S. F. Org. Lett.2007, 9, 1113.25Miller, K. A.; Shanahan, C. S.; Martin, S. F. Tetrahedron 2008, 64, 6884.26Li, J.; Wang, T.; Yu, P.; Peterson, A.; Weber, R.; Soerens, D.;Grubisha, D.; Bennett, D.; Cook, J. M. J. Am. Chem. Soc.1999, 121, 6998.27Takayama, H.; Phisalaphong, C.; Kitajima, M.; Aimi, N.;Sakai, S.-I. Tetrahedron 1991, 47, 1383.28Liu, X.-X.; Wang, T.; Xu, Q.-G.; Ma, C.-R.; Cook, J. M.Tetrahedron Lett. 2000, 41, 6299.29Esmond, R. W.; Le Quesne, P. W. J. Am. Chem. Soc. 1980, 102, 7116.30Liao, X.-B.; Zhou, H.; Yu, J.-M.; Cook, J. M. J. Org. Chem.2006, 71, 8884.31Liao, X.-B.; Zhou, H.; Wearing, X.-Y. Z.; Ma, J.; Cook, J.. lett. 2005, 7, 3501.32Garnick, R. L.; Le Quesne, P. W. J. Am. Chem. Soc.1978, 100, 4213.33Saxton, J. E. Indoles, Part Four, The Monoterpenoid Indole Alkaloids, John Wiley and Sons, New York, 1983, p. 7, p.22, p. 40.(Y0912174 Cheng, B.)。
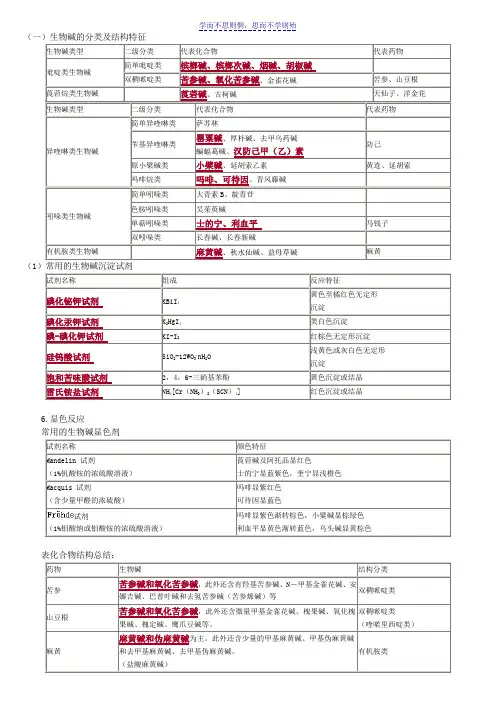
(一)生物碱的分类及结构特征(1)常用的生物碱沉淀试剂6.显色反应试剂糖的分类:单糖(1个糖):葡萄糖、鼠李糖、阿拉伯糖、葡萄糖醛酸、木糖、甘露糖、半乳糖、半乳糖醛酸;寡糖(2~9个糖):蔗糖、麦芽糖、龙胆二糖、新橙皮糖、芸香糖(二糖);五)醌类显色反应三、含醌类的中药实例大纲要求:以下药物化学结构类型及质量控制成分:大黄、虎杖、何首乌、芦荟、决明子(蒽醌)丹参(菲醌)第五节香豆素与木脂素一、香豆素的结构类型及理化性质(一)定义香豆素的母核为苯骈α-吡喃酮。
香豆素分为五大类,即简单香豆素类、呋喃香豆素类、吡喃香豆素类、异香豆素类及其他香豆素类。
5.显色反应二、含香豆素的中药实例香豆素类代表化合物总结木脂素的结构、性质及中药实例结构分类与代表化合物:三、黄酮的显色反应四、含黄酮的中药实例(1)黄芩、葛根、银杏叶、槐花、陈皮、满山红(二)挥发油的性质1.颜色:少数挥发油具有其他颜色,如薁类多显蓝色,佛手油显绿色,桂皮油显红棕色。
2.嗅味:多具浓烈的特异性嗅味(其嗅味常是其品质优劣的重要标志),有辛辣灼烧感。
3.析脑:冷却条件下主要成分常可析出结晶。
4.挥发性:挥发油因挥发而不留油迹,脂肪油则留下永久性油迹;可随水蒸气蒸馏。
5.溶解性:不溶于水。
6.稳定性:遇光、空气、加热易氧化变质。
挥发油与空气及光线经常接触会逐渐氧化变质,使挥发油的相对密度增加,颜色变深,失去原有香味,形成树脂样物质,不能随水蒸气蒸馏。
2.含挥发油类化合物的常用中药皂苷是一类结构复杂的苷类化合物,其苷元为具有螺甾烷及其有相似生源的甾族化合物或三萜类化合物。
大多数皂苷水溶液用力振荡可产生持久性的泡沫,故称为皂苷。
皂苷的结构可分为苷元和糖两个部分。
如果苷元为三萜类化合物则称为三萜皂苷,苷元为螺甾烷类化合物,则称为甾体皂苷。
(一)三萜皂苷1.定义:苷元为三萜类化合物,其基本骨架由6个异戊二烯(30个碳)单位组成。
分类:四环三萜(羊毛甾烷型、达玛烷型)五环三萜(齐墩果烷型、乌苏烷型、羽扇豆烷型) 特点:多含羧基,显酸性。

喜树碱的研究进展作者:黄永鑫来源:《科技创新导报》 2011年第4期黄永鑫(黑龙江中医药大学药学院哈尔滨 150040)摘要:本文对喜树碱的分布、代谢和环境调控,以及生产前景方面的研究进展进行了概述。
关键词:喜树碱环境调控生产前景中图分类号:X17 文献标识码:A 文章编号:1674-098X(2011)02(a)-0005-011 引言喜树碱(Camptothecin,CPT)是一种修饰的单萜吲哚类生物碱(monoterpenoid indole-alkaloids,TIAs)。
CPT具有较高抗癌活性,1985年,Hsiang发现其通过抑制拓扑异构酶来发挥细胞毒性的独特的抗癌机理,而重新得到广泛的重视[1]。
目前第一代CPT类药物irinotecan与topotecan主要用于治疗卵巢癌、结肠癌和肺癌,据估计仅2003年市场份额就达到10亿美元。
2 CPT的分布CPT最早从珙桐科(Nyssacae)喜树属植物喜树(Camptotheca acuminata)中分离得到。
随着研究的不断的扩展,陆续其它植物中亦发现CPT的积累。
但多数含量极低,未受到人们重视,仅喜树、臭假柴龙树具有较高水平的CPT含量。
喜树由于其丰富的CPT含量,成为了目前市场上CPT及其衍生物产品获取的主要天然资源。
喜树中全株均含有CPT,但各器官含量差异较大。
含量最高的器官是幼叶,达到了干重的0.4%,分别是种子与树皮(两种CPT的最初采集器官)中含量的1.5倍和2.5倍[2]。
臭假柴龙树是继喜树之后发现的又一富含CPT的植物,其体内还含有喜树中未发现的较高水平的9-甲氧基CPT。
臭假柴龙树树皮中具有较高水平的CPT,分别含有干重0.27%的CPT和0.11%的9-甲氧基CPT,随后是根、茎、叶,其中根CPT含量是叶的2.6倍,而树皮的CPT含量是叶的4.5倍。
臭假柴龙树中亦发现未成熟组织CPT含量较高的现象:未成熟种子CPT含量达到了0.32%,是成熟种子的2倍[3]。

单萜吲哚生物碱的仿生合成
单萜吲哚生物碱的仿生合成
单萜吲哚生物碱因其骨架和官能团的丰富变化,加上它们的生物活性,多年来一直吸引着一代又一代的化学家对其进行结构和合成研究.它们的共同生物合成前体strictosidine是由色胺和单萜苷secologanin缩合形成的.自从secologanin可以大量得到以后,以它为原料沿着可能的`生物合成路线合成天然生物碱即仿生合成就成为一个重要的研究领域.它对于理解和阐释生物碱的生物合成过程,为提供天然来源极少的生物碱供药理试验及对促进有机合成化学的发展等都有重要意义.这方面的研究也取得了许多重要进展,成功合成了一些重要的单萜吲哚生物碱,如育亨宾类、钩藤碱、异钩藤碱、卡得宾、利血平类似物、喜树碱等.。



目录摘要 (1)Abstract: (2)1.概述 (3)2.分类 (3)2.1 单萜吲哚生物碱 (3)2.1.1.重排单萜吲哚生物碱 (4)2.1.2.非重排单萜吲哚生物碱 (5)2.2双聚单萜吲哚生物碱 (5)2.3与单萜吲哚碱相关的生物碱 (5)3.单萜吲哚生物碱的化学合成 (7)3.1柯南因-的士宁碱类的合成 (7)3.1.1.士的宁的合成 (8)3.1.2 最新的柯南因类生物碱的合成方法 (14)3.2白坚木碱类 (16)3.3双吲哚类生物碱的合成 (17)3.3.1.长春碱的合成 (17)3.3.2.马钱子碱的合成 (20)3.3.2.1.Mangus,P.小组的合成策略 (20)3.3.2.2.Overman小组的合成策略 (21)3.3.2.3.Mori小组的合成策略 (22)3.3.2.4.Tobru Fukuyama,小组的合成策略 (23)3.4.灯台碱类 (24)参考文献 (26)摘要:生物碱是自然界中种类繁多且拥有生物活性的一类物质,因为其显著的生物活性,近年来有关生物碱的研究异常活跃,这些研究在医学研究与生物化学领域有着重要的地位。
在生物碱中,单萜吲哚生物碱因其优异而广泛的生物活性又是其中十分重要的一类。
本文综述了吲哚生物碱的分类和生物活性以及一些重要的单萜吲哚生物碱的合成,如柯南因-士的宁碱类、白坚木碱类、灯台碱类与长春碱、马钱子碱等重要双吲哚类生物碱的合成。
并介绍了Mangus.P小组、Overman小组、Mori小组与Tobru Fukuyama小组的合成策略。
Abstract:Alkaloid compounds that are numerous in the nature have remarkable biological activities giving rise to the hyperactive studies of alkaloids in recent years. These studies have an important position in the medical research and biological chemistry field .Among the alkaloids,Monoterpenoid Indole Alkaloid is an significant one because of its excellent and extensive biological activity. This paper reviewed the classification and biological activities of indole alkaloids and some important synthesis of Monoterpenoid indole alkaloids,such as Strychnine,Aspidosperma,Echitamine , vinblastine and Stychnine。
依波加明类单萜吲哚生物碱的集群合成和倍半萜类化合物Mitchellene B的合成探究专业品质权威编制人:______________审核人:______________审批人:______________编制单位:____________编制时间:____________序言下载提示:该文档是本团队精心编制而成,期望大家下载或复制使用后,能够解决实际问题。
文档全文可编辑,以便您下载后可定制修改,请依据实际需要进行调整和使用,感谢!同时,本团队为大家提供各种类型的经典资料,如办公资料、职场资料、生活资料、进修资料、教室资料、阅读资料、知识资料、党建资料、教育资料、其他资料等等,想进修、参考、使用不同格式和写法的资料,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!And, this store provides various types of classic materials for everyone, such as office materials, workplace materials, lifestyle materials, learning materials, classroom materials, reading materials, knowledge materials, party building materials, educational materials, other materials, etc. If you want to learn about different data formats and writing methods, please pay attention!依波加明类单萜吲哚生物碱的集群合成和倍半萜类化合物Mitchellene B的合成探究依波加明类单萜吲哚生物碱的集群合成和倍半萜类化合物Mitchellene B的合成探究摘要:依波加明类单萜吲哚生物碱是一类具有重要生物活性的自然产物,具有广泛的药理活性和潜在的医药探究价值。
蕊木属单萜吲哚生物碱(+)-Arboridinine的不对称全合成研究蕊木属单萜吲哚生物碱(+)-Arboridinine的不对称全合成研究摘要:蕊木属单萜吲哚生物碱(+)-Arboridinine是一种具有潜在药理活性的复杂天然产物。
由于其独特的结构和生物活性,合成该化合物成为有机合成领域的一大挑战。
在本文中,我们报道了一种不对称全合成路线,成功地合成了(+)-Arboridinine。
引言:蕊木属单萜吲哚生物碱(+)-Arboridinine被广泛应用于药物研发领域,并显示出抗氧化、抗病毒和抗肿瘤等多种活性。
然而,其复杂的结构和低产量限制了其研究和开发。
因此,设计高效、不对称的全合成路线成为合成化学家的目标。
方法:我们采用了一个多步反应的合成路线,从简单的前体开始,经历了一系列关键的中间体合成和立体选择性的控制,最终得到了目标化合物(+)-Arboridinine。
结果和讨论:在合成过程中,我们成功地建立了吲哚环和萜环结构,并使得目标化合物主要产生成(3R,4aR,5S,7R,7aR)-(+)-Arboridinine。
在最后一步的手性诱导反应中,通过选择合适的手性配体和催化剂,我们实现了对(+)-Arboridinine的立体选择性控制。
结论:通过本研究,我们成功地合成了(+)-Arboridinine,并建立了一条高效的不对称全合成路线。
这一成果为该复杂天然产物的研究提供了可行的合成方法,并为开发具有生物活性的衍生物打下了基础。
此外,我们的研究也为不对称合成方法学的发展做出了贡献。
展望:尽管我们已成功合成了(+)-Arboridinine,但在合成过程中仍面临多个挑战,例如高成本的合成前体、较低的产率等。
因此,我们将进一步改进合成路线,提高产率和经济性,并探索更多的应用领域和化合物修饰方法。
我们相信,随着对(+)-Arboridinine及其衍生物更深入的研究,将进一步推动药物研发领域的发展本研究成功合成了目标化合物(+)-Arboridinine,并建立了一条高效的不对称全合成路线。
芍药甙的结构修饰赵红岩【期刊名称】《农产品加工·创新版》【年(卷),期】2016(000)003【摘要】芍药甙是从中药白芍、赤芍等中提取出来的一种单萜苷类化合物,它有1个蒎烷骨架及1个缩醛结构,这一结构在一定的酸性条件下可水解为成醛基。
经水解后,芍药甙的主要功能基团与断马钱子苷(Secologanin)较为相似(都具有单萜及醛基的结构),而Secologanin即是合成单萜吲哚类生物碱的主要前体物。
可以用芍药甙作为前体物,对其进行结构修饰,主要是与吲哚类(色氨酸,5-羟基色氨酸)作用,来合成一类全新的单萜吲哚类生物碱。
此项工作将为进一步研究单萜吲哚类生物碱的丰富结构提供依据,并为新药的研制与开发提供一个新的思路。
%Paeoniflorin is a monoterpenoid which is isolated from Paeonia lasectiflora pall, and shown to possess the pinene skeleton unit. Moreover, it has unique structure which can be hydrolyzed into aldehyde under the certain acidic condition. The paeoniflorin can be seen as a simple monoterpenoid. The structural features common to paeoniflorin and monoterpenoid glucoside secologanin which is used as the starting matter in the synthesis of monoterpenoid indole alkaloids. Most monoterpenoid indole alkaloid contain two structural elements: tryptamine and unit derived from secologanin.Therefore, it is certain that we can employ paeoniflorin as the unit by condensation with tryptamine to synthesize the new kind of monoterpenoid indole alkaloid. This experiment will not onlyprovide more documents for the further study up on the rich variey of functionality and skeleton of monoterpenoid indole alkaloids, but also a new idea for the exploitation of new medicine.【总页数】2页(P68-69)【作者】赵红岩【作者单位】陕西学前师范学院生物科学与技术系,陕西西安 710061【正文语种】中文【中图分类】R284.1【相关文献】1.HPLC测定益胃胶囊中芍药甙、橙皮甙、甘草酸的含量 [J], 张善飞;郭平平;田燕华;吴昊2.白芍总甙、芍药甙和白芍总甙去除芍药甙对佐剂性关节炎大鼠的免疫调节作用[J], 葛志东;周爱武3.芍药甙和去芍药甙白芍总甙对佐剂性关节炎大鼠脾淋巴细胞产生白介… [J], 葛志东;魏伟4.芍甙脉康冲剂中芍药甙含量测定研究 [J], 李守拙;何慧君5.古汉养生精片中淫羊藿甙,芍药甙,黄芪甲甙,齐墩果酸及枸杞子,人… [J], 杨永华;刘奕晖因版权原因,仅展示原文概要,查看原文内容请购买。
中药马钱子中十个单萜吲哚类生物碱1H NMR谱综述
刘亮镜;祁俊;潘扬
【期刊名称】《现代中药研究与实践》
【年(卷),期】2015(029)004
【摘要】目的总结马钱子单萜吲哚类生物碱不同结构系列的1H NMR谱规律.方法通过查阅前人对马钱子中生物碱类成分的研究文献,并综述有文献报道的马钱子中生物碱类成分的1H NMR谱.结果根据其生物碱都是以士的宁为母核的特性,同一系列的1H NMR谱生物碱具有相似的规律.结论根据这些规律可以简便、快速的鉴别马钱子中的生物碱.
【总页数】3页(P81-83)
【作者】刘亮镜;祁俊;潘扬
【作者单位】芜湖市中医医院,安徽芜湖241 000;芜湖市中医医院,安徽芜湖241 000;南京中医药大学中医药研究院,江苏南京210029
【正文语种】中文
【中图分类】R284.1;R917
【相关文献】
1.吲哚衍生物的1H NMR谱研究 [J], 周勇;姚霞君;恽榴红
2.盆架树中单萜吲哚生物碱成分的分离与结构鉴定 [J], 郭峰;郁建平;张于;苑春茂;何红平
3.药用狗牙花的单萜吲哚生物碱类成分 [J], CHENG Chunlei;YUAN Mengfei;XIE Jing;ZHANG Jian;ZHANG Xiaoqi;YE Wencai
4.思茅山橙中的单萜吲哚生物碱类成分(英文) [J], 何隽;张发雷;望石琴;王淙薇;崔琴丹;冯涛
5.螺吲哚啉萘并噁嗪衍生物的 ̄1H、 ̄(13)C NMR谱法研究 [J], 刘买利;常旭红;杜文虎
因版权原因,仅展示原文概要,查看原文内容请购买。
盆架树中单萜吲哚生物碱成分的分离与结构鉴定郭峰;郁建平;张于;苑春茂;何红平【期刊名称】《天然产物研究与开发》【年(卷),期】2014(026)003【摘要】本文对夹竹桃科盆架树属盆架树(Winchia calophylla A.DC.)小枝的化学成分进行了研究,从其甲醇提取物中分离得到4个单萜吲哚生物碱.采用波谱技术并结合文献分别鉴定为echitamidine、17-O-acetyl-Nb-demethylechitamine、Nb-demethylechitamine、Nb-demethylechitamine N-oxide.【总页数】3页(P361-363)【作者】郭峰;郁建平;张于;苑春茂;何红平【作者单位】贵州大学生命科学学院,贵阳550025;中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室,云南昆明650201;贵州大学生命科学学院,贵阳550025;中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室,云南昆明650201;中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室,云南昆明650201;中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室,云南昆明650201【正文语种】中文【中图分类】R284.2【相关文献】1.虎眼万年青单萜内酯新成分的分离及结构鉴定 [J], 白进发;刘志强;王淑敏;宋凤瑞;刘淑莹2.同物异名植物盆架树化学成分及药理活性研究进展 [J], 尤钰琳; 孙雪明; 李菲菲; 王姝麒3.同物异名植物盆架树化学成分及药理活性研究进展 [J], 尤钰琳; 孙雪明; 李菲菲; 王姝麒4.思茅山橙中的单萜吲哚生物碱类成分(英文) [J], 何隽;张发雷;望石琴;王淙薇;崔琴丹;冯涛5.海南蕊木化学成分的研究──Ⅰ.根中单吲哚生物碱的分离与鉴定 [J], 运文慧;陈玉武;冯孝章因版权原因,仅展示原文概要,查看原文内容请购买。