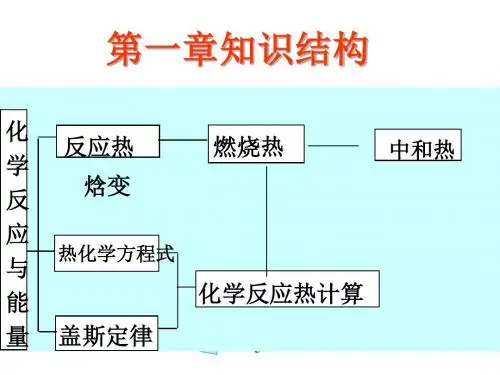
关于反应热的计算完美版
- 格式:pdf
- 大小:550.31 KB
- 文档页数:5



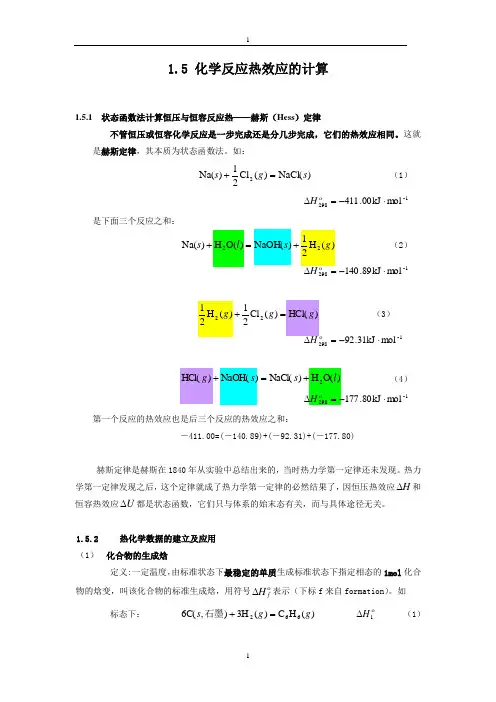
1.5 化学反应热效应的计算1.5.1 状态函数法计算恒压与恒容反应热——赫斯(Hess )定律不管恒压或恒容化学反应是一步完成还是分几步完成,它们的热效应相同。
这就是赫斯定律,其本质为状态函数法。
如:)NaCl()(Cl 21)Na(2s g s =+(1)-1298mol kJ 00.411⋅-=∆ H是下面三个反应之和:)NaOH()O(H )Na(2s l s =+ (2)-1298mol kJ 89.140⋅-)HCl()(Cl 212g g =+ (3)-1298mol kJ 31.92⋅-=∆H)O(H)NaCl()NaOH()HCl(2l s s g +=+ (4)-1298mol kJ 80.177⋅-=∆ H第一个反应的热效应也是后三个反应的热效应之和:-411.00=(-140.89)+(-92.31)+(-177.80)赫斯定律是赫斯在1840年从实验中总结出来的,当时热力学第一定律还未发现。
热力学第一定律发现之后,这个定律就成了热力学第一定律的必然结果了,因恒压热效应H ∆和恒容热效应U ∆都是状态函数,它们只与体系的始末态有关,而与具体途径无关。
1.5.2 热化学数据的建立及应用 (1) 化合物的生成焓定义:一定温度,由标准状态下最稳定的单质生成标准状态下指定相态的1mol 化合物的焓变,叫该化合物的标准生成焓,用符号f H ∆表示(下标f 来自formation )。
如标态下:)(H C )(3H ),C(6662g g s =+石墨1H ∆ (1)标态下:)(H C )(H ),C(2222g g s =+石墨2H ∆ (2)那么)(H C ,66g f H ∆= 1H ∆)(H C ,22g f H ∆=2H ∆什么是最稳定的单质呢?如25℃,1atm.下,碳有石墨、无定型及金刚石三种相态,其中只有石墨是最稳定的相态,故生成反应中当涉及到最稳定的单质碳时必须是石墨。

化学反应热的计算知识点一:盖斯定律1、盖斯定律的内容不管化学反应是一步完成或分几步完成,其反应热是相同的.换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
2、盖斯定律直观化△H=△H1+△H23、盖斯定律的应用(1)有些化学反应进行很慢或不易直接发生,很难直接测得这些反应的反应热,可通过盖斯定律获得它们的反应热数据。
例如:C(s)+0.5O2(g)=CO(g)上述反应在O2供应充分时,可燃烧生成CO2、O2供应不充分时,虽可生成CO,但同时还部分生成CO2。
因此该反应的△H无法直接测得。
但是下述两个反应的△H却可以直接测得:C(S)+O2(g)=CO2(g) △H1=-393.5kJ/molCO(g)+0.5 O2(g)=CO2(g) △H2=-283.0kJ/mol根据盖斯定律,就可以计算出欲求反应的△H。
分析上述反应的关系,即知△H1=△H2+△H3△H3=△H1-△H2=-393.5kJ/mol--(-283.0kJ/mol)=-110.5kJ/mol由以上可知,盖斯定律的实用性很强。
(2)在化学计算中,可利用热化学方程式的组合,根据盖斯定律进行反应热的计算。
(3)在化学计算中,根据盖斯定律的含义,可以根据热化学方程式的加减运算,比较△H的大小。
知识点二:反应热的计算根据热化学方程式、盖斯定律和燃烧热的数据,可以计算一些反应的反应热。
反应热、燃烧热的简单计算都是以它们的定义为基础的,只要掌握了它们的定义的内涵,注意单位的转化即可。
热化学方程式的简单计算的依据:(1)热化学方程式中化学计量数之比等于各物质物质的量之比;还等于反应热之比。
(2)热化学方程式之间可以进行加减运算。
【规律方法指导】有关反应热的计算依据归纳1、根据实验测得热量的数据求算反应热的定义表明:反应热是指化学反应过程中放出或吸收的热量,可以通过实验直接测定。
例如:燃烧6g炭全部生成气体时放出的热量,如果全部被水吸收,可使1kg水由20℃升高到67℃,水的比热为4.2kJ/(kg·℃),求炭的燃烧热。

初中化学常见化学反应的热效应解析与计算化学反应的热效应是指反应过程中释放或吸收的能量。
热效应是研究化学反应的基本内容之一,它可以帮助我们了解反应的放热或吸热性质,从而更好地掌握化学反应的规律。
本文将解析和计算初中化学中常见的一些化学反应的热效应。
1. 反应热的表达方式反应热可以通过热变化(△H)来表示。
当反应放热时,△H为负值,表示系统从外界吸收了热量;当反应吸热时,△H为正值,表示系统向外界释放了热量。
反应热的单位通常为焦耳/摩尔(J/mol)。
2. 反应热的计算方法反应热的计算可以使用热效应的标准计算公式:△H = ∑(△H[生成物]) - ∑(△H[反应物]),其中,△H[生成物]表示生成物的热效应,△H[反应物]表示反应物的热效应。
根据不同反应的特点,我们可以采用不同的计算方法。
例如,对于化学反应A + B → C,如果我们已知A和B的热效应为△H[A]和△H[B],则可以通过计算得到化学反应的热效应△H[C]。
假设△H[A] = -100 kJ/mol,△H[B] = -200 kJ/mol,那么根据计算公式:△H[C] = △H[C] - (△H[A] + △H[B]) = -300 kJ/mol。
3. 常见化学反应的热效应下面举例说明几个常见的化学反应及其热效应的计算方法。
3.1 酸碱中和反应的热效应酸碱中和反应是一种常见的反应类型。
对于酸碱中和反应,反应热的计算方法比较简单,可以直接使用△H = m·c·△T的公式进行计算。
其中,m表示溶液的质量,c表示溶液的比热容,△T表示溶液温度的变化。
例如,当1mol的盐酸和1mol的氢氧化钠发生中和反应时,根据反应的化学方程式:HCl + NaOH → NaCl + H2O可以得到反应热为-57.1 kJ/mol。
这时,如果我们知道反应物的质量和初始和终止温度的差值,就可以使用公式△H = m·c·△T来计算反应热。

化学反应的热效应计算化学反应的热效应是指在化学反应过程中释放的热量或吸收的热量。
了解和计算化学反应的热效应对于理解反应过程的热力学性质和化学平衡有着重要的作用。
本文将介绍热效应的概念及其计算方法。
一、热效应的概念热效应是化学反应中热量的变化量,可分为两种情况:吸热反应和放热反应。
吸热反应是指在反应过程中吸收热量,反应物的内能增加;放热反应是指在反应过程中释放热量,反应物的内能减少。
根据热力学第一定律,热效应可以用以下公式计算:ΔH = H(生成物) - H(反应物)其中,ΔH表示热效应,H(生成物)表示生成物的焓,H(反应物)表示反应物的焓。
二、热效应的计算方法根据化学反应的平衡方程式,可以通过化学方程式中物质的摩尔系数和热效应的关系来计算热效应。
1. 单一物质热效应对于单一物质的热效应,可以通过该物质的标准热效应计算。
标准热效应是指在标准状态下,1摩尔物质完全反应产生的热效应。
2. 化学反应热效应对于化学反应的热效应计算,需要根据反应方程式中物质的摩尔系数和标准热效应来计算。
以以下反应为例:2H2(g) + O2(g) → 2H2O(g)可以根据反应方程式中的摩尔系数和标准热效应来计算热效应:ΔH = 2ΔH(H2O) - [2ΔH(H2) + ΔH(O2)]其中,ΔH(H2O)表示水的标准热效应,ΔH(H2)表示氢气的标准热效应,ΔH(O2)表示氧气的标准热效应。
三、热效应计算的实例以氯化钠的溶解反应为例进行热效应的计算。
NaCl(s) → Na+(aq) + Cl-(aq)根据该反应方程式和已知的标准热效应数据,可以计算出热效应的值。
ΔH = [ΔH(Na+(aq)) + ΔH(Cl-(aq))] - ΔH(NaCl(s))其中,ΔH(Na+(aq))表示钠离子在水溶液中的标准热效应,ΔH(Cl-(aq))表示氯离子在水溶液中的标准热效应,ΔH(NaCl(s))表示氯化钠晶体的标准热效应。

第三节化学反应热的计算【重难点】1.理解盖斯定律的本质,了解其在科学研究中的意义2.掌握有关盖斯定律的应用【知识点】一、盖斯定律1.盖斯定律的内容:不管化学反应是一步或分几步完成,其反应热是相同的。
或者说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
2、盖斯定律的特点①.反应热效应只与始态、终态有关,与反应的途径无关。
就像登山至山顶,不管选哪一条路走,山的海拔总是不变的。
②.反应热总值一定。
如下图表示始态到终态的反应热,则ΔH=ΔH1+ΔH2=ΔH3+ΔH4+ΔH5。
二、盖斯定律的应用对于进行得很慢的反应,不容易直接发生的反应,产品不纯(即有副反应发生)的反应,测定反应热有困难,如果应用盖斯定律,就可以间接地把它们的反应热计算出来。
例如:(1)C(s)+O2(g)=CO2(g)ΔH1=-393.5 kJ·mol-1(2)CO(g)+O2(g)=CO2(g)ΔH2=-283.0 kJ·mol-1求C(s)+O2(g)=CO(g)的反应热。
解析:根据上述两个反应的关系可知:ΔH1=ΔH2+ΔH3,ΔH3=ΔH1-ΔH2=-393.5 kJ·mol-1-(-283.0 kJ·mol-1)=-110.5 kJ·mol-1所以C(s)+O2(g)=CO(g)ΔH3=-110.5 kJ·mol-1三、应用盖斯定律计算反应热时应注意的事项1.热化学方程式中物质的化学计量数同乘以某一个数时,反应热数值也必须乘上该数。
2.热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减。
3.将一个热化学方程式颠倒时,ΔH的“+”、“-”号必须随之改变。
4.若热化学方程式需相减,最好能先把被减方程式进行颠倒,然后相加,更不易出错。
典例导析知识点1:盖斯定律的意义例1实验中不能直接测出由石墨和氢气反应生成甲烷的反应热,但可通过测出CH4、石墨及H2燃烧反应的反应热,再求由石墨生成甲烷的反应热。

高中化学的解析如何计算化学反应的反应热化学反应的反应热是描述化学反应吸热或放热性质的重要物理量,能够反映化学反应所释放或吸收的热量大小。
在高中化学中,学生需要学习如何计算化学反应的反应热,从而更好地理解和应用化学知识。
本文将介绍解析计算化学反应的反应热的相关方法和原理。
一、化学反应的反应热的定义和表达式化学反应的反应热指的是化学反应在常压下吸收或释放的热量。
通常以ΔH表示,单位是焦耳(J)或千焦(kJ)。
化学反应的反应热可以通过下述表达式来计算:ΔH = ∑(产物的摩尔热焓 - 反应物的摩尔热焓)其中,ΔH代表化学反应的反应热,∑代表求和运算,产物和反应物的摩尔热焓分别表示一摩尔产物和反应物在标准状态下的热焓。
二、计算化学反应的反应热的步骤计算化学反应的反应热一般分为以下几个步骤:1. 确定化学反应方程式首先,需要根据实验数据或已知条件来确定化学反应方程式。
化学反应方程式描述反应物转化为产物的过程,必须准确无误。
2. 根据方程式确定反应物和产物的物质的摩尔量根据方程式中的化学计量关系,计算出化学反应中反应物和产物的摩尔量。
3. 确定反应物和产物的摩尔热焓根据已知的热焓数据,确定反应物和产物在标准状态下的摩尔热焓。
热焓数据可以通过查阅参考书籍或相关资料获得。
4. 计算反应热将反应物和产物的摩尔热焓代入化学反应的反应热表达式中,进行计算。
注意计算时需注意各物质的系数和符号。
5. 若需要,将反应热进行转换根据具体问题的需要,可能要将反应热从焦耳转换为千焦或者相反。
三、实例分析以乙醇燃烧反应为例,介绍如何计算化学反应的反应热。
C2H5OH(l) + 3O2(g) -> 2CO2(g) + 3H2O(l)根据上述反应方程式,我们可以知道反应物乙醇(C2H5OH)、氧气(O2)和产物二氧化碳(CO2)以及水(H2O)之间的化学计量关系。
根据需要,我们可以获得下述热焓数据:ΔH1 = -1368.5 kJ/mol(C2H5OH)ΔH2 = -393.5 kJ/mol(CO2)ΔH3 = -285.8 kJ/mol(H2O)根据计算化学反应的反应热的步骤,我们将上述数据代入表达式:ΔH = (2×ΔH2 + 3×ΔH3) - (ΔH1 + 3×0)计算结果为:ΔH = (2×-393.5 kJ/mol + 3×-285.8 kJ/mol) - (-1368.5 kJ/mol + 0)= -1137.3 kJ/mol因此,乙醇燃烧反应的反应热为-1137.3 kJ/mol。

高中反应热的公式高中反应热的公式是热反应物质间发生化学反应时所释放或吸收的热量。
反应热的计算对于理解化学反应的能量变化非常重要,因为它可以告诉我们反应是否是放热或吸热的,以及反应的强度和方向。
在化学反应中,反应物会发生化学变化,生成新的产物。
在这个过程中,化学键会被打破和形成,从而释放或吸收能量。
反应热的公式可以通过测量反应前后的温度差来计算,或者根据已知的热值来推导。
一般情况下,反应热可以根据下面的公式来计算:反应热 = 生成物的热量 - 反应物的热量其中,生成物的热量是指反应产物形成时释放或吸收的能量,反应物的热量是指反应物发生化学变化时释放或吸收的能量。
反应热的计算需要知道反应物和生成物的热量。
这些热量可以通过实验测量得到,也可以根据已知的标准热量值来推导。
在实验中测量反应热时,可以使用热量计来测量反应前后的温度变化,从而计算出反应热。
反应热的符号表示也很重要。
如果反应热为正值,表示反应是吸热的,即反应物吸收了热量;如果反应热为负值,表示反应是放热的,即反应物释放了热量。
这个符号可以告诉我们反应的强度和方向。
如果反应热为正,表示反应是不利的,需要消耗能量才能进行;如果反应热为负,表示反应是有利的,能够自发进行。
反应热的计算可以帮助我们理解化学反应的能量变化。
例如,在燃烧反应中,燃料与氧气发生化学反应,产生二氧化碳和水。
这个过程是放热的,因为燃料释放了能量。
反应热的计算可以告诉我们燃烧反应的强度和方向,以及所释放的能量数量。
总结起来,高中反应热的公式是热反应物质间发生化学反应时所释放或吸收的热量。
通过计算反应热,我们可以了解化学反应的能量变化,判断反应的强度和方向。
反应热的计算需要知道反应物和生成物的热量,可以通过实验测量或者已知的标准热量值来得到。
符号表示反应热的正负,正值表示吸热反应,负值表示放热反应。
反应热的计算对于理解化学反应的能量变化非常重要,有助于我们深入研究化学反应的本质和特性。
化学反应的热效应与反应热的计算化学反应是物质发生变化的过程,而在化学反应中,往往伴随着热效应的发生。
热效应是指化学反应中伴随着的能量变化,也是根据热力学定律进行反应热的计算的基础。
本文将介绍化学反应的热效应以及反应热的计算方法。
一、热效应的分类化学反应的热效应可以分为两种:吸热反应和放热反应。
吸热反应指在反应过程中吸收外界热量,导致周围环境温度降低。
而放热反应则指在反应过程中释放出热量,导致周围环境温度升高。
对于吸热反应来说,该过程需要外界提供能量,因此反应前的组成物比反应后的生成物具有较高的内能。
而放热反应则是反应中内能的降低,因此反应后生成物的内能较高。
二、反应热的定义与计算反应热是指单位质量或单位物质参与反应时,反应所发出(释放)或吸收的热量。
反应热是进行反应热计算的基础。
计算反应热的一般公式如下:ΔH = m × c × ΔT其中,ΔH为反应热,m为物质的质量,c为物质的热容量,ΔT为温度的变化。
在计算反应热时,有一些需要注意的地方。
首先,要确定反应热的符号。
对于放热反应,反应热通常为负值,而对于吸热反应,反应热通常为正值。
其次,要确定计算的物质质量。
通常情况下,可以通过已知物质的质量与反应方程式的化学计量比例关系,来确定其他物质的质量。
此外,还需要确定物质的热容量。
热容量是指物质单位质量的温度变化时所需要吸收或释放的热量。
三、热效应与反应类型的关系热效应与反应类型之间存在一定的关系。
例如,对于氧化反应来说,通常是放热反应。
当物质与氧气发生氧化反应时,因为氧元素会与其他元素形成更强的化学键,从而释放出能量。
另外,对于酸碱中和反应、盐类析晶水反应以及氧化还原反应等,也常常是放热反应。
而在合成反应和水解反应中,通常是吸热反应。
四、热效应的应用热效应的研究对于一些重要的化学反应具有重要意义。
首先,它对于控制反应的方向和速率有着重要意义。
在化学反应中,反应物的热效应与生成物的热效应之间的差异,决定了反应方向。