符合Amsterdam-I标准的遗传性非息肉病性结直肠癌家
- 格式:ppt
- 大小:2.46 MB
- 文档页数:26

在我们身边的林奇综合征家族史是结直肠癌患病风险的最重要影响因素之一,大约1/3的结直肠癌患者有家族史.一个家族中出现多个结直肠癌患者,可能是因为存在共同的环境和或遗传易感因素。
林奇综合征(LS)是一种常染色体显性遗传疾病,患者易患各种类型的癌症,包括结直肠癌(患病风险70%~80%)、子宫内膜癌(EC)(50%~60%)、胃癌(13%~19%)、卵巢癌(9%~14%)、小肠癌、肝癌、胆道癌、输尿管癌以及肾盂移行细胞癌等等。
林奇综合征的致癌倾向源于一组错配修复蛋白的基因结构的改变,失活的错配修复蛋白导致基因组中的微卫星高度不稳定性,随着时间的推移,微卫星以及基因组其他部位突变的积累可以影响细胞内重要功能蛋白的数量或活性,从而引起肿瘤的发生。
林奇综合征相关的癌症与散发性癌症相比,具有不同的病理及临床特征,因此治疗与管理也与散发性癌症有所不同,所以对林奇综合征的鉴别诊断也就显得非常重要。
既往该病的诊断主要依赖于家族史,但由于现在的家庭逐渐趋于小型化、家系成员居住分散化、癌前病变接受内镜治疗增加等相关因素导致该病容易漏诊。
据估计,全世界每279个人就有1人患林奇综合征,但是有95%的林奇综合征患者不知道他们的诊断。
因此,最为重要的是,我们应尽一切可能来诊断林奇综合征患者。
为了将林奇综合征筛选出来,国内外的学者们先后提出了多个筛查标准。
(1)阿姆斯特丹Ⅰ(AmsterdamⅠ)标准:这是第一个林奇综合征的筛查标准,它于1990首次提出,需要同时满足以下 4 项:(1)家系中至少有3个人确诊结直肠癌,其中一个为另外两个的一级亲属;(2)至少累及2代;(3)其中1个发病年龄<50岁;(4)排除家族性息肉病。
(2)阿姆斯特丹Ⅱ(AmsterdamⅡ)标准:与阿姆斯特丹Ⅰ标准的区别就在于把结直肠癌换成了林奇综合征相关肿瘤,所有林奇综合征相关肿瘤都可用于筛查林奇综合征。
与阿姆斯特丹Ⅰ标准相比,Ⅱ的漏诊率降低了很多,但是仍然高达62.5%~68%;特异性也只有约50%。

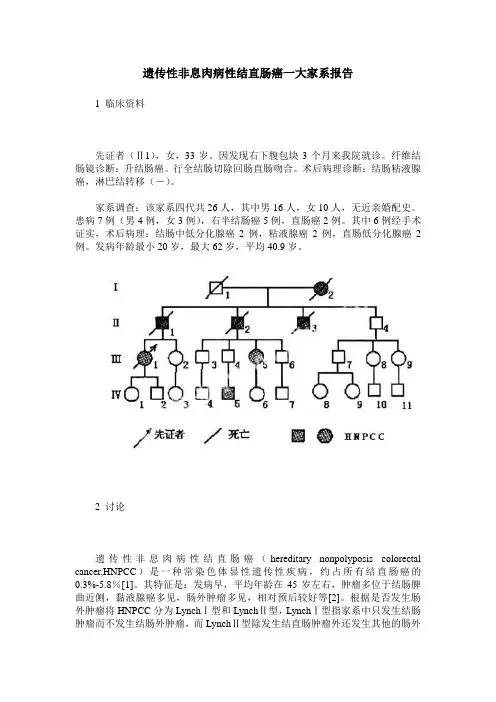
遗传性非息肉病性结直肠癌一大家系报告1 临床资料先证者(Ⅱ1),女,33岁。
因发现右下腹包块3个月来我院就诊。
纤维结肠镜诊断:升结肠癌。
行全结肠切除回肠直肠吻合。
术后病理诊断:结肠粘液腺癌,淋巴结转移(-)。
家系调查:该家系四代共26人,其中男16人,女10人,无近亲婚配史。
患病7例(男4例,女3例),右半结肠癌5例,直肠癌2例。
其中6例经手术证实,术后病理:结肠中低分化腺癌2例,粘液腺癌2例,直肠低分化腺癌2例。
发病年龄最小20岁,最大62岁,平均40.9岁。
2 讨论遗传性非息肉病性结直肠癌(hereditary nonpolyposis colorectal cancer,HNPCC)是一种常染色体显性遗传性疾病,约占所有结直肠癌的0.3%-5.8%[1]。
其特征是:发病早,平均年龄在45岁左右,肿瘤多位于结肠脾曲近侧,黏液腺癌多见,肠外肿瘤多见,相对预后较好等[2]。
根据是否发生肠外肿瘤将HNPCC分为LynchⅠ型和LynchⅡ型,LynchⅠ型指家系中只发生结肠肿瘤而不发生结肠外肿瘤,而LynchⅡ型除发生结直肠肿瘤外还发生其他的肠外肿瘤如子宫内膜癌、胃癌、卵巢癌、膀胱癌等。
1991年成立的HNPCC国际合作组织(ICG-HNPCC)制定了HNPCC诊断标准,即所谓的AmstendamⅠ标准[3]。
HNPCC-ICG于1999年修订了Amsterdam标准,称为Amsterdam标准Ⅱ[4]。
目前已经确认HNPCC的遗传学基础是错配修复基因(mismatch repair genes,MMR)突变,已经克隆出的错配修复基因有hMLH1、hMSH2、hMSH6、hPSM1、hPSM2、hMSH3 和hMSH5,其表达产物为错配修复蛋白,是一种核酸水解蛋白,可以水解DNA复制过程中错配的碱基,从而保证DNA的精确复制。
如果该基因突变,DNA复制错误增加,出现微卫星(MSI)不稳定而导致大肠癌和其他肠外肿瘤的增加。


遗传性非息肉性结直肠癌诊疗进展【关键词】遗传性非息肉性结直肠癌诊疗进展遗传性结直肠癌在所有结直肠癌患者中大约占5%~10%,其中遗传性非息肉性结直肠癌(hereditary nonpolyposis colorectal cancer, HNPCC)也称Lynch综合征,是最常见的一种遗传性结直肠癌综合征,约占全部结直肠癌的1%~5%。
HNPCC在我国并未引起足够的重视,常常漏诊。
随着科学技术的进步以及分子遗传学的快速发展,我国的结直肠癌专家们也开始注意到HNPCC,正确认识HNPCC的发病特点、遗传学特征以及临床治疗方法对有效防治结直肠癌有十分重要的意义。
在发现和处理结直肠癌患者的同时,应该想到如何鉴别散发性结直肠癌和HNPCC,因为此病的临床表现及处理与一般的大肠癌有所不同,而且有利于发现患者家族中的现症患者和即将发生的患者,及时采取积极的防治措施,降低结直肠癌的发病率。
1 病因及发病机制HNPCC在西方国家报道较多,据文献统计,约占结直肠癌的0.3%~5.8%[1],国内有关HNPCC的报道较少,约占同期收治结直肠癌的2.4%。
综合世界各地报道,HNPCC约占所有结直肠癌的1%~5%[2]。
目前认为HNPCC的产生和多种因素所导致的错配修复基因(mismatch match repair genes,MMR)基因突变有关。
由于HNPCC家族的前几代人患胃癌较多,而胃癌的发生被认为是与饮食习惯关系最密切的恶性肿瘤,所以有人认为:HNPCC和饮食习惯关系最为密切。
MMR基因突变使得MMR蛋白表达缺失并造成了DNA重复序列(也称微卫星位点,microsatellites site)的修复错误,从而导致患者DNA出现微卫星不稳定(microsatellites instability,MSI),MSI是HNPCC的基因标志[3]。
文献报道含有MMR基因突变的患者较未突变者更容易发生结肠腺瘤,并且发现年龄提前,腺瘤多位于近侧结肠且较大,多为绒毛状或伴有高度不典型增生等癌前病变表现[4],而结肠腺瘤恶变是HNPCC家族患者患结肠癌的主要途径。

Lynch综合征,也被称为遗传性非息肉性结直肠癌综合征(HNPCC),是一种遗传性的癌症综合征,主要与结直肠癌和其他消化道癌症的发生相关。
Lynch综合征是由一些基因突变引起的,主要是MLH1、MSH2、MSH6和PMS2等DNA错配修复基因的突变。
诊断Lynch综合征通常需要满足一系列的标准。
根据Amsterdam I和Amsterdam II标准以及Bethesda指南,以下是Lynch综合征的主要诊断标准:
1、个人层面标准:
●早发结直肠癌:患者应为50岁以前发生结直肠癌。
●家族病史:患者的一级或二级亲属中,应有3代中至少有2例结
直肠癌或其他相关肿瘤(如子宫内膜癌、卵巢癌、胃癌、小肠癌、上尿路癌等)。
2、分子遗传学标准:
●检测错配修复基因:对患者进行MLH1、MSH2、MSH6、PMS2等
错配修复基因的遗传检测,确认是否存在突变。
如果患者符合上述个人层面和分子遗传学标准,且排除了遗传性息肉病(如FAP),则可以被诊断为Lynch综合征。



《遗传性结直肠癌临床诊治和家系管理中国专家共识》要点《遗传性结直肠癌临床诊治和家系管理中国专家共识》是由我国结直肠癌临床诊治领域的专家共同制定的一份指南,旨在为遗传性结直肠癌的诊断、治疗和家系管理提供准确、规范的指导。
下面将从要点的角度介绍该专家共识的主要内容。
一、遗传性结直肠癌的定义与分类共识明确了遗传性结直肠癌的定义,即在没有明显环境因素干扰的情况下,由一种或多种突变所致的肿瘤。
根据突变所在的基因和传递方式,遗传性结直肠癌被分为常染色体显性遗传性结直肠癌、常染色体隐性遗传性结直肠癌和X-连锁遗传性结直肠癌。
二、遗传性结直肠癌的诊断和筛查共识提出了遗传性结直肠癌的诊断和筛查的具体指导原则。
在家族中有2例或以上结直肠癌病例,或者有1例结直肠癌病例伴有其他遗传性肿瘤综合征时,应进行遗传性结直肠癌的筛查。
筛查包括家族史采集、基因突变筛查、肿瘤相关标志物检测以及结肠镜检查等。
三、遗传性结直肠癌的治疗共识详细介绍了遗传性结直肠癌的治疗原则和方案。
在手术治疗中,依据患者的具体情况进行个体化治疗,包括局部切除、结直肠切除、淋巴结清扫和中远期预防等。
对于晚期或转移性遗传性结直肠癌,还提供了靶向治疗和免疫治疗等新型治疗手段。
四、遗传性结直肠癌的家系管理共识强调了遗传性结直肠癌的家系管理的重要性。
家系管理包括家族史采集、突变筛查、预防性筛查和教育指导等方面。
对于突变阳性的家族成员,需要进行定期的肿瘤筛查,以早期发现和早期干预。
五、其他相关问题综上所述,《遗传性结直肠癌临床诊治和家系管理中国专家共识》是一份权威且实用的指南,为遗传性结直肠癌的诊断、治疗和家系管理提供了重要的参考。
其内容涵盖了遗传性结直肠癌的定义、诊断筛查、治疗方案和家系管理等方面,对于提高遗传性结直肠癌的防治水平具有重要的指导意义。

遗传性结直肠癌诊疗面临的问题和挑战2024摘要近年来随着对遗传出绪直肠癌的研究不断加深,新发患者的诊断率逐年上升。
但是某些患者的临床症状不典型并且趋向年轻化,易出现漏诊或误诊,甚至被当成散发型结直肠癌,从而延误患者的治疗。
熟悉和掌握遗传性结直肠癌的鉴别和诊断方法有利千识别潜在或高危遗传性结直肠癌患者。
本文主要对遗传性结直肠癌中Lynch综合征和家族性腺瘤性息肉病的患癌风险、漏诊、误诊、手术选择及家系管理相关进展进行综述,以启示临床工作者要重视遗传出绪直肠癌的诊断和治疗。
遗传性结直肠癌(he reditary colorectal cancer, HCR C)占所有结直肠癌患者的5%~6%,这其中又以Lynch综合征(Lynch syndrome, LS) 和家族阳捩瘤性息肉病(family adenomatous polyposis, FAP)多见[, 21近年来临床上HCR C比例上升,患者的临床症状不典型并且趋千年轻化,易出现漏诊和误诊现象。
临床医师应熟悉并掌握HCR C的临床表现、诊断及鉴别诊断,及时发现潜在或高危患者,对确诊家系进行科学管理,早诊断、早治疗。
然而,HCR C在临床上仍存在诸多棘手问题,如漏诊、误诊、手术方式与时机选择以及家系管理等。
本文主要对HCR C中L S和FAP的患癌风险、涌诊、误诊、手术选择及家系管理进行归纳总结,以提供临床医师进行诊疗参考。
—、HCR C相关的肿瘤发生风险高1.L S患癌的风险:LS是由错配修复基因MLH1、MSH2、MSH6、PMS2及EPCAM等发生胚系突变引起错配修复(mismatch repair, MM R)蛋白缺失或失活,错配修复系统失控导致微卫星(microsatellite instabilit y, MSI)不稳定的一类常染色体显性遗传病。
LS患者可累及消化系统、泌尿生殖系统及神经系统等,与其相关的肿瘤包括结直肠癌、子宫内膜癌、卵巢癌、尿路上皮癌,膀胱癌、胃癌、小肠癌、胰腺癌、胆管癌、前列腺癌、乳腺癌和脑癌等[3],其中结直肠癌的患癌风险最高,L S患者一生罹患结直肠癌的概率可达40%~80%,到80岁时根据突变基因不同,累积风险分别是MLH1(46%~61%� MSH2(33%~52% � MSH6(10%~44%入PMS2 (8.7%~20%),一般风险人群一生发病率为4.2%[ 41LS是最常见的HCR C,占所有结直肠癌的2%~4%,按中国2016年结直肠癌的新发病例数40.8万估算,2016年新发8160~16320例[51 -项Meta研究发现147个LS家族(6342人)中确诊结直肠癌628例,其中68.3%的男性患者和56.6%的女性患者在50岁之前诊断出结直肠癌,其发病年龄远低千一般风险人群[61其次,在女性L S患者中,子宫内膜癌发病率也高,为25%~60%[ 4 ], 80岁的累积风险分别为M L H1 (34%~54%)、MSH2(21 %~57%)、MSH6(16%~49%)、PMS2 (13%~26%),一般风险人群一生发病率仅为3.1%。

结直肠癌遗传变异相关基因初步鉴定报告结直肠癌是一种常见的恶性肿瘤,遗传变异被认为是导致该疾病发生的主要原因之一。
为了进一步了解结直肠癌遗传变异的相关基因,我们进行了初步的鉴定研究。
本报告将对我们的研究结果进行介绍。
在本次研究中,我们选取了一组结直肠癌患者和一组健康对照组。
通过对这些样本进行次代测序,我们获得了大量的遗传信息。
我们首先对这些数据进行了质量控制和预处理,确保了数据的可靠性。
随后,我们将数据与已知的遗传变异数据库进行比对。
我们鉴定出了一系列与结直肠癌遗传变异相关的基因。
这些基因可以被进一步分为两类:致病基因和易感基因。
在致病基因方面,我们发现突变状态频率较高的基因包括APC、KRAS、TP53和SMAD4。
这些基因的突变状态已经在许多研究中与结直肠癌的发生和发展密切相关。
其中,APC基因突变是结直肠癌最为常见的突变类型之一,这一结果与现有的研究结果一致。
此外,KRAS、TP53和SMAD4基因的突变也与结直肠癌的预后和治疗反应有关。
在易感基因方面,我们发现了一些可能与结直肠癌易感性相关的基因。
这些基因包括MLH1、MSH2、MSH6和PMS2等。
这些基因的突变可能会增加个体患结直肠癌的风险。
我们的结果与现有的遗传流行病学研究一致,进一步证实了这些基因在结直肠癌发生中的重要作用。
除了上述已知的致病基因和易感基因,我们还发现了一些新的潜在相关基因。
这些基因还需进一步的研究来验证它们与结直肠癌之间的关联。
我们相信,在未来的研究中,这些新的基因有望为我们揭示结直肠癌的发病机制和治疗靶点提供新的线索。
总结起来,我们通过对结直肠癌患者和健康对照组的遗传数据进行初步鉴定,发现了一系列与结直肠癌遗传变异相关的基因。
这些基因可以被进一步分为致病基因和易感基因。
在致病基因方面,我们鉴定出了APC、KRAS、TP53和SMAD4等已知的重要基因。
在易感基因方面,我们发现了MLH1、MSH2、MSH6和PMS2等可能增加结直肠癌风险的基因。
遗传性非息肉性结直肠癌陈昌望;珠珠;董坚【期刊名称】《世界华人消化杂志》【年(卷),期】2013(0)28【摘要】遗传性非息肉性结直肠癌(hereditary nonpolyposis colorectal cancer,HNPCC)又称为lynch综合征(lynch syndrome,LS)是一种常染色体显性遗传性疾病.临床特点是:发病年龄早,多见于右半结肠,伴同时性或异时性肠外恶性肿瘤如子宫内膜癌、胃癌、卵巢癌等,预后比散发性结直肠癌好.对高危家系人群的筛查和干预能有效降低结直肠及肠外恶性肿瘤的发生率和死亡率.本文对HNPCC发病机制、流行病学、临床诊断、筛查、预防和治疗做一综述.【总页数】6页(P2963-2968)【关键词】遗传性非息肉性结直肠癌;错配修复基因;微卫星不稳定;诊断筛查【作者】陈昌望;珠珠;董坚【作者单位】昆明医科大学第一附属医院肿瘤内科;昆明医科大学第一附属医院肿瘤科【正文语种】中文【中图分类】R735.3【相关文献】1.分子诊断在家族性腺瘤性息肉病和遗传性非息肉病性结直肠癌家族中的作用 [J], 金黑鹰2.遗传性弥漫性胃癌伴遗传性非息肉病性结直肠癌一家系 [J], 于俊秀;杨道贵;任玉波;辛福泽3.中国部分地区结直肠癌遗传易感性与遗传性非息肉病性结直肠癌流行状况分析[J], 张渊智;盛剑秋;李世荣;武子涛4.瑞典遗传性非家族性腺瘤性息肉病和非遗传性非息肉病性结肠直肠癌家系的基因组连锁分析 [J], Djureinovic; T.; Skoglund; J.; Vandrovcova; J.; 程妍(译); 陈云茹(校)5.遗传性非息肉性结直肠癌综合征的β连环蛋白外显子3基因突变与结直肠癌密切相关 [J], Johnson V.;Volikos E.;Halford S.E.;A.R.J. Silver;雒向宁因版权原因,仅展示原文概要,查看原文内容请购买。
遗传性非息肉性结肠直肠癌:一种新的遗传性结肠直肠癌病种的临床和分子学证据Mueller-Koch Y;Vogelsang H;Kopp R.;E. Holinski-Feder;郑世成【期刊名称】《世界核心医学期刊文摘:胃肠病学分册》【年(卷),期】2006(0)4【摘要】Background: Hereditary non-polyposis colorectal cancer (HNPCC) is clinically defined by familial clustering of colorectal cancer and other associated tumours. Methods: By thorough molecular and clinical evaluation of 41 families, two dif ferent groups were characterised: group 1, 25 families with truncating mutations in MLH1 or MSH2 (12 novel mutations); and group 2, 16 Amsterdam positive famili es without mutations in these genes and without microsatellite instability in th eir corresponding tumours. Results: Significant clinical differences between the se two groups were found. Firstly, earlier age of onset for all colorectal cancers (median 41 v 55 years; p < 0.001) and all tumours (median 4 3 v 56 years; p = 0.022) was observed, comparing groups 1 and 2. Secondly,68%o f the index colorectal cancers were localised proximally of the splenic flexure in group 1 compared with 14%in group 2 (p < 0.010). Thirdly, more synchronous a nd metachronous colorectal (p = 0.017) and extracolorectal tumours (p < 0.001) w ere found in group 1. Fourthly, a higher colorectal adenoma/carcinoma ratio (p = 0.030) and a tendency towards more synchronousor metachronous adenomas in group 2 (p =0.084) was observed, indicating a slower progression of adenomas to carc inomas. As three mutation negative tumours revealed chromosomal instability afte r comparative genomic hybridisation, these tumours may be caused by one or more highly penetrant disease alleles from the chromosomal instability pathway. Concl usion: These data show that HNPCC includes at least two entities with clinical a nd molecular differences. This will have implications for surveillance programme s and for cancer research.【总页数】2页(P42-43)【关键词】结肠直肠癌;分子学;直肠结肠癌;结肠直肠腺瘤;家族聚集性;发病年龄;阿姆斯特丹地区;不稳定性;非同步【作者】Mueller-Koch Y;Vogelsang H;Kopp R.;E. Holinski-Feder;郑世成【作者单位】Centre of Medical Genetics, Bayerstrasse 53, 80336 München, Germany,Dr.【正文语种】中文【中图分类】R735.3【相关文献】1.遗传性非息肉病性结直肠癌与散发性结肠癌的临床特征及生存率对比分析 [J], 张升瑞;隋春阳;赵连和2.遗传性非息肉病性结直肠癌的分子生物学特点和临床特征 [J], 管莎莎;戴广海3.遗传性非息肉病性结肠直肠癌的家系和临床研究 [J], 刘合代4.遗传性非息肉性结肠直肠癌患者中移码突变累积对结肠直肠癌发生发展的作用[J], Yamaguchi; T.; lijima; T.; Mori; T.; M.Miyaki,5.瑞典遗传性非家族性腺瘤性息肉病和非遗传性非息肉病性结肠直肠癌家系的基因组连锁分析 [J], Djureinovic; T.; Skoglund; J.; Vandrovcova; J.; 程妍(译); 陈云茹(校)因版权原因,仅展示原文概要,查看原文内容请购买。
武汉地区八个家系遗传性非息肉病性结直肠癌的临床特点陈超;陈继贵;王倩【期刊名称】《临床误诊误治》【年(卷),期】2007(20)7【摘要】目的:探讨武汉地区遗传性非息肉病性结直肠癌(hereditary nonpolyposis colorectal cancer,HNPCC)家系发病情况及临床特点.方法:收集8个遗传性HNPCC家系,其中符合Amsterdam标准Ⅱ2个,Japan标准5个,Bethesda指导原则1~3项1个,分析其临床特点.结果:8个家系107人,有癌症患者20例.平均年龄53.35岁,发病高峰年龄50~59岁.20例中肠癌15例,其中右半结肠癌5例,左半结直肠癌10例;肠外癌5例.结论:武汉地区HNPCC家系与散发性结直肠癌(sporadic colorectal cancer,SCRC)相比具有发病年龄轻、肠外癌发病率高、常见多原发癌及好发于右半结肠的特点,某些特点与国内其他地区不完全相同.【总页数】3页(P14-16)【作者】陈超;陈继贵;王倩【作者单位】武汉市第八医院,武汉,430010;武汉市第八医院,武汉,430010;武汉市第八医院,武汉,430010【正文语种】中文【中图分类】R574【相关文献】1.武汉地区遗传性非息肉病性结直肠癌的临床特点分析 [J], 陈超;陈继贵;张宇星;刘畅2.遗传性非息肉病性结直肠癌8个家系临床及病理分析 [J], 王瑜;杨磊;丁彦青;童晶3.遗传性非息肉病性结直肠癌一大家系报告 [J], 刘文杰4.瑞典遗传性非家族性腺瘤性息肉病和非遗传性非息肉病性结肠直肠癌家系的基因组连锁分析 [J], Djureinovic; T.; Skoglund; J.; Vandrovcova; J.; 程妍(译); 陈云茹(校)5.遗传性非息肉病性结直肠癌家系中胃癌的特征和在家系遴选中价值 [J], 崔龙;金黑鹰;孟荣贵;张晓春;阎于悌;喻德洪因版权原因,仅展示原文概要,查看原文内容请购买。
MLH1、MSH2基因 mRNA突变分析与遗传性非息肉性结直肠癌的基因诊断王朝夫;周晓燕;张太明;孙孟红;徐烨;施达仁【期刊名称】《中华医学遗传学杂志》【年(卷),期】2006(023)001【摘要】目的检测胚系MLH1和MSH2基因mRNA突变,确立遗传性非息肉性结直肠癌(hereditary nonpolyposis colorectal cancer, HNPCC)家系.方法收集符合Amsterdam标准Ⅱ的12个家系14名家庭成员外周血,用特异引物和耐热性逆转录酶特异地逆转录MLH1和MSH2的RNA;利用长模板PCR扩增酶扩增逆转录产物(cDNA);测序分析扩增产物.提取外周血的DNA,设计与利用上述方法检测出突变对应外显子的特异性引物,利用Taq DNA聚合酶扩增测序,以检测上述方法的有效性.结果利用基于外周血mRNA的方法,在6个家系中检出6个胚系突变,4个MLH1突变和2个MSH2突变,MLH1突变分别位于第8、12、16和第19外显子;MSH2突变分别位于第1和第2外显子.利用基于外周血DNA的方法,上述突变均在MLH1和MSH2相应的外显子中得到验证.突变类型为4个错义突变、1个同义突变和1个非编码区突变;其中5个突变国际上尚未报道; 6个突变中有5个为病理性,分布于5个不同家系,该5个家系被确诊为HNPCC家系.结论基于外周血MLH1和MSH2 mRNA异常的检测能确诊HNPCC家系;该方法敏感、省时、节约成本.【总页数】5页(P32-36)【作者】王朝夫;周晓燕;张太明;孙孟红;徐烨;施达仁【作者单位】200032,上海,复旦大学附属肿瘤医院分子病理室,复旦大学上海医学院肿瘤学系;200032,上海,复旦大学附属肿瘤医院分子病理室,复旦大学上海医学院肿瘤学系;200032,上海,复旦大学附属肿瘤医院分子病理室,复旦大学上海医学院肿瘤学系;200032,上海,复旦大学附属肿瘤医院分子病理室,复旦大学上海医学院肿瘤学系;200032,上海,复旦大学附属肿瘤医院分子病理室,复旦大学上海医学院肿瘤学系;200032,上海,复旦大学附属肿瘤医院分子病理室,复旦大学上海医学院肿瘤学系【正文语种】中文【中图分类】R73【相关文献】1.遗传性非息肉病性结直肠癌错配修复基因MLH1启动子甲基化研究2.hEXO1基因突变与中国人遗传性非息肉病性结直肠癌的相关性3.遗传性非息肉病性结直肠癌中COX-2的表达及与MMR基因表达的分析4.结直肠癌患者MLH1和MSH2基因突变的转变分析5.瑞典遗传性非家族性腺瘤性息肉病和非遗传性非息肉病性结肠直肠癌家系的基因组连锁分析因版权原因,仅展示原文概要,查看原文内容请购买。