趋化因子及其受体在免疫细胞中的作用
- 格式:docx
- 大小:453.92 KB
- 文档页数:6

免疫细胞和免疫因子的生物学特性和功能免疫细胞是免疫系统的主要组成部分,包括巨噬细胞、T细胞、B细胞、自然杀伤细胞等。
它们有着不同的生物学特性和功能。
首先,巨噬细胞是一类具有吞噬功能的免疫细胞。
它们可以通过吞噬和消化病原体来清除感染,释放细胞因子激活其他免疫细胞,并参与抗病原体过程中的抗原呈递和抗原递呈等功能。
其次,T细胞是免疫系统中的重要细胞类型,包括辅助T细胞(Th细胞)和细胞毒性T细胞(CTL)。
Th细胞可以通过产生细胞因子来调节和增强免疫应答,具有活化B细胞、细胞毒性T细胞和巨噬细胞等免疫细胞的功能。
CTL则具有直接杀伤感染细胞的能力,通过释放细胞毒素来清除感染细胞。
再次,B细胞是免疫系统中的另一种重要细胞类型。
它们通过表面免疫球蛋白(抗体)来识别和结合抗原,从而启动和参与免疫应答。
在免疫应答过程中,B细胞可以分化为产生抗体的浆细胞,将抗体释放到体液中,通过中和病原体和激活其他免疫细胞来清除感染。
此外,自然杀伤细胞(NK细胞)也是一类重要的免疫细胞。
它们具有非特异性杀伤肿瘤细胞和感染细胞的能力,通过释放细胞毒素来清除这些异常细胞。
NK细胞在识别和杀伤异常细胞方面起到重要作用,对于控制肿瘤生长和感染病原体的扩散起到重要的调节作用。
除了免疫细胞,免疫因子也是免疫系统的重要组成部分。
免疫因子是细胞间的信号分子,可以调节免疫细胞的增殖、分化和功能。
常见的免疫因子包括细胞因子、趋化因子和抗体等。
细胞因子是免疫系统中的重要信号分子,包括白介素、肿瘤坏死因子、干扰素等。
它们可以通过与细胞上的受体结合,调节免疫细胞的活化、增殖和分化,从而参与免疫应答过程。
趋化因子是一类能够引导免疫细胞迁移至感染和损伤部位的分子。
趋化因子可以通过结合免疫细胞上的受体,引导其向趋化因子浓度梯度高的方向运动,从而定向迁移至感染和损伤部位,参与免疫应答过程。
抗体是一类由B细胞产生的免疫球蛋白,具有高度的特异性和亲和性。
抗体可以与抗原结合,通过中和病原体和激活其他效应细胞来清除病原体。


免疫细胞的迁移机制及其在炎症和免疫反应中的作用免疫细胞是指包括淋巴细胞、单核细胞、巨噬细胞、粒细胞等一系列可以参与免疫反应的细胞。
它们都具有一定的迁移和定向的能力,可以在机体内进行自由运动和信息交流,从而发挥免疫反应的作用。
在机体免疫系统中,免疫细胞的迁移机制起着至关重要的作用,相关研究已经成为当前研究热点。
本文将从迁移机制和免疫反应两个角度来探讨免疫细胞的作用和意义。
一、迁移机制免疫细胞的迁移机制包括黏附、转移、趋化、细胞移动和形态变化等多个过程。
其中黏附和转移是最重要、最基本的两步。
(1)黏附和转移黏附和转移指的是免疫细胞在穿过内皮细胞时和血管内的黏附分子(如选择素、整合素等)之间的结合和分离过程。
这一过程需要细胞在受刺激后释放黏附素和趋化因子,然后这些分子通过受体和特异性黏附蛋白(如VLA-4,LFA-1等)形成桥式连接,从而实现细胞对血管壁的黏附,进而进行转移。
(2)趋化趋化是细胞针对外部环境刺激做出的一种自主的运动反应,也是免疫细胞在免疫反应中迁移的主要方式。
这一过程主要由趋化因子控制。
趋化因子分为内源性趋化因子和外源性趋化因子两类,内源性趋化因子主要包括白介素、肿瘤坏死因子和干扰素等,而外源性趋化因子则主要包括细菌、病毒和细胞残骸等。
这些趋化因子可以通过作用于细胞表面的受体,从而引导免疫细胞运动,并决定它们的轨迹和目标,从而更好的发挥免疫反应的作用。
二、免疫反应免疫细胞在机体免疫系统中发挥的作用非常广泛,主要参与炎症和免疫反应的过程。
下面将分别从两个方面来谈谈免疫细胞在这方面的作用。
(1)炎症反应炎症反应是一种非特异性免疫反应,是机体针对细菌、病毒等损伤因素引起的一种保护性反应。
炎症反应可以促进血管再生、减轻组织的损伤,并有效杀死或清除机体内的病原体。
其中,免疫细胞(如嗜中性粒细胞、单核细胞等)起着至关重要的作用。
当遭遇到外界的损伤刺激时,刺激物会通过某些刺激机制(如鸟嘌呤核苷酸、脂多糖等)激活免疫细胞,进而使其释放大量趋化因子和炎性因子,引起局部血管扩张和通透性增加,从而形成炎症反应。
细胞因子,趋化因子及其受体
趋化因子1;BRAK,乳腺和肾表达趋化因子;CTACK,皮肤T细胞吸引趋化因子;DCs,树突状细胞;Eo,嗜酸性粒细胞;GCP-2,粒细胞趋化蛋白2;IL-8,白细胞介素8;IP-10,干扰素可诱导蛋白10;Mac,巨噬细胞;MCP,单核细胞趋化蛋白;MEC,粘膜相关上皮趋化因子;MIP,巨噬细胞炎症蛋白;NAP-2,中性粒细胞激活肽2;Neu,中性粒细胞;NK,自然杀伤细胞;RANTES,调节活化正常T细胞表达和分泌的趋化因子;SCY,小细胞因子;SDF-1,基质细胞来源因子1;SLC,刺激淋巴组织趋化因子;T,T细胞;Th1,1型辅助T细胞;Th2,2型辅助T细胞。
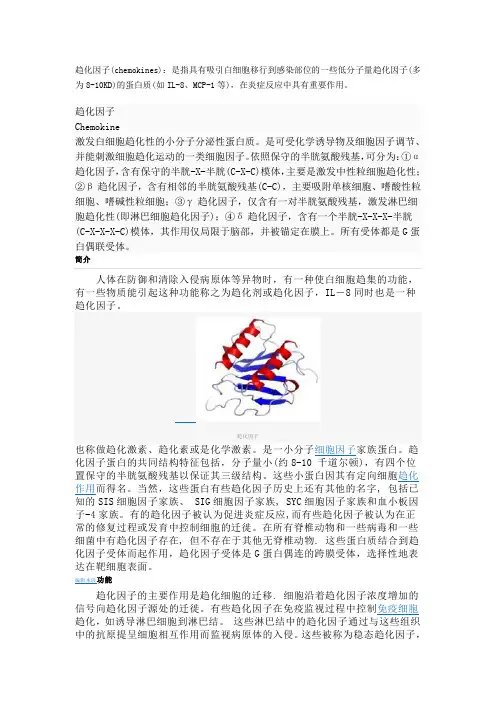
趋化因子(chemokines):是指具有吸引白细胞移行到感染部位的一些低分子量趋化因子(多为8-10KD)的蛋白质(如IL-8、MCP-1等),在炎症反应中具有重要作用。
趋化因子Chemokine激发白细胞趋化性的小分子分泌性蛋白质。
是可受化学诱导物及细胞因子调节、并能刺激细胞趋化运动的一类细胞因子。
依照保守的半胱氨酸残基,可分为:①α趋化因子,含有保守的半胱-X-半胱(C-X-C)模体,主要是激发中性粒细胞趋化性;②β趋化因子,含有相邻的半胱氨酸残基(C-C),主要吸附单核细胞、嗜酸性粒细胞、嗜碱性粒细胞;③γ趋化因子,仅含有一对半胱氨酸残基,激发淋巴细胞趋化性(即淋巴细胞趋化因子);④δ趋化因子,含有一个半胱-X-X-X-半胱(C-X-X-X-C)模体,其作用仅局限于脑部,并被锚定在膜上。
所有受体都是G蛋白偶联受体。
简介人体在防御和清除入侵病原体等异物时,有一种使白细胞趋集的功能,有一些物质能引起这种功能称之为趋化剂或趋化因子,IL-8同时也是一种趋化因子。
趋化因子也称做趋化激素、趋化素或是化学激素。
是一小分子细胞因子家族蛋白。
趋化因子蛋白的共同结构特征包括,分子量小(约8-10 千道尔顿),有四个位置保守的半胱氨酸残基以保证其三级结构。
这些小蛋白因其有定向细胞趋化作用而得名。
当然,这些蛋白有些趋化因子历史上还有其他的名字, 包括已知的SIS细胞因子家族、 SIG细胞因子家族, SYC细胞因子家族和血小板因子-4家族。
有的趋化因子被认为促进炎症反应,而有些趋化因子被认为在正常的修复过程或发育中控制细胞的迁徙。
在所有脊椎动物和一些病毒和一些细菌中有趋化因子存在, 但不存在于其他无脊椎动物. 这些蛋白质结合到趋化因子受体而起作用,趋化因子受体是G蛋白偶连的跨膜受体,选择性地表达在靶细胞表面。
编辑本段功能趋化因子的主要作用是趋化细胞的迁移. 细胞沿着趋化因子浓度增加的信号向趋化因子源处的迁徙。
有些趋化因子在免疫监视过程中控制免疫细胞趋化,如诱导淋巴细胞到淋巴结。

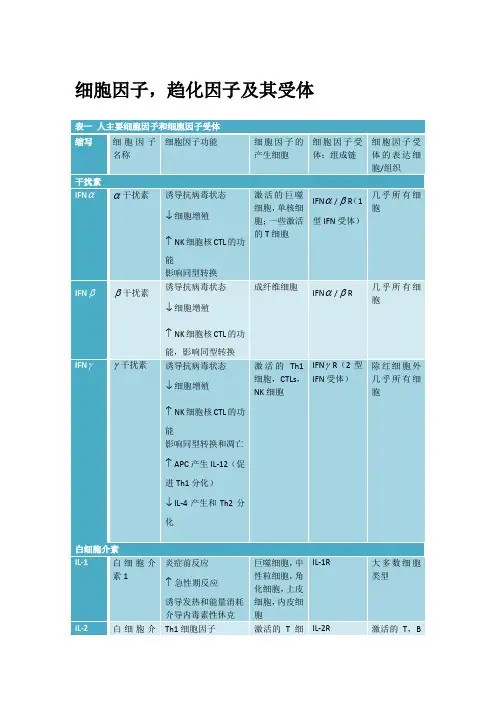
细胞因子的分类和功能细胞因子是一类在细胞间进行通讯的蛋白质分子,是免疫系统中重要的信号分子。
它能够调节细胞的增殖、分化、附着、运动和死亡等多种生物学活动,对身体的免疫反应、炎症反应、细胞凋亡及增殖等过程起着重要的调节作用。
细胞因子的分类和功能的了解对于理解免疫系统的调节过程、疾病的发生和发展以及开发新的治疗手段都至关重要。
细胞因子是由免疫原、丝裂原或其他刺激剂诱导多种细胞合成并分泌产生的,具有广泛生物学活性的低分子质量蛋白或多肽,用于细胞间信号传导和相互作用。
它们调节多种细胞生理功能,在免疫系统中起着非常重要的调控作用,在异常情况下也会导致病理反应。
一、细胞因子的分类根据其功能和来源的不同,细胞因子可以分为多个类别。
下面是几种常见的分类方法:白细胞介素:白细胞介素是一类能够双向调节免疫系统的细胞因子家族,主要参与免疫细胞的分化和激活。
白细胞介素可划分为白细胞介素-1(IL-1)细胞因子家族、共γ链细胞因子家族、IL-10细胞因子家族、IL-12细胞因子家族等。
干扰素:干扰素是机体应对各种不同的刺激(包括病毒)时所产生的一类特殊的蛋白质或糖蛋白,分为IFN-α、IFN-β、IFN-γ3类,具有调节先天免疫、活化抗病毒性质和抗增殖功能。
肿瘤坏死因子:肿瘤坏死因子是一种促炎性细胞因子,分为TNF-α和TNF-β2种,具有促炎作用,能够诱导肿瘤细胞坏死,此外还参与发热和炎症的发生。
集落刺激因子:集落刺激因子主要包括粒细胞巨噬细胞集落刺激因子(CM-CSF)、巨噬细胞集落刺激因子(M-CSF)和粒细胞集落刺激因子(G-CSF),可刺激造血祖细胞增殖和分化。
集落刺激因子也是促炎细胞因子网络的一部分,参与炎症的发生和发展。
趋化因子:趋化因子是一类具有7~15ku的低分子质量的细胞因子大家族,根据其氨基端半胱氨酸排列基序可分为C-X-C基序(CXC)、C-C基序(CC)、C-X3-C基序(CX3C)、C基序(C)四个趋化因子亚族。

免疫细胞的信号传导和细胞因子释放免疫系统是机体的一道天然屏障,它能够检测和摧毁各种可疑抗原物质,从而维护机体免受感染和疾病的侵袭。
其中,免疫细胞是免疫系统的主要执行机构。
这些细胞需要快速而准确地接收和传递信号,以便有效地执行其职能。
本文将详细介绍免疫细胞的信号传导和细胞因子释放过程。
一、免疫细胞的信号传导免疫细胞的信号传导过程包括信号物质与受体结合、受体内样品产生、信号通路的激活等环节。
信号物质通常是细胞因子,免疫细胞表面则有相应的受体来感知这些细胞因子。
当受体与信号物质相互作用时,会引发细胞内的一系列变化,最终导致信号的传递和细胞活性的改变。
信号通路的激活通常需要先通过膜受体进行信号转导。
膜受体大致可以分为离子通道型和酪氨酸激酶型两类。
前者相当于小门,可以直接开启,后者需要配体结合后使其磷酸化而激活。
离子通道类型的受体通常反应较快,可以快速释放细胞内钙离子,然后引发下一级反应。
酪氨酸激酶类型的受体结构比较复杂,激活需要多个蛋白质参与,通常需要一定时间才能起作用。
信号转导通常需要以一种高效的方式进行,免疫细胞的信号转导类似于链接各种蛋白质的“穿球游戏”。
这种游戏包含了多个蛋白质,每个蛋白质都具有一定的功能,它们之间不断地相互作用、连接,最终形成一个大的分子复合体。
这种复合体既可以位于细胞膜上,也可以位于细胞质内或细胞核内。
二、免疫细胞的细胞因子释放免疫细胞的细胞因子是免疫反应中的重要物质,它们可以调控细胞的功能和数量,从而对机体的攻击产生反应。
免疫细胞的细胞因子通常可以分为细胞因子、趋化因子和生长因子等几类。
细胞因子是介导免疫细胞间相互传递信号的物质,可以分为炎症因子、淋巴因子、细胞生长因子、巨噬细胞因子、干扰素、间质细胞因子、肿瘤坏死因子等。
这些因子在免疫反应中发挥着重要的调控作用,可以改变细胞的分化、增殖和功能等方面。
趋化因子是介导免疫细胞向炎症部位迁移的化学介质,可以吸引特定类型的免疫细胞向炎症组织移动,从而起到调控免疫反应的作用。

趋化因子名词解释趋化因子(chemokines):是一类由细胞分泌的小细胞因子或信号蛋白。
由于它们具有诱导附近反应细胞定向趋化的能力,因而命名为趋化细胞因子。
人体在防御和清除入侵病原体等异物时,有一种使免疫细胞定向趋化的功能,有一些物质能引起这种功能称之为趋化剂或趋化因子,也称做趋化激素、趋化素或是化学激素。
趋化因子是一小分子细胞因子家族蛋白,这些小蛋白因其有定向细胞趋化作用而得名。
这些蛋白有些趋化因子历史上还有其他的名字,包括SIS细胞因子家族、 SIG 细胞因子家族, SYC细胞因子家族和血小板因子-4家族。
趋化因子蛋白的共同结构特征包括,分子量小(约8-10 kDa),有四个位置保守的半胱氨酸残基以保证其三级结构。
一部分趋化因子被认为是促炎性细胞因子,可以在免疫应答过程中诱导免疫系统的细胞进入感染部位。
而有些趋化因子被认为维持机体自我调节,在正常的组织维持或发育过程中控制细胞的迁徙。
在所有的脊椎动物、一些病毒和一些细菌中有趋化因子存在,但在其他无脊椎动物中尚未发现。
趋化因子被分为四个主要亚家族:CXC、CC、CX3C和XC。
所有这些蛋白都通过与G蛋白连接的跨膜受体(称为趋化因子受体)相互作用来发挥其生物学效应这些蛋白质结合到趋化因子受体而起作用,趋化因子受体是G蛋白偶连的跨膜受体,选择性地表达在靶细胞表面。
所有趋化因子都很小,分子量在8到10 kDa之间。
它们之间大约有20-50%是相同的;也就是说,它们具有相同的基因序列和氨基酸序列同源性。
它们也都拥有保守的氨基酸,这些氨基酸对形成它们的三维或三级结构很重要,例如在大多数情况下四个半胱氨酸相互作用,形成一个希腊钥匙形状,这是趋化因子的一个特征。
分子内二硫键通常连接第一个到第三个半胱氨酸残基,第二个到第四个半胱氨酸残基,它们在趋化因子的蛋白序列中出现时编号。
典型的趋化因子蛋白是以肽前体的形式产生的,在其从细胞分泌的过程中,从分子的活性(成熟)部分分裂出大约20个氨基酸的信号肽。

免疫细胞的迁移和趋化免疫细胞是我们身体最重要的防御系统之一,保护我们不受外界的侵害。
它们不仅可以消灭病菌和病毒,还可以清除身体内部的异常细胞。
如此强大的免疫细胞是如何在身体内移动并定位到需要保护的区域的呢?这就是本文将要探讨的话题——免疫细胞的迁移和趋化。
1. 免疫细胞的迁移免疫细胞需要通过血管系统进入身体的各个区域,所以它们必须具备迁移的能力。
免疫细胞通过特殊的小分子受体在血管内壁上寻找细胞黏附分子,这些分子会与免疫细胞表面的黏附分子相互作用,从而激活免疫细胞并将其固定在血管内壁上。
此时,免疫细胞会释放一系列酶和蛋白质,在血管内壁形成细胞黏附分子的缺口。
免疫细胞通过这些缺口穿过血管内壁,进入组织细胞,开始执行它们的免疫功能。
2. 免疫细胞的趋化除了能够迁移之外,免疫细胞还要具备趋化的能力。
这意味着它们需要有一种能够指引它们前往需要保护的区域的机制。
人体中有很多类型的细胞都可以分泌趋化因子,比如趋化性细胞因子和趋化因子受体。
例如,如果身体受到了感染,炎症细胞就会分泌趋化细胞因子CCL21、CCL19和CXCL12。
这些分子可以与免疫细胞表面的趋化因子受体结合,从而吸引免疫细胞向感染区域迁移,并参与病原体的清除。
3. 免疫细胞在癌症治疗中的作用人体内有很多类型的免疫细胞,其中最重要的是T淋巴细胞和自然杀伤细胞(NK细胞)。
T淋巴细胞可以直接杀死癌细胞,但它们需要受到足够的激活信号。
而NK细胞则直接杀死癌细胞,不需要受到特定的激活信号。
自身的免疫系统对癌症的诊断和治疗非常重要。
在肿瘤开始生长的早期阶段,免疫细胞就会被招募到癌细胞周围。
这些免疫细胞将识别癌细胞,并尝试消灭它们。
如果癌细胞能够逃脱免疫系统的攻击,它们就会继续生长和扩散。
然而,有时免疫系统对癌症的消灭并不彻底。
在这种情况下,癌细胞可能激活自己的生存机制,防止免疫细胞杀死它们。
这就是为什么一些实验室研究人员正在研究如何激活免疫系统,以更有效地消灭癌细胞。

细胞因子在免疫调节中的作用和机制细胞因子是指一类由免疫细胞分泌的分子,它们在维持机体免疫平衡、调节免疫反应和参与炎症反应等方面发挥着重要作用。
细胞因子的种类繁多,常见的有肿瘤坏死因子、干扰素、趋化因子、白细胞介素等。
在这些细胞因子中,以白细胞介素在免疫调节中的作用和机制更为重要和广泛。
一、介绍细胞因子在免疫调节中的作用细胞因子对于机体免疫防御系统的调节和平衡具有十分重要的作用。
它们能够通过增强免疫细胞介导的攻击作用来增强免疫力,也可以通过抑制免疫细胞的活动降低免疫力,同时对于炎症反应、免疫耐受和修复等过程也有深入的影响。
细胞因子在免疫调节中的作用主要表现在以下几个方面:1. 细胞因子在炎症反应中的作用在炎症反应过程中,细胞因子起到了扩散、增殖、激活等多重作用。
它们能够使炎症细胞聚集、增殖,血液中的白细胞数量增加,增强机体对于细菌、病毒等物质的攻击能力。
同时,细胞因子也能够通过调节内皮细胞基底膜通透性和炎症细胞的激活状态,控制炎症反应过程的进程和范围,从而保证机体对于炎症的有效处理。
2. 细胞因子在免疫耐受中的作用细胞因子还能够调节机体对于自身抗原的耐受,维护机体正常免疫状态。
它们可以通过维持免疫细胞的平衡状态,促进细胞间的相互作用和信号传递,控制T细胞的发育和功能,维持机体正常的免疫状态。
同时,细胞因子也能够协助机体检测和消除自身细胞的病理性变化,保证机体免疫能力的稳定性和保护性。
3. 细胞因子在免疫损伤修复中的作用细胞因子还能够参与机体损伤修复和维持器官功能的调节。
它们能够通过促进细胞增殖、分化和迁移,协助机体进行组织修复和再生。
同时,细胞因子也能够促进免疫细胞的吞噬作用,加速机体对于细胞死亡和病理性变化的处理,调控机体对于内外环境的适应能力。
二、介绍细胞因子在免疫调节中的机制细胞因子在免疫调节中的作用具有复杂的机制。
对于不同的细胞因子,在不同的环境下,其影响和机制也存在一定的差异。
但大体上,细胞因子在免疫调节中的机制主要包括以下几个方面:1. 信号传递细胞因子能够通过绑定特定的受体,触发相应的信号传递通路,从而产生生物学效应。
细胞调控因子在免疫系统中的作用免疫系统是人体内保护身体免于外部病原体感染的一套系统。
它主要由一系列细胞和分子组成,包括了白细胞、淋巴细胞、巨噬细胞等,以及调节这些细胞功能的生物分子,包括了细胞因子、趋化因子等。
其中,细胞调控因子在免疫系统中扮演了非常重要的角色。
什么是细胞调控因子?细胞调控因子是指一类促进或抑制免疫系统中细胞功能的生物分子。
这些分子可以在机体内的很多组织和细胞中产生,如淋巴细胞、巨噬细胞、树突状细胞、内皮细胞等。
它们通过与细胞表面上的特定受体结合,引发一系列细胞信号转导事件,从而调节细胞抗菌和抗病毒的免疫反应。
细胞调控因子的类型和作用细胞调控因子种类繁多,包括了促炎性因子、趋化因子、生长因子、调节性因子等。
它们的具体作用可分为三类:1. 促进免疫反应。
例如,IL-1、IL-6和TNF-α等促炎性因子能够激活免疫系统中的多种细胞,如T细胞、巨噬细胞等,使这些细胞产生巨量的细胞因子和吞噬能力,从而加强人体的免疫防御能力。
2. 调控免疫反应。
例如,IL-10、TGF-β、IL-4等调节性因子能够抑制免疫系统中一些过度激活的免疫细胞,从而防止过度炎症反应造成的组织损伤和免疫损伤等。
3. 维持免疫平衡。
例如,IL-7、IL-15等生长因子可以促进免疫系统中某些细胞的生长繁殖,从而保持免疫系统的恒定状态。
细胞调控因子在人类免疫疾病中的应用由于细胞调控因子对免疫反应的调控作用非常重要,它们在临床上也被广泛应用。
例如,术后休克患者常常出现免疫功能下降,而使用一些细胞调控因子可以加强免疫系统的免疫力,从而防止感染的发生。
此外,很多自身免疫性疾病也可使用细胞调控因子进行治疗。
例如,利用TNF-α受体融合蛋白、抗TNF-α单克隆抗体等药物治疗风湿性关节炎等疾病已经获得了良好的临床效果。
总结细胞调控因子在免疫系统中发挥着非常重要的调节作用,它们通过调控不同免疫细胞的功能来协调完成人体的免疫防御任务。
不同类型的细胞调控因子具有不同的作用,可以促进免疫反应、调节免疫反应以及维持免疫平衡。
细胞因子的生物学功能细胞因子是一类具有广泛生物学功能的蛋白质分子。
它们在细胞间的相互作用和信号传导中发挥着重要的角色。
细胞因子可以被分为多个不同的类别,如生长因子、细胞凋亡相关因子、趋化因子、介导免疫反应的淋巴因子等。
以下是关于细胞因子的一些常见生物学功能:1.促进细胞生长和分化:生长因子是细胞因子的一个重要类别,它们可以促进细胞的增殖、分化和存活。
常见的生长因子包括表皮生长因子(EGF)、神经生长因子(NGF)和纤维母细胞生长因子(FGF)。
这些分子通过与受体结合,激活细胞内的信号传导通路,从而促进细胞的增殖和分化。
2.调节免疫反应:细胞因子在免疫系统中发挥着重要的调节作用。
例如,淋巴因子可以调节T细胞和B细胞的发育、增殖和分化,从而影响免疫应答的强度和方向。
趋化因子能够引导免疫细胞向炎症部位迁移,参与炎症反应的调节。
胞浆因子更是在机体遭受外界刺激或细胞受损时释放,通过调节炎症反应和免疫应答来保护机体。
3.介导细胞间的相互作用:细胞因子可以促进不同细胞之间的相互作用和通讯。
例如,神经生长因子(NGF)可以介导神经元间的相互作用,促进神经元的存活和突触的形成。
另外,细胞因子还可以通过调节胚胎发育过程中细胞的迁移和分化来促进组织器官的发育。
4.调节细胞凋亡:细胞凋亡是正常细胞生命周期中的一部分,也是维持组织健康和稳态的重要过程。
一些细胞因子,如肿瘤坏死因子(TNF)和白介素-1(IL-1),可以诱导细胞凋亡。
这对于清除损伤细胞和抗肿瘤过程非常重要。
5.递质调节:细胞因子也可以作为神经递质在神经系统中起到传导和调节的作用。
例如,多巴胺、去甲肾上腺素和乙酰胆碱等递质都是细胞因子的成员。
它们能够在神经元间传递信号,调节中枢神经系统的功能和行为。
总之,细胞因子在生物体内发挥着多种重要的生物学功能,涉及到细胞生长和分化、免疫应答、细胞间通讯、胚胎发育、细胞凋亡和神经递质调节等方面。
深入理解细胞因子的生物学功能对于揭示疾病发生机制、研究治疗方法以及开发新药具有重要意义。
炎性介质的病理名词解释炎性介质是一种在炎症过程中产生的生物活性分子,它们在体内扮演着调节免疫反应和炎症过程的关键角色。
这些炎症介质在正常情况下起到保护性作用,但当炎症过度激活或长期存在时,它们可以对机体产生伤害。
在炎症反应中,炎性介质的合成和释放是由炎症细胞、免疫细胞以及局部组织细胞共同完成的。
这些介质包括细胞因子、趋化因子、炎症介质以及一些酶类物质等。
接下来,我们将对其中几种重要的炎性介质进行详细的解释。
细胞因子是一类分泌细胞间的蛋白质分子,能够在细胞间进行信息传递,调节细胞的生长、增殖、分化、凋亡等。
其中,肿瘤坏死因子(TNF)是一种重要的细胞因子,它参与调节细胞的生存与死亡,并在炎症过程中发挥重要的作用。
TNF的过度释放会引发自身免疫性疾病,因此,细胞因子的平衡对于维持机体的正常功能非常重要。
另一个重要的炎性介质是趋化因子。
它们能够引导免疫细胞定向运动,使其在炎症部位聚集。
最常见的趋化因子是化学趋化因子,它们通过与特定的受体结合,激活免疫细胞,并使其迁移至炎症局部。
趋化因子的功能在机体免疫防御中起到了至关重要的作用。
除了细胞因子和趋化因子外,炎性介质还包括炎症介质和酶类物质。
炎症介质包括血浆生成因子、凝血因子等,它们在炎症过程中起到血管渗透、管壁通透性增加、血栓形成等作用。
这些作用有助于免疫细胞的浸润,并促进炎症的进一步发展。
而酶类物质,如蛋白酶、脂肪酶等,则可以通过降解组织细胞的外基质,促进炎症部位的组织重构。
炎性介质在炎症过程中的发挥作用是相互联动的。
免疫细胞的激活和迁移受到趋化因子的诱导,而趋化因子的产生则受到细胞因子的调控。
细胞因子和炎症介质通过多种信号通路调控炎性细胞的功能和活性。
这些介质相互作用,共同调节炎症反应的程度和持续时间。
然而,当机体受到过度激活的炎性介质的刺激时,炎症反应将无法被适时控制,导致炎症反应的持续加剧,出现炎症性疾病。
过度分泌细胞因子和炎症介质,如白细胞介素-1(IL-1)、白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、光活化物酶原(PAF)等,都与多种免疫性和非免疫性疾病的发生和发展相关。
趋化因子(1)六、趋化因子由组织细胞和微生物产生的趋化剂(chemoattractants)对白细胞的趋化作用(chemotaxis)是炎症发生过程中重要的起始步骤,也是机体防御和清除入侵病原体等异物先天性免疫功能的一个重要方面。
1986年以前,“经典”的(classical)白细胞趋化物质主要有补体片段C5 a、白三烯B4(leukotrinin B4,LTB4)、血小板激活因子(platelet-a ctivating factor,PAF)和fMLP(N-formylmethionyl-leucyl-phenyl-alanine,N-甲酰甲硫氨酰-亮氨酰-苯丙氨酸),这些趋化物质的受体同属于G蛋白偶联受体(Gprotein-coupled receptor)。
(一)趋化因子的种类1.趋化因子的命名1986年以来,陆续发一现了一类主要由免疫细胞产生的、具有趋化白细胞作用的细胞因子(chemoattractant cyt okines或chemotactic cytokines)。
在1992年第3届国际趋化因子研讨会上,绝大多数学者建议把chemoattractant(chemotactic)cytokine简称为chemokines,本书暂译名为趋化因子。
趋化因子又称可诱导的小分子蛋白(small-inducible protein,SIP)、间分泌(intercrine)、细胞因子PE-4超家族(PF-4superfamily of common an-cestral cyto kines)或PF-4样细胞因子(PF-4 like cytokine)等。
2.趋化因子亚族及其成员通过基因克隆和cDNA、氨基酸序列分析,人的趋化因子超家族目前至少发现有19个成员,它们具有以下共同的特点。
(1)来自同一个祖先基因(com-mon ancestral gene)。
(2)成熟分子为分子量8~10kDa的小分子多肽。
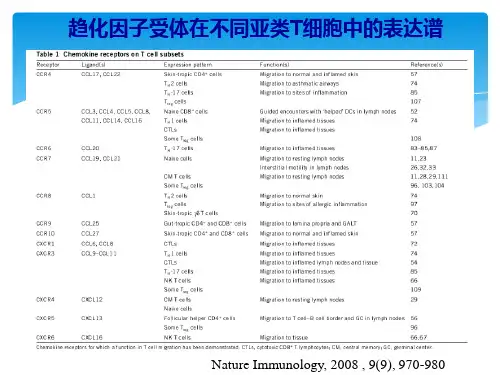
趋化因子及其受体在免疫细胞中的作用研究概述趋化因子是目前成员最多的细胞因子家族,在人和小鼠中大概有50个内源性趋化因子。
这些因子大约结合20多个跨膜受体。
趋化因子的主要作用是控制免疫细胞的迁移模式,对细胞运动至关重要。
趋化因子系统在初始T细胞产生,决定细胞的分化(如效应细胞和记忆细胞),影响调节性T细胞的功能,调节免疫细胞迁移和定位,已达到体内平衡。
趋化因子在急性炎症和淋巴系统中对免疫反应的产生和调节具有重要作用。
趋化因子在炎性疾病及癌症中的作用使其成为新的药物靶点。
趋化因子可以控制骨髓、血液及外周组织中的免疫细胞运输。
CXCL12由CAR细胞产生,可以使发育中的中性粒细胞、B细胞和单核细胞保留在骨髓中。
DC前体、肥大细胞前体和发育中的嗜酸性粒细胞通过未知机制保留在骨髓中。
在没有CXCR4信号传导或CXCR2信号传导的情况下,嗜中性粒细胞离开骨髓并进入血液。
B细胞通过CB2信号进入骨髓,并通过S1P1信号传导进入血液。
B细胞可以使用CCR7、CXCR4和CXCR5信号进入淋巴结构。
单核细胞响应CCR2信号进入血液以及CXCR4信号传导减少。
单核细胞分化为促炎症(CCR2+)和抗炎(CX3CR1+)单核细胞。
抗炎单核细胞可以通过CX3CL1进入外周组织。
DC前体通过未知机制进入血液,并可以通过CCL20离开外周组织。
在人类中,CXCL14也可能在抗炎单核细胞和DC前体迁移到外周组织中起作用。
肥大细胞前体通过未知机制离开骨髓,并在CXCR2介导的信号后迁移至肠道。
CCR3信号通过CCL11和CCL24(人和小鼠)以及CCL26(人)后,嗜酸性粒细胞进入血液并离开外周组织。
趋化因子精细控制免疫细胞前体的发育及分化,发生在原发性淋巴器官-骨髓和胸腺。
在胸腺中,T细胞祖细胞产生的CCL21、CCL25和CXCL12与CCR7、CCR9和CXCR4相互作用决定胸腺中T细胞的发育。
在骨髓中,免疫细胞的稳态保留和发育在很大程度上依赖于CXCL12/CXCR4相互作用。
研究发现CXCL12/CXCR4相互作用对于多种免疫细胞系的正常发育是必需的,比如B细胞、单核细胞、巨噬细胞、嗜中性粒细胞、天然杀伤(NK)细胞和浆细胞样树突状细胞(pDC)。
因此,使用拮抗剂阻断CXCR4信号导致嗜中性粒细胞异常增加并进入外周血。
随着嗜中性粒细胞在骨髓中成熟,CXCR4的表达逐渐降低,允许嗜中性粒细胞从骨髓中释放并在血液和外周组织中定位。
CXCR4和CCR2信号传导控制来自骨髓的单核细胞释放。
CXCL12与CXCR4相互作用以将单核细胞保留在骨髓中,CXCR4的阻断引起外周血单核细胞数量的小幅增加。
CCR2介导的信号的丢失阻止单核细胞从骨髓中的排出。
B细胞祖细胞发育依赖于CXCR4,CXCR4缺乏可以导致未成熟B细胞从骨髓中退出,进而减少原始B细胞数量,造成B细胞功能缺陷。
在次级淋巴器官(SLO)中,趋化因子在介导细胞募集和细胞类型的结构分离中起着下游作用。
SLO包括淋巴结构(LNs)、脾脏和Peyer’s斑块。
SLO在淋巴管的特定位置发展,通过CXCL13聚集。
在成熟的SLO中,趋化因子的稳态生成可以维持SLO的结构。
CXCL13和CXCR5相互作用促进B细胞的体内平衡定位。
在脾脏中,边缘区域B细胞依赖于CXCR7表达用于其稳态定位。
用CXCR7拮抗剂治疗小鼠,导致脾边缘区B细胞数量减少。
同时,成纤维细胞网状细胞(FRCs)产生CCL19、CCL21和CXCL12,通过受体CCR7和CXCR4,促进T 细胞和树突状细胞(DCs)进入和定位。
因此,即使在没有免疫应答的情况下,初始淋巴细胞和抗原呈递细胞(APC)也主动迁移并保留在SLO中。
在三级淋巴器官(TLOs)中,趋化因子的作用机制尚不清楚。
炎性细胞因子诱导淋巴细胞吸收趋化因子CXCL13和CCL19的表达,一起作用促进淋巴细胞进入TLO。
在通过淋巴毒素、CXCL13、CCL19或CCL21的异位表达研究TLO发展实验中,强调了无细胞因子阳性反馈环的存在。
鉴于TLO在感染和病理性自身免疫应答中的局部免疫激活中的作用,该趋化因子反馈环可以呈现出有效的靶向和减弱自身免疫应答的区域。
在天然T细胞中,趋化因子受体CCR7和CXCR4得以表达。
CCR7结合由HEV产生并呈现在腔内皮上的CCL21,以及由FRC网络产生的CCL19,并跨越HEV穿过腔内皮细胞。
天然T细胞上的CXCR4还通过结合CXCL12促进LN进入,CXCL12由FRC产生并转染,呈递在HEV 腔上。
一旦进入LN,T细胞将CCL19和CCL21跟踪到T细胞区域,这使得它们能够作用于DC。
在天然B细胞中,趋化因子受体CCR7、CXCR4和CXCR5得以表达。
天然B细胞还表达CXCR5,其结合由FDC产生的CXCL13,并且可以通过HEV转胞吞素后呈递。
CXCR5缺陷型B 细胞在很大程度上受到Peyer’s斑块的限制,但是似乎几乎不发挥作用。
一旦进入LN,B细胞迁移到卵泡以响应CXCL13。
Foxp3 +调节性T细胞(Tregs)是免疫反应的重要介质。
在没有感染或炎症的情况下,Treg广泛分布在大多数淋巴组织和非淋巴组织中。
在小鼠中,趋化因子受体表达的破坏可以改变这种广泛的分布并导致致病性炎症反应。
例如,Treg中CCR4的缺失可防止其在皮肤和肺中的稳态积累,并导致这些特定器官发炎。
在人类中,趋化因子受体在Treg细胞中表达随发育生长而变化。
在新生儿脐带血中,趋化因子受体CCR7、CXCR4和L-选择蛋白以及去神经受体CCR9得以表达。
在三周岁以前,人类血清中的Treg大多数似乎具有记忆表型,使得肠道CCR9表达下调,而皮肤、肺部及炎症归巢的趋化因子受体获得表达,如CXCR3、CCR2、CCR4、CCR5、CCR6和CCR8。
趋化因子控制炎症中骨髓、血液和外周组织之间的先天免疫细胞运输。
在炎症期间,G-CSF导致骨髓中CXCL12的产生减少,并通过嗜中性粒细胞增殖降低CXCR4的表达。
CXCR4介导减少,CXCR2介导的出血信号的丧失,促进中性粒细胞释放到血液中。
人类中的BLT1、CCR1(或CXCR1)和嗜中性粒细胞上的CXCR2受体与其配体结合,促进嗜中性粒细胞进入外周组织。
在组织中,嗜中性粒细胞可能受到CCR1(小鼠)、CXCR1(人)、CXCR2和BLT1信号传导影响,而产生到感染或损伤。
单核细胞通过全身病原体相关分子模式(如TLR配体)产生的CCL2迁移出骨髓,通过CXCR2信号粘附于发炎的内皮,并通过CCR2信号转移到外周。
肥大细胞前体能够通过CXCR2、BLT1或CYSLT1信号转导到外周。
嗜酸性粒细胞离开骨髓并通过CCR3信号迁移到外周组织。
最后,成熟的组织DCs上调CCR7并通过CCL21迁移到淋巴管中以排出外周组织。
肥大细胞在急性炎症中起重要作用,因为它们表达多种模式识别受体(PRR)并含有预先形成的炎症介质的大颗粒。
已有研究结果表明肥大细胞释放CCL1,诱导CCR8表达。
肥大细胞脱颗粒是促进嗜中性粒细胞募集的趋化因子的重要直接来源。
肥大细胞受到刺激可以产生多种趋化因子,如CCL2、CCL3、CCL4、CCL5、CCL11、CCL20、CXCL1、CXCL2、CXCL8、CXCL9、CXCL10和CXCL11。
组织中趋化因子产生的另一个来源是响应于局部免疫细胞释放的炎性细胞因子。
除了趋化因子,激活的肥大细胞、DC和巨噬细胞释放急性炎症细胞因子如TNF和IL-1。
这些细胞因子可刺激其他局部免疫细胞或激活局部上皮细胞。
细胞因子活化的上皮可以产生许多趋化因子,包括CCL2、CCL3、CCL4、CCL5、CXCL1、CXCL2、CXCL3、CXCL5和CXCL8。
同时,细胞因子可以通过局部内皮细胞改变趋化因子的产生和表达。
在实验性自身免疫性脑炎(EAE)中,脑内皮细胞的IL-17刺激导致CXCR7的外膜表达,CXCL12表达。
在没有内皮CXCL12的情况下,白细胞可以进入脑并诱发疾病发病。
急性炎症趋化因子靶向的最早的细胞之一是嗜中性粒细胞。
嗜中性粒细胞表达许多趋化因子受体,包括CXCR2和CCR1(和人类中的CXCR1)。
趋化因子在介导中性粒细胞释放中发挥重要作用。
在发炎的环境中,G-CSF的全身水平增加,这促进嗜中性粒细胞生成以及骨髓出血的增加。
G-CSF降低骨髓中的CXCL12产生和中性粒细胞上的CXCR4表达,从而中断了基于CXCL12 / CXCR4的中性粒细胞滞留。
活化的嗜中性粒细胞产生CCL3、CCL4、CCL5、CCL20、CXCL1、CXCL8、CXCL9和CXCL10。
因此,它们可以通过促进额外的免疫细胞的流入来促进和扩大初始的急性炎症反应。
炎性单核细胞表达许多的趋化因子受体,其可能在粘附和迁移中发挥特异性和非冗余作用。
例如,单核细胞表达CXCR2,但它们不会响应于CXCL8而迁移。
相反,CXCL8/CXCR2相互作用被证明是在动脉粥样化模型中单核细胞对血管内皮的牢固粘附所必需的。
除CXCR2外,CCR1和CCR5可以促进单核细胞在体外内皮细胞粘附和迁移。
最后,转移实验表明,CCR6是免疫后将炎性单核细胞迁移到皮肤组织中所必需的。
尽管如此,CCR6的配体CCL20在体外不诱导单核细胞迁移,因此CCL20/CCR6在单核细胞迁移中的作用仍不清楚(16)。
嗜酸性粒细胞表达趋化因子受体CCR1和CCR3,使其能够响应多种趋化因子,包括嗜酸性粒细胞趋化因子(CCL11、CCL24和CCL26)。
在哮喘模型中,CCL11、CCL24和CCL26在暴露于IL-4和IL-13时在肺中强烈诱导。
CCR3和CCL11都能促进嗜酸性粒细胞向周围组织的迁移。
CCL24和CCL26也诱导嗜酸性粒细胞迁移。
如上所述,天然淋巴细胞在稳态条件下表达炎性趋化因子受体,这使得它们能够快速迁移并对炎症刺激作出反应。
趋化因子介导的细胞迁移可以促进先天和适应性免疫细胞之间重要的细胞相互作用。
趋化因子起初被认为是天然免疫细胞的重要化学引诱物,如嗜中性粒细胞和巨噬细胞。
随着研究的深入,趋化因子系统对于产生原发性肝炎所需的T细胞、B细胞和DC的贩运模式、迁移行为、细胞相互作用和定位也是至关重要。
趋化因子通过影响其在淋巴组织中的细胞相互作用和定位在起始初始T细胞中起重要作用,也在适应性免疫应答的中枢细胞命运决定中起重要作用,如效应和记忆分化。
此外,Treg不仅受趋化因子的影响,而且也影响趋化因子表达,这是发挥其抑制功能的一种方式。
附图:趋化因子表达细胞及其靶细胞图注释:: Macrophages, : Monocytes, : Fibroblasts, : Neutrophils, : Megakaryocytes, : T Cells, : Epithelial Cells, : Endothelial Cells, : Eosinophils, : Basophils, : B Cells, :Melanocytes, : Myeloid cell, : DCs;更多内容请关注我们近期在官网分享的细胞因子海报(Post of human cytokine and chemokine-Cell sources, cell targets and major funcetions)。