趋化因子家族及其受体基础研究进展
- 格式:docx
- 大小:96.85 KB
- 文档页数:4
趋化因子及其受体在免疫细胞中的作用研究概述趋化因子是目前成员最多的细胞因子家族,在人和小鼠中大概有50个内源性趋化因子。
这些因子大约结合20多个跨膜受体。
趋化因子的主要作用是控制免疫细胞的迁移模式,对细胞运动至关重要。
趋化因子系统在初始T细胞产生,决定细胞的分化(如效应细胞和记忆细胞),影响调节性T细胞的功能,调节免疫细胞迁移和定位,已达到体内平衡。
趋化因子在急性炎症和淋巴系统中对免疫反应的产生和调节具有重要作用。
趋化因子在炎性疾病及癌症中的作用使其成为新的药物靶点。
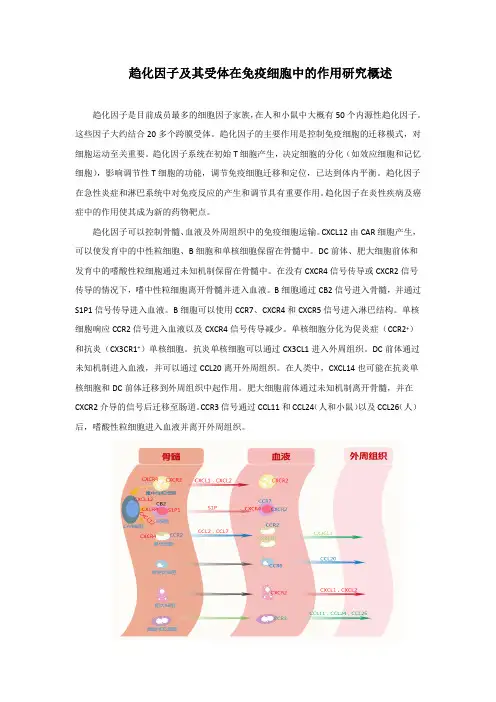
趋化因子可以控制骨髓、血液及外周组织中的免疫细胞运输。
CXCL12由CAR细胞产生,可以使发育中的中性粒细胞、B细胞和单核细胞保留在骨髓中。
DC前体、肥大细胞前体和发育中的嗜酸性粒细胞通过未知机制保留在骨髓中。
在没有CXCR4信号传导或CXCR2信号传导的情况下,嗜中性粒细胞离开骨髓并进入血液。
B细胞通过CB2信号进入骨髓,并通过S1P1信号传导进入血液。
B细胞可以使用CCR7、CXCR4和CXCR5信号进入淋巴结构。
单核细胞响应CCR2信号进入血液以及CXCR4信号传导减少。
单核细胞分化为促炎症(CCR2+)和抗炎(CX3CR1+)单核细胞。
抗炎单核细胞可以通过CX3CL1进入外周组织。
DC前体通过未知机制进入血液,并可以通过CCL20离开外周组织。
在人类中,CXCL14也可能在抗炎单核细胞和DC前体迁移到外周组织中起作用。
肥大细胞前体通过未知机制离开骨髓,并在CXCR2介导的信号后迁移至肠道。
CCR3信号通过CCL11和CCL24(人和小鼠)以及CCL26(人)后,嗜酸性粒细胞进入血液并离开外周组织。
趋化因子精细控制免疫细胞前体的发育及分化,发生在原发性淋巴器官-骨髓和胸腺。
在胸腺中,T细胞祖细胞产生的CCL21、CCL25和CXCL12与CCR7、CCR9和CXCR4相互作用决定胸腺中T细胞的发育。
在骨髓中,免疫细胞的稳态保留和发育在很大程度上依赖于CXCL12/CXCR4相互作用。

乳腺癌肿瘤细胞中趋化因子CXCL12及其受体CXCR4的研
究进展
刘小林;蔡宁;童本定
【期刊名称】《药学与临床研究》
【年(卷),期】2010(18)2
【摘要】CXCL12因子及其受体CXCR4作为趋化因子家族中与肿瘤关系最为密切的一对,特别在乳腺癌方面,无论是对原位肿瘤还是转移性肿瘤都进行了一系列深入的研究,本文就这一方面的研究进行了总结和展望.
【总页数】3页(P120-122)
【作者】刘小林;蔡宁;童本定
【作者单位】江苏省肿瘤医院,南京,210009;江苏省肿瘤医院,南京,210009;江苏省肿瘤医院,南京,210009
【正文语种】中文
【中图分类】R937.9
【相关文献】
1.趋化因子CXCL12/SDF-1及其受体CXCR4与系统性红斑狼疮的研究进展 [J], 吴晓蓓;苏美华;马天骄;毕黎琦
2.不同分子分型乳腺癌组织中趋化因子CXCL12及其受体CXCR4和CXCR7的表达及临床意义 [J], 吴唯;钱立元;戴荆;丁波泥;陈学东
3.趋化因子CXCL12及其受体CXCR4在神经系统疾病中的研究进展 [J], 汪琦;朱
舟;王伟
4.趋化因子CXCL12及其受体CXCR4、 CXCR7在子宫内膜异位症中的作用研究进展 [J], 张琼; 刘颂平
5.趋化因子CXCL12和其受体CXCR4在神经系统肿瘤中的研究进展 [J], 王金;幸兵
因版权原因,仅展示原文概要,查看原文内容请购买。



cxcr2因子全文共四篇示例,供读者参考第一篇示例:CXCR2因子是一种在生物体中起着重要作用的蛋白质因子,它属于趋化因子受体家族,也被称为趋化因子受体2。
CXCR2因子主要在免疫系统中发挥作用,参与调节炎症反应、免疫应答、白细胞迁移等生理过程。
本文将从CXCR2因子的结构、功能、调控机制以及与疾病相关的研究进展等方面进行详细阐述。
一、CXCR2因子的结构CXCR2因子是一种膜上受体蛋白质,其分子结构由7个跨膜结构域组成,这种结构是许多受体蛋白质的共同特征。
CXCR2因子的N端位于细胞外,C端位于细胞内,这种结构决定了其在细胞膜上的位置和功能。
CXCR2因子与其配体结合后,会激活信号传导通路,从而引发一系列生理效应。
CXCR2因子的活性受到多种因素的调控,例如细胞内信号通路的调控、配体的结合等。
研究表明,CXCR2因子的活性会受到炎症介质、细胞凋亡、氧化应激等多种生理和病理因素的影响。
调控CXCR2因子的活性也是治疗炎症性疾病的重要方式之一。
四、与疾病相关的研究进展CXCR2因子在多种疾病的发生和发展过程中起着关键作用。
炎症性疾病、自身免疫性疾病、肿瘤等都与CXCR2因子的异常表达和活性有关。
近年来,越来越多的研究表明,调控CXCR2因子的活性可能成为治疗这些疾病的有效手段。
第二篇示例:CXCR2因子是一种重要的化学信号分子,在细胞信号传导和炎症反应中起着关键的作用。
它是一种趋化因子受体,能够诱导白细胞向炎症部位移动,并参与细胞间的通讯和调控。
CXCR2因子在机体的免疫反应、炎症反应、细胞增殖和损伤修复等过程中发挥着重要作用。
研究表明,CXCR2因子在多种疾病的发生和发展中起着至关重要的作用。
在炎症性疾病中,CXCR2因子调节着炎症反应的程度和范围,对疾病的发展起着重要影响。
在肿瘤的发生和生长中,CXCR2因子也可以通过调节肿瘤微环境、促进肿瘤血管生成等方式,影响肿瘤的发展和预后。
CXCR2因子在免疫反应中也扮演着关键角色。




趋化因子及其受体在胶质瘤中作用的研究进展张晓辉ꎬ马莉ꎬ朴颖哲ꎬ李文良(天津医科大学肿瘤医院国家肿瘤临床医学研究中心天津市肿瘤防治重点实验室天津市恶性肿瘤临床医学研究中心ꎬ天津300060)㊀㊀摘要:趋化因子是一类高度保守的小分子分泌蛋白ꎬ能够介导细胞定向移动ꎮ趋化因子与细胞膜上相应的趋化因子受体结合ꎬ激活下游信号通路ꎬ在细胞移动㊁增殖㊁分化㊁存活中发挥作用ꎬ从而参与机体的生理病理过程ꎮ趋化因子及其受体与炎症㊁免疫㊁肿瘤转移和侵袭关系密切ꎬ是肿瘤进展和治疗方面的研究热点ꎮ多种趋化因子及其受体在胶质瘤中表达升高ꎬ可促进胶质瘤细胞侵袭㊁增殖㊁存活㊁上皮间质转化ꎬ与胶质瘤干细胞和血液供应关系密切ꎬ有望成为胶质瘤治疗的新靶点ꎮ㊀㊀关键词:趋化因子ꎻ趋化因子受体ꎻ胶质瘤ꎻ靶向治疗㊀㊀doi:10.3969/j.issn.1002 ̄266X.2019.29.027㊀㊀中图分类号:R739.4㊀㊀文献标志码:A㊀㊀文章编号:1002 ̄266X(2019)29 ̄0089 ̄04基金项目:国家自然科学基金青年项目(81702481)ꎻ天津市自然科学基金青年项目(15JCQNJC44800)ꎮ通信作者:李文良(E ̄mail:tjzlnaoxike@sina.com)㊀㊀中枢神经系统原发恶性肿瘤中约80%为胶质瘤ꎬ而胶质瘤中约55%为WHOⅣ级的胶质母细胞瘤ꎬ其侵袭性强ꎬ恶性程度高ꎬ预后差ꎮ研究显示ꎬ趋化因子及其受体与肿瘤转移和侵袭关系密切ꎮ趋化因子是一类高度保守的小分子分泌蛋白ꎬ具有介导细胞定向移动的趋化作用ꎮ目前发现的趋化因子约有50种ꎬ依据N端半胱氨酸残基的数目和相对位置分为CXC㊁CC㊁XC㊁CX3C四类ꎻ趋化因子受体已发现约20种ꎮ趋化因子与细胞膜上相应的趋化因子受体结合ꎬ激活下游的信号通路ꎬ在细胞迁移㊁增殖㊁分化㊁存活中发挥作用[1]ꎮ现将趋化因子及其受体在胶质瘤中作用的研究进展综述如下ꎮ1㊀趋化因子及其受体在胶质瘤中的表达㊀㊀研究发现ꎬ多种趋化因子及其受体在胶质瘤中表达升高ꎮCXCR4主要表达于胶质瘤细胞ꎬ其配体CXCL12主要表达于血管内皮细胞ꎬ二者在坏死旁肿瘤组织中尤其多见[2]ꎮCCR5㊁CXCL5㊁CXCR7㊁CCL11 ̄CCR3在胶质瘤组织中的表达明显增高ꎬ并与患者肿瘤级别高㊁临床分期晚㊁生存时间短密切相关ꎬ提示其可用于胶质瘤患者的生存预后判断[3~6]ꎮ2㊀趋化因子及其受体与胶质瘤细胞增殖㊁迁移和侵袭2.1㊀CXCL16及其受体CXCR6㊀CXCL16及其受体CXCR6与胶质瘤细胞的增殖㊁迁移和侵袭有关ꎮAdamski等[7]报道ꎬ从切除的胶质母细胞瘤中分离出的快速迁移肿瘤细胞CXCL16表达高于缓慢迁移肿瘤细胞ꎬ提示CXCL16可促进胶质母细胞瘤细胞迁移ꎮLepore等[8]对鼠胶质瘤细胞系GL261和成人胶质母细胞瘤细胞进行研究ꎬ发现胶质瘤细胞产生的CXCL16可促使胶质瘤相关小胶质细胞㊁巨噬细胞向抗炎和促肿瘤表型极化ꎬ抑制免疫反应ꎬ形成有利于肿瘤生长和侵袭的微环境ꎻ并且CXCL16可直接作用于胶质瘤细胞表达的CXCR6ꎬ促进其增殖㊁迁移和侵袭ꎬ而抑制CXCR6或CXCL16表达可显著降低胶质瘤细胞的增殖和侵袭ꎮ2.2㊀CXCL8及其受体CXCR1和CXCR2㊀弥漫浸润性生长和坏死是胶质母细胞瘤的重要特征ꎮAhn等[9]发现ꎬ在胶质母细胞瘤患者病理标本中ꎬCXCL8阳性肿瘤细胞主要分布于坏死区边缘ꎻ而对人胶质母细胞瘤细胞系CRT ̄MG的研究表明ꎬ坏死细胞可诱导肿瘤细胞p38㊁JNK㊁IκBα磷酸化和转录因子AP ̄1㊁NF ̄κB结合到CXCL8启动子ꎬ导致CXCL8mRNA表达和蛋白分泌增加ꎬ显著增强胶质母细胞瘤细胞的迁移和侵袭能力ꎮSharma等[10]研究发现ꎬ联合阻断CXCR1和CXCR2可明显抑制体外培养人胶质母细胞瘤细胞系U ̄87MG细胞的增殖ꎬ而对CXCL8及其受体CXCR1和CXCR2的共同阻断可以达到最大的抑制效果ꎮ2.3㊀CCL5及其受体CCR5㊀CCL5及其受体CCR5对胶质瘤细胞的增殖㊁迁移和侵袭有促进作用ꎮDai等[4]研究发现ꎬ上调CXCL5表达可以显著提高体外培养U87细胞的增殖和迁移能力ꎬ下调则有明显的98抑制作用ꎬ并且环境中CXCL5水平的变化同样会影响U87细胞的增殖和迁移能力ꎬ显示CXCL5能通过自分泌和旁分泌方式作用于胶质瘤细胞ꎻ进一步分子机制研究提示MAPK信号通路的激活在CXCL5促进胶质瘤细胞的增殖和迁移中发挥作用ꎮZhao等[3]对体外培养的人胶质瘤细胞系U87和U251细胞进行研究发现ꎬCCL5 ̄CCR5轴可以诱导胶质母细胞瘤细胞增殖和侵袭ꎻ另外ꎬ抑制CCR5表达的U87细胞的裸小鼠脑内移植瘤的生长得到显著抑制ꎬ可以见到明显的肿瘤体积缩小和质量减轻ꎮWang等[11]研究发现ꎬ在胶质母细胞瘤组织中大量浸润的巨噬细胞可以分泌CCl4ꎬ取其作用于体外培养U87细胞的CCR5ꎬ可以促进U87细胞的MMP ̄9表达ꎬ提高U87细胞的侵袭能力ꎻ而缺氧既可以通过上调IRF ̄8表达增加巨噬细胞的CCl4分泌ꎬ也能促进U87细胞的CCR5表达ꎬ从两方面共同增强U87细胞的侵袭能力ꎮ2.4㊀CCL11及其受体CCR3㊀CCL11及其受体CCR3可提高胶质瘤细胞的增殖㊁迁移和侵袭ꎮTian等[6]证实ꎬCCL11/CCR3对体外培养U251MG㊁U87MG细胞的增殖㊁迁移和侵袭均有促进作用ꎮPu等[12]报道ꎬ抑制CXCR3表达可显著降低胶质母细胞瘤细胞的侵袭能力ꎬ而CXCR3过表达的胶质母细胞瘤细胞的侵袭能力明显提高ꎬ提示CXCR3可促进胶质母细胞瘤细胞侵袭ꎮ3㊀趋化因子及其受体与胶质瘤细胞存活与凋亡㊀㊀趋化因子及其受体可通过多种机制提高胶质瘤细胞的存活能力ꎮ胶质母细胞瘤细胞在室管膜下区可获得放射抗性ꎬ提高存活能力ꎬCXCL12在此过程中发挥重要作用ꎻ而使用AMD3100抑制CXCL12/CXCR4轴可增加室管膜下区胶质母细胞瘤细胞的放射敏感性[13]ꎮCalinescu等[14]研究发现ꎬCXCR4拮抗剂AMD3100对体外培养的胶质母细胞瘤细胞有抑制增殖㊁诱发凋亡和阻碍细胞周期进程的作用ꎬ其中伴有pAkt㊁Rb㊁Bcl ̄XL㊁CyclinD1㊁cdk4/cdk6㊁HIF ̄1α㊁CXCL12表达下调ꎬ提示CXCL12/CXCR4信号轴通过一种自分泌正反馈机制调控胶质母细胞瘤细胞的存活与增殖ꎮ㊀㊀Chang等[15]研究表明ꎬ肿瘤来源的CCL20和骨保护素可诱导巨噬细胞产生CCL2ꎬ而CCL2可通过与受体CCR4和CCR2作用分别募集调节性T细胞和髓源抑制性细胞至胶质瘤ꎬ成为免疫抑制微环境的重要组成部分ꎬ利于肿瘤细胞存活ꎬ并提示可通过阻断CCL2 ̄CCR4/2轴抑制胶质瘤细胞的免疫逃避ꎮLu等[16]研究发现ꎬ通过转染CCL2 ̄siRNA降低U251细胞的CCL2表达水平ꎬ可以抑制U251细胞增殖㊁阻滞U251细胞周期在S期和增加U251细胞凋亡ꎬ并可检测到凋亡相关蛋白caspase ̄3㊁caspase ̄7表达上调和TNFRSF10C表达下调ꎮ由此可见ꎬ抑制趋化因子及其受体表达可从多个方面降低胶质瘤细胞的存活ꎮ4㊀趋化因子及其受体与胶质瘤血液供应㊀㊀血液供应与胶质瘤的恶性生物学行为密切相关ꎬ而趋化因子及其受体在其中发挥重要作用ꎮTabouret等[17]对29例经手术加一线放化疗后复发再手术的胶质母细胞瘤患者进行研究发现ꎬ与初诊时相比ꎬ80%患者的复发肿瘤标本中存在VEGFR2 ̄HIF1αmRNA表达减少和CXCL12 ̄CXCR4mRNA表达增多ꎬ提示在放化疗后胶质母细胞瘤复发过程中可能存在血管生成模式由VEGFR2 ̄HIF1α向CXCL12 ̄CXCR4通路的转变ꎮ血管生成拟态(VM)是由恶性肿瘤细胞形成的血管类似结构ꎬ是胶质瘤抗VEGF治疗失败的一个关键因素ꎮGuo等[18]在临床胶质瘤标本的缺氧区域观察到CXCR4和VM的共定位ꎬ提示缺氧诱导的CXCR4高表达在VM形成中发挥重要作用ꎮAngara等[19]通过对U251细胞系及其脑内移植瘤动物模型的研究发现ꎬ瓦他拉尼或阿瓦斯汀的抗血管生成治疗可使胶质母细胞瘤中CXCL8及其受体CXCR2的表达显著增高ꎬCXCR2阳性胶质母细胞瘤细胞可获得干细胞样状态及内皮细胞样表型ꎬ并参与到VM的形成中ꎬ导致治疗抵抗ꎻ给予CXCR2 ̄shRNA和CXCR2抑制剂SB225002可减少VMꎬ延缓胶质母细胞瘤的生长ꎮ以上研究提示ꎬ抑制趋化因子及其受体的表达有助于胶质瘤的抗血管生成治疗ꎮ5㊀趋化因子及其受体与胶质瘤干细胞㊀㊀胶质瘤干细胞是胶质瘤中一类与神经干细胞类似的具有较强自我更新㊁无限增殖能力和多向分化潜能的细胞ꎬ在胶质瘤发生㊁发展㊁治疗抵抗和复发中发挥关键作用ꎮ室管膜下区是成体中枢神经系统主要的神经干细胞nicheꎬ该区可吸引胶质母细胞瘤干细胞(GSC)向其迁移和定居ꎬ对胶质母细胞瘤的扩散和复发产生影响[20]ꎬCXCL12及其受体CXCR4分别表达于室管膜下区和胶质母细胞瘤细胞ꎬ侵入室管膜下区的GSC较原发病灶内的胶质瘤细胞表现出更强的CXCL12引导下的迁移能力ꎮHira等[21]对高级别胶质瘤标本进行研究ꎬ发现在小动脉周围可见到CD133阳性和nestin阳性的胶质瘤干细胞样细胞(GSLC)的nicheꎬ其中有CXCL12及其受体CXCR4表达ꎻCXCL12参与GSLC向niche迁移和09在其中停留的过程ꎮ6㊀趋化因子及其受体与胶质瘤细胞上皮间质转化(EMT)㊀㊀胶质瘤细胞在EMT过程中获得间质细胞特性ꎬ增强侵袭㊁迁移和存活能力ꎬ在胶质瘤的进展及治疗抵抗中发挥重要作用ꎮXu等[22]研究发现ꎬCXCL12 ̄CXCR4信号轴通过诱导前梯度蛋白2(AGR2)表达调控胶质母细胞瘤的EMT进程ꎮGuo等[18]发现缺氧可诱导胶质母细胞瘤MIF㊁CXCR4和间质细胞标志物N ̄钙黏蛋白㊁波形蛋白强烈表达ꎬ并抑制上皮细胞标志物E ̄钙黏蛋白表达ꎬ提示CXCR4在缺氧诱导的胶质母细胞瘤细胞EMT中起关键作用ꎮ㊀㊀Zhang等[23]研究发现ꎬCXCL8在胶质瘤组织和细胞系中存在高表达ꎬCXCL8通过CXCR1 ̄ELMO1 ̄NF ̄κB ̄Snail信号通路诱导胶质瘤细胞的间质转化ꎬN ̄钙黏蛋白㊁波形蛋白表达升高ꎬ胶质细胞标志物T ̄钙黏蛋白表达降低ꎬ促进胶质瘤细胞迁移和侵袭ꎻ体内外实验表明ꎬ抑制CXCR1表达可以减少CX ̄CL8自分泌诱导的胶质瘤细胞侵袭ꎮZheng等[24]报道ꎬ在TGF ̄β1诱导胶质瘤细胞EMT的过程中ꎬE ̄钙黏蛋白表达降低和N ̄钙黏蛋白㊁波形蛋白表达增高ꎬ而这些EMT标志物改变可被CCR7 ̄siRNA逆转ꎬ并且用CCR7 ̄siRNA和CCR7中和抗体均可显著减少TGF ̄β1引发的胶质瘤细胞侵袭和迁移ꎮ7㊀以趋化因子及其受体为靶点的胶质瘤治疗7.1㊀以CXCL12及其受体CXCR4为靶点㊀Gravina等[25]报道ꎬ一种可透过血脑屏障的高选择性CX ̄CR4拮抗剂PRX177561不仅可以抑制体外培养的人胶质母细胞瘤细胞系的增殖㊁侵袭ꎬ延缓裸小鼠皮下异种移植胶质母细胞瘤的生长ꎬ而且能延长脑内异种移植胶质母细胞瘤裸小鼠的无病生存期(DFS)和总生存期(OS)ꎮMercurio等[26]报道ꎬ对U87MG细胞脑内移植瘤小鼠给予选择性CXCR4肽拮抗剂ꎬ不仅能够影响肿瘤细胞本身ꎬ还能促进巨噬细胞的M1极化ꎬ抑制肿瘤血管生成ꎮPham等[27]报道ꎬVEGFR信号抑制剂西地尼布和凡德他尼可提高VEGFR阳性的胶质母细胞瘤细胞系和异种移植瘤的CXCR4表达ꎬ这依赖于TGFβ/TGFβRꎬ而非HGF/MET信号ꎻ西地尼布与AMD3100联合应用相比于单药治疗ꎬ可以使脑内移植瘤小鼠的生存时间明显延长ꎮ抗血管生成靶向治疗会引起胶质母细胞瘤组织缺氧㊁CXCL12表达增高和巨噬细胞募集ꎬ导致治疗抵抗ꎮGagner等[28]ꎬ用专有蛋白表位模拟技术开发的一种新型高效选择性CXCR4拮抗剂POL5551ꎬ可通过抑制低氧诱导的胶质瘤细胞迁移ꎬ减少抗VEGF治疗后的胶质瘤侵袭ꎬ并使已知对胶质瘤的生长和扩散有促进作用的巨噬细胞和胶质瘤干细胞的数量减少ꎬ通过多种机制作用于胶质瘤的治疗抵抗ꎮ7.2㊀以CXCR7为靶点㊀Liu等[29]研究发现ꎬ用CXCR7 ̄siRNA或CXCR7的小分子拮抗剂CCX771均能显著抑制胶质母细胞瘤细胞增殖与侵袭ꎮCX ̄CR7选择性表达于胶质母细胞瘤细胞和肿瘤相关血管ꎬ并且肿瘤CXCR7高表达与不良预后及潜在治疗抵抗相关ꎮSalazar等[30]设计了一种以CXCR7为靶点的嵌合抗体X7Abꎬ利用自然杀伤细胞和补体的细胞毒活性以及巨噬细胞的吞噬能力来杀伤胶质母细胞瘤细胞ꎬ同时增强M1巨噬细胞活化ꎬ支持体内抗肿瘤免疫应答ꎻX7Ab和替莫唑胺联合应用相比于单药治疗ꎬ可以显著延长异种脑内移植胶质母细胞瘤小鼠的生存时间ꎬ并减少替莫唑胺用量ꎮ8㊀展望㊀㊀趋化因子及其受体与肿瘤细胞侵袭㊁增殖㊁存活㊁EMT和肿瘤干细胞㊁血液供应关系密切ꎬ这是它们在胶质瘤和肺癌㊁乳腺癌㊁结肠癌等其他恶性肿瘤中的共性表现ꎮ但胶质瘤具有中枢神经系统肿瘤的特殊性ꎬ如血脑屏障的存在ꎮ另外ꎬ趋化因子及其受体除了在肿瘤浸润性生长和转移中发挥促进作用外ꎬ它们还是免疫等肿瘤防御机制的组成部分ꎬ这种两面性增加了其临床应用的复杂性ꎮ趋化因子及其受体目前尚未进入胶质瘤临床治疗中ꎬ但其应用前景广阔ꎬ希望未来能找到切实可行的运用途径ꎬ为胶质瘤的诊断和治疗提供帮助ꎮ参考文献:[1]HughesCEꎬNibbsRJB.Aguidetochemokinesandtheirreceptors[J].FEBSJꎬ2018ꎬ285(16):2944 ̄2971.[2]TangWꎬChenYꎬWangXꎬetal.ExpressionofCXC ̄motif ̄che ̄mokine12andthereceptorC ̄X ̄Creceptor4ingliomaandtheef ̄fectonperitumoralbrainedema[J].OncolLettꎬ2018ꎬ15(2):2501 ̄2507.[3]ZhaoLꎬWangYꎬXueYꎬetal.Criticalrolesofchemokinerecep ̄torCCR5inregulatingglioblastomaproliferationandinvasion[J].ActaBiochimBiophysSin(Shanghai)ꎬ2015ꎬ47(11):890 ̄898. [4]DaiZꎬWuJꎬChenFꎬetal.CXCL5promotestheproliferationandmigrationofgliomacellsinautocrine ̄andparacrine ̄dependentmanners[J].OncolRepꎬ2016ꎬ36(6):3303 ̄3310. [5]DengLꎬZhengWꎬDongXꎬetal.ChemokinereceptorCXCR7isanindependentprognosticbiomarkeringlioblastoma[J].CancerBiomarkꎬ2017ꎬ20(1):1 ̄6.[6]TianMꎬChenLꎬMaLꎬetal.Expressionandprognosticsignifi ̄canceofCCL11/CCR3inglioblastoma[J].Oncotargetꎬ2016ꎬ7(22):32617 ̄27.[7]AdamskiVꎬMentleinRꎬLuciusRꎬetal.Thechemokinereceptor19CXCR6evokesreversesignalingviathetransmembranechemokineCXCL16[J].IntJMolSciꎬ2017ꎬ18(7):E1468. [8]LeporeFꎬDᶄAlessandroGꎬAntonangeliFꎬetal.CXCL16/CX ̄CR6axisdrivesmicroglia/macrophagesphenotypeinphysiologicalconditionsandplaysacrucialroleinglioma[J].FrontImmunolꎬ2018ꎬ9:2750.[9]AhnSHꎬParkHꎬAhnYHꎬetal.Necroticcellsinfluencemigra ̄tionandinvasionofglioblastomaviaNF ̄κB/AP ̄1 ̄mediatedIL ̄8regulation[J].SciRepꎬ2016ꎬ6:24552.[10]SharmaIꎬSinghAꎬSirajFꎬetal.IL ̄8/CXCR1/2signallingpro ̄motestumorcellproliferationꎬinvasionandvascularmimicryinglioblastoma[J].JBiomedSciꎬ2018ꎬ25(1):62.[11]WangYꎬLiuTꎬYangNꎬetal.HypoxiaandmacrophagespromoteglioblastomainvasionbytheCCl4 ̄CCR5axis[J].OncolRepꎬ2016ꎬ36(6):3522 ̄3528.[12]PuYꎬLiSꎬZhangCꎬetal.HighexpressionofCXCR3isanin ̄dependentprognosticfactoringlioblastomapatientsthatpromotesaninvasivephenotype[J].JNeurooncolꎬ2015ꎬ122(1):43 ̄51. [13]GoffartNꎬLombardAꎬLallemandFꎬetal.CXCL12mediatesglioblastomaresistancetoradiotherapyinthesubventricularzone[J].NeuroOncolꎬ2017ꎬ19(1):66 ̄77.[14]CalinescuAAꎬYadavVNꎬCarballoEꎬetal.Survivalandprolif ̄erationofneuralprogenitor ̄derivedglioblastomasunderhypoxicstressiscontrolledbyaCXCL12/CXCR4autocrine ̄positivefeed ̄backmechanism[J].ClinCancerResꎬ2017ꎬ23(5):1250 ̄1262. [15]ChangALꎬMiskaJꎬWainwrightDAꎬetal.CCL2Producedbythegliomamicroenvironmentisessentialfortherecruitmentofregulato ̄ryTcellsandmyeloid ̄derivedsuppressorcells[J].CancerResꎬ2016ꎬ76(19):5671 ̄5682.[16]LuBꎬZhouYꎬSuZꎬetal.EffectofCCL2siRNAonproliferationandapoptosisintheU251humangliomacellline[J].MolMedRepꎬ2017ꎬ16(3):3387 ̄3394.[17]TabouretEꎬTchoghandjianAꎬDenicolaiEꎬetal.Recurrenceofglioblastomaafterradio ̄chemotherapyisassociatedwithanangio ̄genicswitchtotheCXCL12 ̄CXCR4pathway[J].Oncotargetꎬ20156(13):11664 ̄11675.[18]GuoXꎬXuSꎬGaoXꎬetal.Macrophagemigrationinhibitoryfac ̄torpromotesvasculogenicmimicryformationinducedbyhypoxiaviaCXCR4/AKT/EMTpathwayinhumanglioblastomacells[J].On ̄cotargetꎬ2017ꎬ8(46):80358 ̄80372.[19]AngaraKꎬBorinTFꎬRashidMHꎬetal.CXCR2 ̄expressingtumorcellsdrivevascularmimicryinantiangiogenictherapy ̄resistantglio ̄blastoma[J].Neoplasiaꎬ2018ꎬ20(10):1070 ̄1082.[20]GoffartNꎬKroonenJꎬDiValentinEꎬetal.Adultmousesubven ̄tricularzonesstimulateglioblastomastemcellsspecificinvasionthroughCXCL12/CXCR4signaling[J].NeuroOncolꎬ2015ꎬ17(1):81 ̄94.[21]HiraVVꎬPloegmakersKJꎬGreversFꎬetal.CD133+andnestin+gliomastem ̄likecellsresidearoundCD31+arteriolesinnichesthatexpressSDF ̄1αꎬCXCR4ꎬosteopontinandcathepsinK[J].JHistochemCytochemꎬ2015ꎬ63(7):481 ̄93.[22]XuCꎬLiuYꎬXiaoLꎬetal.Theinvolvementofanteriorgradient2inthestromalcell ̄derivedfactor1 ̄inducedepithelial ̄mesenchymaltransitionofglioblastoma[J].TumourBiolꎬ2016ꎬ37(5):6091 ̄6097.[23]ZhangBꎬShiLꎬLuSꎬetal.AutocrineIL ̄8promotesF ̄actinpol ̄ymerizationandmediatemesenchymaltransitionviaELMO1 ̄NF ̄κB ̄Snailsignalinginglioma[J].CancerBiolTherꎬ2015ꎬ16(6):898 ̄911.[24]ZhengYꎬMiuYꎬYangXꎬetal.CCR7mediatesTGF ̄β1 ̄inducedhumanmalignantgliomainvasionꎬmigrationꎬandepithelial ̄mes ̄enchymaltransitionbyactivatingMMP2/9throughthenuclearfac ̄torkappaBsignalingpathway[J].DNACellBiolꎬ2017ꎬ36(10):853 ̄861.[25]GravinaGLꎬManciniAꎬColapietroAꎬetal.ThenovelCXCR4antagonistꎬPRX177561ꎬreducestumorcellproliferationandac ̄celeratescancerstemcelldifferentiationinglioblastomapreclinicalmodels[J].TumourBiolꎬ2017ꎬ39(6):1010428317695528. [26]MercurioLꎬAjmone ̄CatMAꎬCecchettiSꎬetal.TargetingCX ̄CR4byaselectivepeptideantagonistmodulatestumormicroenvi ̄ronmentandmicrogliareactivityinahumanglioblastomamodel[J].JExpClinCancerResꎬ2016ꎬ35:55.[27]PhamKꎬLuoDꎬSiemannDWꎬetal.VEGFRinhibitorsupregu ̄lateCXCR4inVEGFreceptor ̄expressingglioblastomainaTGFβRsignaling ̄dependentmanner[J].CancerLettꎬ2015ꎬ360(1):60 ̄67.[28]GagnerJPꎬSarfrazYꎬOrtenziVꎬetal.MultifacetedC ̄X ̄Cche ̄mokinereceptor4(CXCR4)inhibitioninterfereswithanti ̄vascularendothelialgrowthfactortherapy ̄inducedgliomadissemination[J].AmJPatholꎬ2017ꎬ187(9):2080 ̄2094.[29]LiuYꎬCarson ̄WalterEꎬWalterKA.Targetingchemokinerecep ̄torCXCR7inhibitsgliomacellproliferationandmobility[J].Anti ̄cancerResꎬ2015ꎬ35(1):53 ̄64.[30]SalazarNꎬCarlsonJCꎬHuangKꎬetal.Achimericantibodya ̄gainstACKR3/CXCR7incombinationwithTMZactivatesimmuneresponsesandextendssurvivalinmouseGBMmodels[J].MolT ̄herꎬ2018ꎬ26(5):1354 ̄1365.(收稿日期:2019 ̄05 ̄21)29。
趋化因子及其受体在正常早期妊娠中的作用研究进展智亚楠1,2,甄诚1,3,刘娇1,3,侯涛涛1,李林青1,张萍萍1,李亚丽11 河北省人民医院生殖遗传科,石家庄050051;2 河北医科大学研究生院;3 华北理工大学研究生院摘要:趋化因子是一类结构相似的小分子家族,其与膜结合的G蛋白偶联受体结合而发挥作用,广泛参与细胞免疫、生长发育、炎症等多种生理功能。
趋化因子在母胎界面的胚胎滋养层、蜕膜基质细胞及蜕膜免疫细胞中普遍表达,并通过其受体发挥作用,一方面能够促进子宫内膜蜕膜化、提高子宫容受性,另一方面可以调控滋养层的增殖、迁移和侵袭,促进胚胎着床和发育;此外,趋化因子可以募集外周免疫细胞到达蜕膜,进一步分化诱导母胎免疫耐受,并且介导胎盘血管形成,多方面参与正常妊娠的建立和维持。
对趋化因子及其受体在正常早期妊娠中的作用机制进行总结,有利于更好地认识早期妊娠生理,并为治疗病理妊娠、妊娠合并症和并发症提供治疗新策略。
关键词:趋化因子;趋化因子受体;母胎界面;滋养层细胞;蜕膜细胞;免疫细胞;早期妊娠doi:10.3969/j.issn.1002-266X.2023.11.024中图分类号:R714.1 文献标志码:A 文章编号:1002-266X(2023)11-0093-04趋化因子属于细胞因子超家族,此家族由结构相似的小分子(8~14 kDa)组成,其通过膜结合的G 蛋白偶联受体激活各种信号通路而发挥作用[1]。
迄今为止,已发现总共超过100种趋化因子,根据N端附近保守的半胱氨酸残基的存在及其位置,临床将趋化因子分为C、CC、CXC和CX3C四个亚组,而发现的趋化因子受体只有20多种,受体的命名取决于其配体的结构[2]。
因受体的种类远少于配体的种类,所以一种趋化因子可以与多种受体结合,同时一种趋化因子受体也可以识别多种趋化因子,构成一个复杂的网络,广泛参与细胞免疫、生长发育、炎症等生理病理过程[3]。
囊胚植入并在孕期形成功能性的胎盘对于妊娠的维持至关重要,这是一个复杂而连续的过程,依赖于囊胚和子宫内膜之间的同步发育、免疫耐受调节以及滋养细胞的增殖、迁移和浸润等,需要母胎之间的双向信号传导之间高度协调。
趋化因子受体CCR5的研究进展朱长斌;蒋子恺;程枫;钱关祥【摘要】CCR5, as the member of CC receptor family, with its ligands being CCL3 (MIP-1α), CCL4 (MIP-1β) and CCL5 (RANTES), is categorized as 7 trans-membrane domain G-protein coupled receptor. CCR5 is expressed in monocytes/macrophages as well as lymphocytes inducing chemotaxis and recruitment in inflammatory response and is an important co-receptor of human immunodeficiency virus ( HIV) -1 virus, leading to the multifunction of CCR5 in progression of various kind of immunological diseases and invasion of HIV-1. Moreover, the expression of CCR5 on the surface of tumor cells and stromal cells contributes to mediating multiple biological behaviors of cancers such as proliferation and invasion. Advanced technologies also lead to the revealing of structure, function, signal transduction and roles of CCRS in the progression of related diseases.%CCR5为趋化因子CC受体家族成员,属7次跨膜G蛋白耦联受体,配体为CCL3 (MIP-1α)、CCL4( MIP-1β)、CCL5( RANTES).CCR5主要表达于单核/巨噬细胞和淋巴细胞,与其配体介导CCR5+免疫细胞的趋化、募集过程.因此,多种免疫性疾病的发生和发展过程均有CCR5参与.CCR5是人类免疫缺陷病毒Ⅰ型(HIV-1)入侵时的重要辅助受体,而在肿瘤细胞和各类肿瘤相关间质细胞的表面也可见其表达,并介导肿瘤增殖、浸润等多种生物学过程.随着相关研究技术的发展,进一步加深了对CCR5的结构、功能、信号通路及其在相关疾病中的作用的认识.【期刊名称】《上海交通大学学报(医学版)》【年(卷),期】2012(032)006【总页数】6页(P809-814)【关键词】趋化因子受体;CCR5;免疫性疾病;肿瘤【作者】朱长斌;蒋子恺;程枫;钱关祥【作者单位】上海交通大学医学院临床医学系,上海200025;上海交通大学医学院临床医学系,上海200025;上海交通大学基础医学院教学实验中心,上海200025;上海交通大学基础医学院生物化学与细胞分子生物学系,上海200025【正文语种】中文【中图分类】R730.2趋化因子是一类具有相似分子结构的超家族趋化性细胞因子,依其一级结构中N端高度保守序列的4个半胱氨酸残基中前2个的排列分布状况的不同被分为4类:C、CC、CXC和CX3C[1]。
趋化因子及其受体在肿瘤发生发展中作用的研究进展董智琦;文国容;庹必光【摘要】趋化因子家族通过作用于跨G蛋白偶联受体来介导趋化因子的活性.趋化因子及其受体形成同源或异源二聚体的能力以及趋化因子与趋化因子受体之间的相互作用,使得趋化因子蛋白家族在很多方面具有目前尚未完全了解的可塑性及复杂性.趋化因子既是炎性反应中的必需调节剂又可以介导宿主对肿瘤的反应.大量数据表明,趋化因子及其受体影响大多数肿瘤的形成.因此,笔者将从趋化因子及其受体的信号转导开始,对其如何影响肿瘤细胞的增殖、凋亡、自噬及免疫浸润作一综述.%The chemokine family mediates the activity of chemokines by acting on G protein -coupled receptors.Because chemokines and their receptors have the ability to form homologous or heterodimers and the interaction between chemokines and chemokine receptors ,the chemokine family has many aspects that are not yet fully understood such as plasticity and complexity .Chemokines not only are essential regulators in the inflammatory response but also mediate the host 's response totumor.Many studies have found that chemokines and their receptors affect the formation of most tumors .Therefore,this article will begin with the signal transduction of chemokines and their receptors,and summarize how they affect the proliferation ,apoptosis,autophagy and immune infiltration of tumor cells .【期刊名称】《安徽医药》【年(卷),期】2018(022)006【总页数】4页(P1011-1014)【关键词】炎症趋化因子类;受体,趋化因子;肿瘤;综述【作者】董智琦;文国容;庹必光【作者单位】遵义医学院附属医院消化内科,贵州遵义 563003;遵义医学院附属医院消化内科,贵州遵义 563003;遵义医学院附属医院消化内科,贵州遵义 563003【正文语种】中文自60年前第一个趋化因子(血小板因子CXCL4)的诞生至今[1],趋化因子及其受体家族已经显著扩大,现在已知约50种趋化因子和20种相关受体。
趋化因子家族及其受体基础研究进展
趋化因子(Chemokine)是一类小分子碱性蛋白,主要的功能是能够趋化细胞定向移动。
目前已经发现的趋化因子有50多种,随着研究的深入,趋化因子及其受体的结构、功能及在体内的作用已经被众多的研究者发现。
趋化因子及其受体的相互作用,可以参与多种生理功能,比如细胞的生长、发育、分化、凋亡和分布等,在病理过程中也具有重要作用,如炎症反应、病原体感染、创伤修复及肿瘤形成和转移等。
趋化因子一般由70-125个氨基酸组成,分子量较小(6-14KD)。
按照一级肽链结构特点,其N端半胱氨酸残基的位置和数目可将趋化因子分为4个亚族:CC、CXC、C和CX3C(C为半胱氨酸,X为任意氨基酸)。
四类趋化因子结构相似性较高,氨基酸序列具有一定的同源性。
根据趋化因子的表达方式以及其在免疫系统中的作用,可以将他们分为两类:内环境稳定性趋化因子和炎症性趋化因子。
内环境稳定性趋化因子主要在归巢场所表达,有着维持内环境稳态的功能,并且对淋巴细胞归巢及成熟有着明确的作用。
炎症性趋化因子由受到刺激的细胞表达,如炎性细胞因子的诱导、细菌毒素或其它破坏内环境稳定的因素的刺激,主要功能是募集效应细胞,在协调天然和获得性免疫反应中起重要作用。
大多数的趋化因子属于CC和CXC两个亚族族。
其中CC亚族有28个成员(CCL1-CCL28),主要对中性粒细胞、单核细胞、肥大细胞、树突细胞、NK细胞、T和B淋巴细胞等具有强
大趋化活性,比较重要的有:单核细胞趋化蛋白(MCP-1/CCL2)、巨噬细胞炎症蛋白(MIP/CCL3)、正常T细胞表达和分泌,活化时表达下降的因子(RANTES/CCL5)等;CXC亚族有17个成员(CXCL1-CXCL17),CXC亚家族主要作用于中性粒细胞,这个亚族比较重要的趋化因子有:
白细胞介素-8(IL-8/CXCL8)、γ干扰素诱生的单核因子(Mig/CXCL9)、γ干扰素诱生蛋白10(IP-10/CXCL10)、基质细胞来源因子1(SDF-1/CXCL12)等。
另外,CXC亚家族根据其第1
个半胱氨酸前有无谷氨酸-亮氨酸-精氨酸序列(Glu-Leu-Arg)进一步分为ELR+和ELR-两类,
前者具有促进血管新生作用。
C亚家族包含两个趋化因子XCL1和XCL2,主要表达于胸腺,作用于CD8+ T淋巴细胞。
CX3C亚家族只有一个趋化因子CX3CL1,也称为不规则趋化因子(fractalkine)或神经元趋化因子(neurotactin),是唯一膜结合性趋化因子,主要作用于单核细胞和中性粒细胞。
趋化因子要发挥生物学作用,必须与相应的受体结合才行。
趋化因子受体(Chemokine Receptor)属于G蛋白偶联受体,具有7个富含疏水氨基酸的α螺旋穿膜区结构,主要表达
于骨髓来源的各白细胞亚群,同时也表达于上皮细胞、血管内皮细胞、神经细胞等类型的细胞。
趋化因子受体根据其结合的配体不同也分为4个亚家族:CCR、CXCR、XCR和CX3CR。
其中CCR亚族已克隆11种(CCR1-CCR11),CXCR亚族6种(CXCR1-CXCR6),另俩个亚族分别各有1种:XCR1和CX3CR1。
趋化因子与其受体之间交叉作用,形成复杂的网络关系,即一种趋化因子可与多个受体结合,一个受体也可以有多个高亲和的趋化因子配体。
如CCR1,可以表达于单核细胞、中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、巨噬细胞、T、B淋巴细胞等多种炎症细胞表面,其配体可有CCL2、CCL3、CCL4、CCL5、CCL6、CCL8、CCL15等,在炎症性疾病中CCR1可与其多种配体结合后,对表达该受体的多种炎症细胞进行趋化和激活,进而引起一系列生物学效应,参与多种炎症疾病的转归;同时,趋化因子CCL8除可与CCR1结合外,还可与CCR2、CCR5结合,充分体现了趋化因子受体与其配体相互作用的复杂性。
但CXC趋化因子及其受体不能与CC趋化因子及其受体交叉结合,只有DARC例外,它可以结合CXC亚家族中的IL-8、CXCL7、GRO -α和CC亚家族中的CCL2及CCL5。
趋化因子及其受体的生物学功能非常多。
起初,趋化因子及其受体是作为趋化性介质被发现,随着研究的深入,趋化因子及其受体的功能也被更多的发现,比如在免疫细胞和器官的发育、免疫应答过程、炎症反应、病原体感染、创伤修复及肿瘤形成和转移等方面发挥广泛的生理和病理作用。
趋化因子在骨髓血细胞生成中起关键作用,研究证明至少有25种趋化因子可以调节骨髓祖细胞增殖,CXCL12及其特异性受体CX2CR4表达缺乏的小鼠存在B淋巴细胞发生和成熟障碍并在围产期死亡。
胸腺是T淋巴细胞发育的重要器官,有许多特异性趋化淋巴细胞定向迁移的趋化因子mRNA 表达,包括CCL17、CCL19、CCL21、CCL25和CXCL12。
趋化因子及其受体在淋巴细胞成熟后向二级淋巴器官的归巢和定居过程中具有关键作用。
趋化因子还参与次级淋巴器官的发育和组建。
趋化因子通过作用于具有不同趋化因子受体表达谱的DC,控制和调节DC完成其迁移过程。
趋化因子通过促进炎症细胞在损伤和感染组织的浸润和活化参与炎症过程。
例如在细菌性肺炎,CXC趋化因子趋化中性粒细胞在炎症部位的聚集对于清除侵入微生物非常必需。
CXCL8、CXCL5和CXCL1、2、3,能促进兔角膜的血管生成。
CXCL4、CXCL10和CXCL9能拮抗ELR+趋化因子诱发的血管生成作用。
其他趋化因子如CCL1、CCL2、CCL11和CX3CL1也参与血管生成过程。
趋化因子及其受体与人类疾病的关系密切,如哮喘患者的支气管粘膜有CCR3及其配体的表达,有研究证明抗CXCR1和CXCR2的药物有助于治疗慢性支气管炎、重症哮喘和CCPD 的炎症反应。
趋化因子及其受体在慢性丙型肝炎中对淋巴细胞的迁移和募集起到至关重要的作用。
许多趋化因子通过细胞转化、血管发生、蛋白酶的分泌和器官特异性转移在肿瘤生长、侵犯和转移等方面发挥作用。
在肿瘤及癌症研究方面,已经证明许多人类癌症具有复杂的趋化因子网络,可能会影响白细胞浸润的程度和表型、血管生成、肿瘤细胞生长、存活和迁移。
最近的研究发现,特异性趋化因子的表达为多种肿瘤转移所必需。
例如,CCR4和CCR7在人乳腺癌细胞系、恶性乳腺肿瘤中高表达,而这些受体的配体CX2CL12和CCL21在肿瘤细胞转移的器官中高表达。
趋化因子及其受体在其他肿瘤转移中作用已有许多报道,包括黑素瘤、非霍奇金B细胞淋巴瘤、卵巢癌、胰腺癌等。
乳腺癌细胞的CCL5产生与肿瘤进展相关,只有在良性乳腺疾病中发现的微小趋化因子表达。
CCL2表达水平也与乳腺癌进展和巨噬细胞积累相关。
大多数霍奇金病例的特征是复合趋化因子网络,其包括吸引Th2淋巴细胞如CCL17、CCL11、CCL22以及Th1吸引趋化因子CXCL10、CXCL9、CCL2、CCL3、CCL5和CXCL1。
腹水形成是人上皮性卵巢癌的常见发生。
在腹水细胞和腹水中发现CCL2、CCL3、CCL4、CCL5、CCL8和CCL22的纳摩尔水平的蛋白质。
趋化因子及其受体具有其广泛的细胞来源和生物学效应,在多种疾病的发生和发展中起着重要的作用。
人类肿瘤中的趋化因子网络是复杂的,其作用仅有部分被报道,仍有大量未知的信息需要来研究。
随着在对细胞因子及其受体研究的深入,可能会为治疗人类的某些疾病如动脉粥样硬化病变、自身免疫病、器官移植、HIV感染和肿瘤等开辟新的途径,为临床上治疗各种疾病开辟新景象。