《元素周期表》
- 格式:ppt
- 大小:2.68 MB
- 文档页数:70
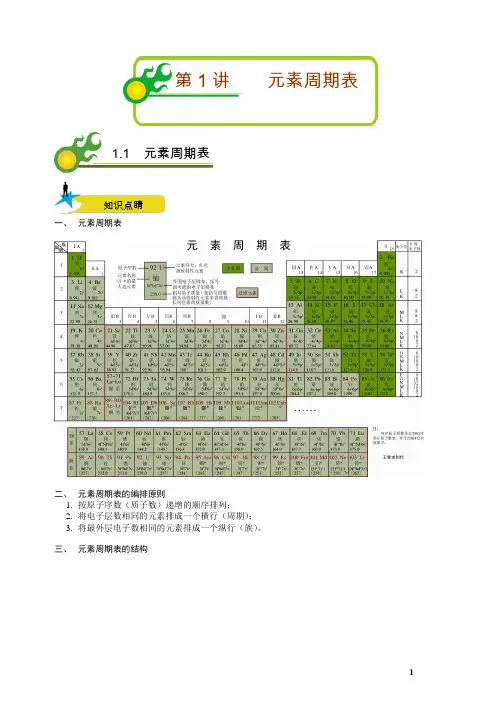
第1讲元素周期表1.1 元素周期表知识点睛一、元素周期表二、元素周期表的编排原则1.按原子序数(质子数)递增的顺序排列;2.将电子层数相同的元素排成一个横行(周期);3.将最外层电子数相同的元素排成一个纵行(族)。
三、元素周期表的结构⎧⎧⎧⎪⎪⎪⎨⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎨⎧⎪⎪⎪⎪⎪⎪⎪⎨⎪⎨⎪⎪⎪⎪⎪⎩⎩⎧⎪⎪⎨⎪⎪⎩⎩:2:8:8:18:18:32::IA ~VIIA 7:IIIB ~VIIB IB ~IIB 7VIII VIIB IB 第一周期种元素短周期第二周期种元素第三周期种元素周期第四周期种元素第五周期种元素长周期第六周期种元素第七周期未填满(又称不完全周期)主族共个主族副族、共个副族族第族:三个纵行,位于第族和第族之间零族:稀有气体⎪⎪⎪⎪⎪⎪⎪ 【总结】1.周期表中的相等关系 周期序数=电子层数主族族序数=最外层电子数=价电子数=最高正价数元素的原子序数=核电荷数=质子数=原子的核外电子数 2.元素周期表(记忆口诀):3.周期和族的表示方法(1)周期用大写数字直接表示即可,如:第四周期。
(2)主族:用罗马数字加A 表示,如:第IIA 族; 副族:用罗马数字加B 表示,如:第IVB 族。
4.由原子序数确定元素位置的规律记住每周期的元素的种数(2、8、8、18、18、32)以及稀有气体元素的原子序数(He 2、Ne 10、Ar 18、Kr 36、Xe 54、Rn 86),便于确定元素在元素周期表中的位置。
具体如下:①若比相应的稀有气体元素的原子序数多1或2,则应处在下周期的第IA 族或第IIA 族,如88号元素88862-=,则应在第七周期第IIA 族。
②若比相应的稀有气体元素少1~5时,则应处在同周期的第VIIA ~IIIA 族,如:84号元素84862-=-,则应在第六周期第VIA 族。
③若预测新元素,可与未发现的第七周期的稀有气体元素(118号元素)相比较,去推知它的位置; 如:114号元素1141184-=-,应在第七周期第IV A 族。

《元素周期表》教学设计《《元素周期表》教学设计》这是优秀的教学设计文章,希望可以对您的学习工作中带来帮助!学习主题介绍学习主题:元素周期表使用教材:人教版版高一年级必修化学2册第一章第一节教学内容:本节教学内容是元素周期表。
元素周期表是元素周期律的具体表现形式,是学习化学的重要工具。
本节的重难点是元素周期表的结构。
元素周期表在初中化学中已有简单介绍,学生已经知道了元素周期表的大体结构,但对元素与原子结构的关系还没有更深的理解。
因此,本节教学的主要目的在于帮助学生能够从原子结构的角度进一步认识元素周期表的实质,为学习元素周期律打下基础。
学习目标分析课程标准中与本学习主题相关的语句:1.知道元素、核素的涵义。
2.了解原子核外电子的排布。
3.能描述元素周期表的结构,知道金属、非金属在元素周期表中的位置及其性质的递变规律。
根据课程标准所设定的学习目标:知识与技能:1、了解元素周期表的结构以及周期、族的概念。
2、理解和掌握元素周期表的结构特征。
3、了解周期、主族序数和原子结构的关系。
过程与方法:1、通过对教材阅读,元素周期表解读,培养学生归纳、总结,形成规律的能力。
2、培养学生理解求知与探索“感性→理性→感性”的认知过程,培养学生分析问题、解决问题的能力。
情感态度价值观:1、通过学习,培养学生勤于观察,勤于总结思考的科学态度。
2、感受周期表的结构美,从周期表发展过程中体会科学的本质在于不断的探究。
核心素养目标:宏观辨识与微观探析:能通过观察、辨识一定条件下物质的形态及变化的宏观现象,初步掌握物质及其变化的分类方法,并能运用符号表征物质及其变化证据推理与模型认知:能初步学会收集各种证据,对物质的性质及其变化提出可能的假设;基于证据进行分析推理,证实或证伪假设学生特征分析学生是否对本课的学习内容有所了解?在初中化学和化学必修1中曾经出现过元素周期表,学生初步了解了周期表和有关原子结构的知识。
学习本课内容必须具备的知识掌握情况如何?元素周期表在初中化学中已有简单介绍,学生对原子结构和元素周期表都有初步了解,学生已经知道了元素周期表的大体结构,但对元素与原子结构的关系还没有更深的理解。


第一章物质结构元素周期表第一节 元素周期表一、周期表原子序数 = 核电荷数 = 质子数 = 核外电子数1、依据横行:电子层数相同元素按原子序数递增从左到右排列纵行:最外层电子数相同的元素按电子层数递增从上向下排列2、结构周期序数=核外电子层数主族序数=最外层电子数短周期(第 1、2、3 周期)周期:7 个(共七个横行)周期表长周期(第 4、5、6、7 周期)主族 7 个:ⅠA -ⅦA族:16 个(共 18 个纵行)副族 7 个:IB-ⅦB第Ⅷ族 1 个(3 个纵行)过渡元素零族(1 个)稀有气体元素二.元素的性质和原子结构(一)碱金属元素:1、原子结构 相似性:最外层电子数相同,都为 1 个递变性:从上到下,随着核电核数的增大,电子层数增多,原子半径增大2、物理性质的相似性和递变性:(1)相似性:银白色固体、硬度小、密度小(轻金属) 熔点低、易导热、导电、有展性。
(2)递变性(从锂到铯):①密度逐渐增大(K 反常)②熔点、沸点逐渐降低结论:碱金属原子结构的相似性和递变性,导致物理性质同样存在相似性和递变性。
3、化学性质(1)相似性:(金属锂只有一种氧化物)4Li + O 2 点燃 Li 2O2Na + O 2 点燃 Na 2O 22 Na + 2H 2O = 2NaOH + H 2↑2K + 2H 2O = 2KOH + H 2↑2R + 2 H 2O = 2 ROH + H 2 ↑产物中,碱金属元素的化合价都为+1价。
结论:碱金属元素原子的最外层上都只有 1 个电子,因此,它们的化学性质相似。
(2)递变性:①与氧气反应越来越容易②与水反应越来越剧烈结论:①金属性逐渐增强②原子结构的递变性导致化学性质的递变性。
总结:递变性:从上到下(从Li到Cs),随着核电核数的增加,碱金属原子的电子层数逐渐增多,原子核对最外层电子的引力逐渐减弱,原子失去电子的能力增强,即金属性逐渐增强。
所以从Li到Cs的金属性逐渐增强。






如何快速记忆《元素周期表》化学元素周期表
1-10:氢、氦、锂、铍、硼;碳、氮、氧、氟、氖。
11-20:钠、镁、铝、硅、磷;硫、氯、氩、钾、钙。
21-30:钪、钛、钒、铬、锰;铁、钴、镍、铜、锌。
31-40:镓、锗、砷、硒、溴;氪、铷、锶、钇、锆。
41-50:铌、钼、锝、钌、铑;钯、银、镉、铟、锡。
51-60:锑、碲、碘、氙、铯;钡、镧、铈、镨、钕。
61-70:钷、钐、铕、钆、铽;镝、钬、铒、铥、镱。
71-80:镥、铪、钽、钨、铼;锇、铱、铂、金、汞。
81-90:铊、铅、铋、钋、砹;氡、钫、镭、锕、钍。
91-100:镤、铀、镎、钚、镅;锔、锫、锎、锿、镄。
101-110:钔、锘、铹、(钅卢)、(钅杜);(钅喜)、(钅波)、(钅黑)、(钅麦)、(钅达)。
第一步:首先以元素1、11、21、31、41、51、61、71、81、91、101为目录,用歌曲的形象法背诵。
第二步:使用目录作为指南,按顺序背诵元素。
忽略那些你暂时没记住的确切单词。
记住之后,我们会在复习过程中解决。
第三步:用歌诀图像指引自己背诵。
在能顺利按顺序背下以后,拿纸默写。
要一次默完,不会写的字先跳过。
全部默写完
后,对照修改其中的错字。
如此最多默写3-5遍就能写对每一个字。
第四步:按顺序复习可以增加对各元素其他性质的记忆,如原子量、最外层电子数等。
一、教学目标:1. 知识与技能:(1)了解元素周期表的发现和发展历程;(2)掌握元素周期表的结构,能正确书写元素符号;(3)了解元素周期表中元素的分组和周期,能运用周期表进行元素推断。
2. 过程与方法:(1)通过观察、分析、归纳等方法,认识元素周期表的规律;(2)学会利用周期表查找元素信息,提高自主学习能力。
3. 情感态度与价值观:(1)培养学生对化学学科的兴趣,激发学生探索未知世界的欲望;(2)培养学生合作、交流、归纳等能力,提高学生的团队意识。
二、教学重点与难点:1. 教学重点:(1)元素周期表的结构及元素符号的书写;(2)元素周期表中元素的分组和周期的特点;(3)利用周期表进行元素推断的方法。
2. 教学难点:(1)元素符号的书写规则;(2)周期表中元素的分组和周期的理解与应用。
三、教学准备:1. 教师准备:(1)熟记元素周期表的结构和元素符号;(2)准备相关的历史资料,介绍元素周期表的发现和发展;(3)准备一些练习题,用于巩固所学知识。
2. 学生准备:(1)预习元素周期表相关内容;(2)了解元素周期表的发现和发展历程;(3)掌握元素符号的书写方法。
四、教学过程:1. 导入新课:(1)回顾元素周期表的发现和发展历程;(2)引导学生关注元素周期表的结构和元素符号。
2. 自主学习:(2)学生分组讨论,分析元素周期表中元素的分组和周期特点。
3. 课堂讲解:(1)讲解元素周期表的结构,强调元素符号的书写方法;(2)讲解元素周期表中元素的分组和周期特点,举例说明;(3)介绍利用周期表进行元素推断的方法。
4. 练习巩固:(1)学生完成课后练习题,巩固所学知识;(2)教师点评练习题,及时纠正错误。
五、课后作业:1. 复习元素周期表的结构和元素符号;3. 练习利用周期表进行元素推断。
六、教学拓展:1. 引导学生了解元素周期表在现实生活中的应用,如物质的制备、药物的研发等;2. 介绍一些与元素周期表相关的科学家故事,激发学生的科学兴趣;3. 探讨元素周期表的局限性,引导学生关注化学科学的不断发展。
元素周期表知识点一.元素周期表的结构1.世界上第一张元素周期表是在1869年由俄国化学家门捷列夫绘制完成的,随着科学的不断发展,已逐渐演变为现在的常用形式。
2.原子序数:按照元素在周期表中的顺序给元素编号,称之为原子序数,原子序数=核电荷数=质子数=核外电子数。
3.编排原则(1)周期:把电子层数相同的元素,按原子序数递增的顺序,从左至右排成的横行。
(2)族:把最外层电子数相同的元素,按电子层数递增的顺序,从上至下排成的纵行。
4.元素周期表的结构5.元素周期表中的特殊位置(1).分区①分界线:沿着元素周期表中铝、锗、锑、钋与硼、硅、砷、碲、砹的交界处画一条斜线,即为金属元素区和非金属元素区分界线(氢元素除外)。
②各区位置:分界线左面为金属元素区,分界线右面为非金属元素区。
③分界线附近元素的性质:既表现金属元素的性质,又表现非金属元素的性质。
(2).过渡元素:元素周期表中部从ⅢB族到ⅡB族10个纵列共六十多种元素,这些元素都是金属元素。
(3).镧系:元素周期表第六周期中,57号元素镧到71号元素镥共15种元素。
(4).锕系:元素周期表第七周期中,89号元素锕到103号元素铹共15种元素。
(5).超铀元素:在锕系元素中92号元素铀(U)以后的各种元素。
结构巧记口诀:横行叫周期,现有一至七,四长三个短,第七尚不满。
纵列称为族,共有十六族,一八依次现①,一零再一遍②。
一纵一个族,Ⅷ族搞特殊,三纵算一族,占去8、9、10。
镧系与锕系,蜗居不如意,十五挤着住,都属ⅢB族。
说明:①指ⅠA、ⅡA、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ;②指ⅠB、ⅡB、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、0。
知识点二.元素的性质与原子结构1 .碱金属元素:周期表中第IA族的元素(除H元素外)。
(1).碱金属的原子结构①.相同点:碱金属元素原子结构的最外层电子数相同,都为1。
②.递变性:从Li到Cs,碱金属元素的原子结构中,电子层数依次增多,原子半径依次增大。