元素周期律与元素周期表
- 格式:doc
- 大小:39.50 KB
- 文档页数:4




一.元素周期表1。
原子序数=核电荷数=核内质子数=核外电子数2.主族元素最外层电子数=主族序数3。
电子层数=周期序数4。
碱金属元素:密度逐渐增大,熔沸点逐渐变大,自上而下反应越来越剧烈银白色金属,密度小,熔沸点低,导电导热性强5.判断元素金属性强弱的方法:单质与水(酸)反应置换出氢的难易程度最高价氧化物的水化物(氢氧化物)的碱性强弱单质间的置换6。
卤族元素:密度逐渐增大,熔沸点逐渐升高与氢气反应剧烈程度越来越弱,生成氢化物稳定性渐弱7.判断元素非金属性强弱的方法:与氢气生成气态氢化物的难易程度以及氢化物的稳定性最高价氧化物的水化物的酸性单质间的置换8。
质量数:核内所有质子和中子的相对质量取近似整数相加9。
核素:具有一定数目质子和一定数目的中子的一种原子10。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素天然稳定存在的同位素,无论是游离态还是化合态各同位素所占的原子个数百分比一般是不变的在相同状况下,各同位素的化学性质基本相同(几乎完全一样),物理性质有所不同12。
原子相对原子质量=1个原子的质量/(1/12 C12的原子质量)13。
原子的近似相对原子质量=质量数14。
元素的相对原子质量=各同位素的相对原子质量的平均值=A·a%+B·b%…15.元素的近似相对原子质量=各同位素质量数的平均值=A·a%+B·b%…二.元素周期律1.K、L、M、N、O、P、Q(1,2,3,4,5,6,7,)层数越大,电子离核越远,其能量越高2.能量最低原理3.各电子层最多容纳电子数:2n^24.最外层不超过8,次外层18,倒数第三层325.原子半径:同周期主族元素,原子半径从左到右逐渐减小同主族元素,元素原子半径从上到下逐渐增大6.元素性质的周期性变化是元素原子的核外电子排布的周期性变化的结果(实质)7.同一周期元素,电子层数相同,从左到右,核电荷数增多,原子半径减小,失电子的能力逐渐减弱,得电子的能力逐渐增强8.同一主族,自上而下,元素的金属性逐渐增强,非金属性逐渐减弱,最外层电子数相同,电子层数增多,原子半径增大9.最高正价=最外层电子数最低负价=8—最外层电子数10.各周期元素种类:2,8,8,18,32,3211.稀有气体原子序数;2,10,18,36,54,8612.同族上下相邻的原子序数差:2,8,18,3213.同周期IIA族与IIIA族原子序数相差:1,1,11,11,2514.电子层数不同,原子序数(核电荷数)均不同时,电子层数越多,半径越大15.电子层数相同,原子序数(核电荷数)不同时,原子序数(核电荷数)越大,半径越小16.电子层数,原子序数(核电荷数)均相同时,核外电子数越多,半径越大17.电子排布相同的离子,离子半径随核电荷数递增而减小选修三.原子结构与性质1.原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s、p、d、f表示不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d 轨道和f轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7。

高中化学奥林匹克竞赛辅导元素周期表与元素周期律1.元素周期表的框架:2.元素周期表的分区:s区:包括第I、Ⅱ主族元素,价电子构型为ns1和ns2。
d区:包括第Ⅱ→Ⅱ副族和第Ⅱ族的元素,价电子构型一般为(n-1)d1~8ns2。
ds区:包括第I、Ⅱ副族元素,价电子构型为(n-1)d10ns1~2。
p区:包括第Ⅱ→Ⅱ主族和零族元素,价电子构型为ns2np1~6。
f区:包括镧系元素和锕系元素,价电子构型一般为(n-2)f1~14(n-1)d1~2ns2。
说明:(1)周期序数=原子的电子层数n。
第n周期含有元素的数目有以下规律:当n为偶数时,第n 周期含有元素的数目为(n+2)2/2;当n为奇数时,第n周期含有元素的数目为(n+1)2/2。
(2)主族元素的族序数=原子最外层电子数。
(3)对于d区元素,族序数=元素最高能级中的电子总数,如21Sc:[Ar]3d14s2是第Ⅱ B族,Mo:[Ar]3d64s2是第Ⅱ族。
26注意:如果元素最高能级组中的电子总数大于8,也属于第Ⅱ族,如Co、Ni等。
(4)对于ds区元素:族序数=原子最外层电子数,如29Cu:[Ar]3d104s1是第Ⅱ B族(5)d区和ds区元素均为副族元素,统称为过渡元素。
f区元素统称为内过渡元素。
3.元素周期律:原子半径、金属性、非金属性、电离能、电子亲合能、电负性。
4.原子半径:原子核的周围是电子云,它们是没有确定的边界的。
我们通常所说的原子半径是人为地规定的一种物理量。
原子半径可分为金属半径、共价半径、范德华半径三种。
共价半径是元素的两个原子以共价单键相连时,核间距离的一半。
稀有气体元素一般不能形成共价单键,所以用稀有气体分子晶体中两个原子距离的一半作为其半径,称为范德华半径。
范德华力不能像共价键一样将两个原子紧密结合,所以范德华半径大于共价半径,因此由于标准的不同,稀有气体的原子半径在同一周期的元素中半径是最大的。
金属单质的晶体中,相邻两金属原子核间距离的一半,称为该金属原子的金属半径。
元素周期律与元素周期表考纲要求:1.了解元素周期表的结构及其应用。
2.认识元素周期律的本质。
掌握同一周期、同一主族元素的原子结构与元素性质递变的关系。
3.掌握短周期和所有主族元素“位、构、性”关系的相互推导。
重点难点:元素周期律含义元素周期表结构元素“位、构、性”关系的相互推导学习内容:一、元素周期律:1、概念:元素的随着元素递增而呈的变化,这个规律叫元素周期律。
元素性质的周期性变化是元素原子的的周期性变化的必然结果,这就是元素周期律的实质。
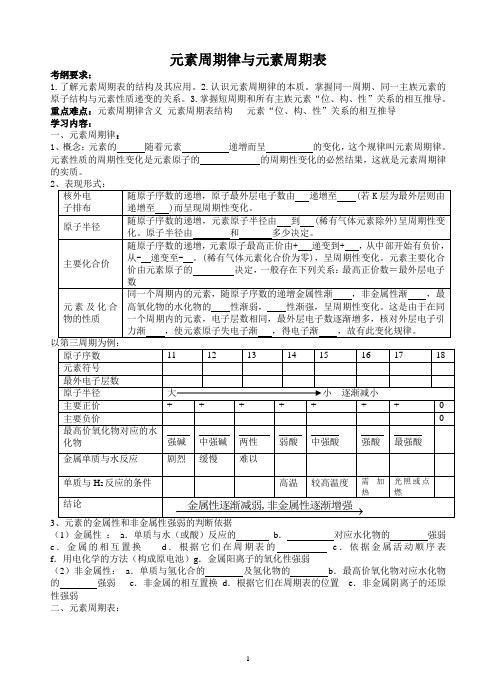
23(1)金属性:a.单质与水(或酸)反应的b.对应水化物的强弱c.金属的相互置换d.根据它们在周期表的e.依据金属活动顺序表f.用电化学的方法(构成原电池)g.金属阳离子的氧化性强弱(2)非金属性:a.单质与氢化合的及氢化物的b.最高价氧化物对应水化物的强弱c.非金属的相互置换d.根据它们在周期表的位置e.非金属阴离子的还原性强弱二、元素周期表:1、编排原则①按原子序数递增的顺序从 到 、从 到 编排。
②将电子层数相同的各种元素从 到 排成横行(周期),共有 横行③将最外层电子数相同的元素按电子层数递增的顺序从 到 排成纵行,共有 纵行。
2......................3、元素周期表与原子结构的关系原子序数= = = , 周期序数=电子层数主族序数= 数=元素的最高 数*|最高正价数|+|负价数|= 或 。
4、元素在周期表中的“位、构、性”关系:○1.同周期元素从左到右:随着 的递增, 原子半径 ,原子核对最外层电子的吸引力 ,得电子能力 ,元素的 性增强,失电子能力 ,元素的 性减弱。
具体表现在单质的 性增强, 性减弱;元素的最高价氧化物的水化物的 性增强, 性减弱;气态氢化物的 性增强。
○2.同主族元素从上到下:随着 的递增,原子半径 ,原子核对最外层电子 的吸引力 ,得电子能力 ,元素的 性增强,失电子能力 , 元素的 性减弱。
具体表现在单质的 性增强,性减弱;元素的最高价氧化物的水化物的 性增强, 性减弱;气态氢化物的 性 。


高考化学一轮复习:元素周期律和元素周期表知识点总结一、元素周期律1. 原子序数(1)含义:元素在元素周期表中的序号(2)与其他量的关系:原子序数=核电核数=质子数=核外电子数2. 元素周期律的含义元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着原子序数的递增而呈周期性变化的规律。
3. 元素性质的周期性变化实质是元素原子核外电子排布的周期性变化...................的必然结果。
二、元素周期表1. 元素周期表与元素周期律的关系:元素周期表是元素周期律的具体表现形式。
2. 元素周期表(1)编排原则:①按原子序数递增的顺序从左到右排列。
②周期:将电子层数相同..。
(周期序数=原子的电子层数)......的各元素从左到右排成一横行③族:把最外层电子数相同..。
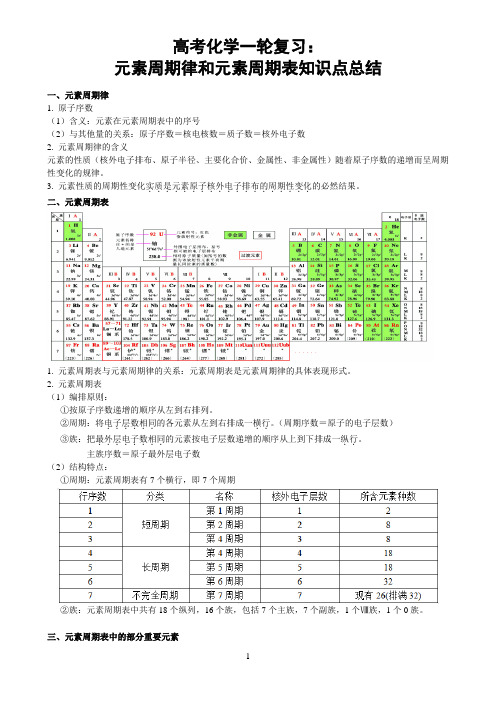
........的元素按电子层数递增的顺序从上到下排成一纵行主族序数=原子最外层电子数(2)结构特点:①周期:元素周期表有7个横行,即7个周期②族:元素周期表中共有18个纵列,16个族,包括7个主族,7个副族,1个Ⅷ族,1个0族。
三、元素周期表中的部分重要元素四、焰色反应1、Na 黄Li 紫红K 浅紫(透过蓝色钴玻璃观察,因为钾里面常混有钠,黄色掩盖了浅紫色)2、Rb 紫Ca 砖红色Sr 洋红Rb 紫Cu 绿Ba 黄绿Co 淡蓝五、微粒半径的大小与比较(1)一看“电子层数”:当电子层数不同时,电子层数越多,半径越大。
如:同一主族元素,电子层数越多,半径越大如:r(Cl)>r(F)、r(O2-)>r(S2-)、r(Na)>r(Na+)。
(2)二看“核电荷数”:当电子层数相同时,核电荷数越大,半径越小。
如:同一周期元素,电子层数相同时核电荷数越大,半径越小。
如r(Na)>r(Cl)、r(O2-)>r(F-)>r(Na+)。
(3)三看“核外电子数”:当电子层数和核电荷数均相同时,核外电子数越多,半径越大。
如:r(Cl-)>r(Cl) 、r(Fe2+)>r(Fe3+)。


元素周期律+元素周期表⼀、元素周期律数量关系:质⼦数 = 核电荷数 = 核外电⼦数 = 原⼦序数。
质量关系:质量数(A) = 质⼦数(Z) + 中⼦数(P)≈相对原⼦质量。
电量关系:核外电⼦数 = 质⼦数 ± 离⼦电荷数。
周期序数 = 核外电⼦层数 = 能级组序数。
主族序数 = 最外层电⼦数/价电⼦数/特征电⼦数 = 最⾼正价。
副族序数 = 最多可失去的电⼦数/价电⼦数/特征电⼦数。
元素周期律: 定义:元素性质随原⼦序数递增呈周期性变化的规律。
发现者:门捷列夫。
内容: ①原⼦半径:同周期从左到右,原⼦半径越来越⼩。
同主族从上到下,原⼦半径越来越⼤。
分类:共价半径、⾦属半径、范德华(Van Der Waals)半径。
共价半径: 定义:相邻两同种原⼦以共价单键相连时核间距的⼀半。
共价半径 < 真实半径。
⾦属半径: 定义:⾦属晶体中相邻两同种原⼦核间距的⼀半。
⾦属半径 = 真实半径。
范德华半径: 定义:相邻两同种原⼦以范德华⼒相连时核间距的⼀半。
范德华半径 > 真实半径。
适⽤范围:稀有⽓体。
②化合价:同周期从左到右,最⾼正价越来越⼤,最低负价越来越⼩。
同主族从上到下,最⾼正价和最低负价不变。
③第⼀电离能(势):同周期从左到右,第⼀电离能(势)越来越⼤,同主族从上到下,第⼀电离能(势)越来越⼩。
特例:铍 > 硼。
氮 >氧。
镁 > 铝。
磷 > 硫。
砷 > 硒。
定义:⽓态基态原⼦失去⼀个电⼦变为⽓态⼀价正离⼦时吸收的能量。
符号:I。
单位:国际单位(SI):焦(尔)每摩(尔)(J/mol)。
常⽤单位:千焦(尔)每摩(尔)(kJ/mol)。
第⼀电离能(势)越⼤,失电⼦能⼒越弱,得电⼦能⼒越强,⾦属性越弱,⾮⾦属性越强。
第⼀电离能(势)越⼩,失电⼦能⼒越强,得电⼦能⼒越弱,⾦属性越强,⾮⾦属性越弱。
④第⼀电⼦亲和能(势):同周期从左到右,第⼀电⼦亲合能(势)越来越⼤。

第2讲元素周期律与元素周期表一、原子核外电子的排布1.原子核外电子是分层排布的。
各电子层由内向外依次为1,2,3,4,5,6,7……,分别称为K,L,M,N,O,P,Q ……。
离核越远,电子能量越高。
2.排布规律:①由内层向外层排布——能量最低原理;②每一层最多排2n2(n表示电子层数);③最外层最多排8 ,次外层最多排 18 ,倒数第三层最多排 32 。
3.画出1~18号元素的原子结构示意图1 23 4 5 6 7 8 9 1011 12 13 14 15 16 1718二.元素周期律:1.概念:元素的性质随着核电荷数的递增而呈现周期性变化的规律。
2.本质:元素性质的周期性变化规律是元素原子最外层电子周期性变化的必然结果。
3.具体内容(1)原子核外最外层电子数呈现从1到8 的周期性变化;(2)原子半径呈现由大到小的周期性变化;①同周期,从左往右,原子半径依次减小;②同主族,从上往下,原子半径依次增大。
(3)元素最高正化合价呈现由+1到+7 ,最低负化合价呈现由-4 到-1 的周期性变化;主族元素最高正价=价电子数=最外层电子数(除O、F)。
|最高正价|+|最低负价|=8(除H、O、F)。
例1.短周期元素X的气态氢化物的化学式为H2X,X在周期表中所在的族是()A.ⅡA B.ⅣA C.ⅥA D.0【答案】C【解析】气态氢化物的化学式为H2X,则X为-2价,最外层电子数为6。
(4)元素的金属性呈现由强到弱,非金属性呈现由弱到强的周期性变化。
Na Mg Al Si P S Cl 金属性:Na>Mg>Al金属性逐渐减弱非金属性逐渐增强非金属性:Si<P<S<Cl4.判断元素的金属性、非金属性强弱:金属性越强,则:①原子半径越大;②单质还原性越强(即“强制弱”);③单质越容易从水或酸中置换出氢气;④元素最高价氧化物对应的水化物的碱性越强。
非金属性越强,则:①原子半径越小;②单质氧化性越强(即“强制弱”);③单质与氢气反应越剧烈,产物越稳定;④元素最高价氧化物对应的水化物的酸性越强。

元素周期律和元素周期表课题元素周期律和元素周期表教学过程知识点-元素周期律和与元素周期表重点提示教学内容【知识点】(一)元素周期表1.周期表的基本结构把电子层数目相同的各种元素,按原子序数递增的顺序从左到右排成横行,再把不同横行中最外层的电子数相同的元素,按电子层数递增的顺序又上而下排成纵行,元素这样排列得到的表就称为元素周期表。
2.周期概念:具有相同电子层数的元素按原子序数递增的顺序从左向右排列成一横行此行,即为周期。
现行元素周期表的横行共七行(如果加入最新发现的元素则有八行)前三行所含的元素种类较少,称为短周期;四、五、六三行所含的元素较多,称为长周期;第七行称为不完全周期(若采用最新的周期表,则第七行应为长周期,第八行为不完全周期)同一个周期的元素,其原子的电子层数相同,等于其周期序数。
短周期:第一周期:周期表中最短的周期,只有氢和氦两种元素。
结构特征是元素原子的电子层数均为一第二周期:包含了锂、铍、硼、碳、氮、氧、氟、氖八种元素,结构特征是元素原子的电子层数是二,同时,最外层电子数从1到8递增。
第三周期:包含了钠、镁、铝、硅、磷、硫、氯、氩八种元素,均为三电子层元素,最外层电子数也是从1到8递增长周期:长周期元素由于包含了副族元素,在结构上的递变性比较复杂,在此不做阐述,要注意的是,长周期中的主族元素依然存在递变性。
3.族概念:将最外层电子数相同的元素按电子层数递增的顺序从上到下顺序排成一纵列,此列即为族。
副族和第八族的设定与此规则略有差别。
周期表中共有十八列,分为十六族。
主族:所有包含短周期元素的列均为主族,在周期表中用罗马数字和A表示,稀有气体元素另外归类。
副族:所有不包含短周期元素的列(或只有长周期元素的列),除铁、钴、镍所在的列以外,均为副族,在周期表中用罗马数字和B表示零族:稀有气体元素所在的列是零族第八族:铁、钴、镍所在的三列合并为第八族,用罗马数字Ⅷ表示主族和主族元素:第一主族:包含了氢、锂、钠、钾、铷、铯、钫七种元素。

元素周期律和元素周期表知识点 1.元素周期表
横行:同一周期,电子层数相同,从左到右,原子序数递增 纵行:同一主族,最外层电子数相同,从上到下,原子序数递增
元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律 2.元素周期表的结构
粒子半径大小的比较
1.同周期元素的粒子
同周期元素的原子、最高价阳离子、最低价阴离子(稀有气体除外)的半径随核电荷数的增加而减小
2.同主族元素的粒子
同主族的原子和离子均随核电荷数的增大而逐渐增大
3.电子层结构相同的粒子
电子层结构相同,则核外电子排布相同,电子数相同,离子的半径随核电荷数的增加而减少
4.同种元素形成的粒子
电子数越多,半径越大
5.不同周期、不同主族的粒子,可通过选一种参照物进行比较。
苏教版必修(II)《核外电子排布与周期律》的教学情境设计
湖州中学皇甫莹
一、核心问题
1.元素周期律的含义和实质
2.元素周期表的基本结构
3.同一主族、同一周期元素的性质递变规律
二、教学思路
总的思路是通过复习原子结构及元素周期表的相关知识引入新知识的学习,然后设置问题引导学生进一步探究原子结构与元素周期表的关系,再结合教材中的“科学探究”引导学生进行问题探究,最后在学生讨论交流的基础上,总结归纳元素的外围电子排布的特征与元素周期表结构的关系。
根据新课标的要求,笔者在教学的过程中采用探究法,坚持以人为本的宗旨,注重对学生进行科学方法的训练和科学思维的培养,提高学生的逻辑推理能力以及分析问题、解决问题、总结规律的能力。
三、教材分析
元素周期律涉及的知识点有:①原子结构;②元素性质的递变规律;③元素周期律的应用。
笔者认为②③两部分内容值得探究,其原因是:学生学习了金属Na、Mg、Al、Fe、Cu 等性质和非金属元素Cl、S、N等性质的知识后,有自己的思维基础,并有关于物质共性与个性的知识体验。
有了这样的知识体验,自然就需要有一个规律加以升华,自然就会对元素周期律有一个想认识的欲望。
元素周期律的知识也正是在元素及其化合物的基础上建构起来的,对于这样关于元素及其化合物的规律问题就有探究的价值。
四、情境设计
评注:教师组织学生讨论这些问题,从而发现规律,得出结论。
并指出,可以推广到质子数大于18的元素,从而揭示核外电子排布规律的普遍性。
评注:训练学生的实验探究能力,培养学生分析问题的能力。
情境3 元素的非金属性的周期性变化规律
评注:训练学生的实验探究能力,培养学生分析问题的能力。
情境4 同主族元素性质的递变规律
评注:训练学生“分析-推论-结论”的方法,揭示周期律的普遍性
五、反思提炼
提出有价值、高质量问题是问题探讨的核心,怎样提出有价值、高质量问题呢?首先要将学生的元认知激活,温故知新,注意与新知识的相关基础知识提问引入。
其次,要在细节处进行深入的问题探讨。
通过细节把握整体,这是有价值、高质量问题的共性。
提出有价值、高质量的问题,必须明确:追问是问题探讨的基础与起点,通过它发现问题;细节关注是其支点,通过它梳理问题。
这两个方面共同作用,使问题探讨的课堂生机盎然,精彩纷呈。
一节课的好坏不是看教师知识教授得怎样,而是要看学生是否学习到了一定的知识、能力、方法,并能通过学习形成学生的情感态度与价值观。
一个有效的教学,不一定非得探究,但要做到教得有效,学得快乐,考得自在与满意。
六、教学资源链接
1.元素周期律和元素周期表的重要意义
(1)在哲学方面:元素周期律揭示了元素原子核电荷数递增引起元素性质发生周期性变化的事实,有力的论证了事物变化的量变引起质变的规律性。
通过元素周期律和周期表的学习,可以加深对物质世界对立统一规律的认识。
(2)在自然科学方面:周期表为发展物质结构理论提供了客观依据。
元素周期表和元素周期律在自然科学的许多部门,首先是化学、物理学、生物学、地球化学等方面,都是重要工具。
(3)在生产中的某些应用:由于在周期表中位置靠近的元素性质相似,这就启发人们在周期表中一定的区域内寻找新的物质。
比如说农药的制造,半导体材料的寻找,催化剂的选择,耐高温、耐腐蚀特种合金材料的制取,矿物的寻找等等。
2.元素周期表的重点在哪里
1869年俄国科学家门捷列夫将当时已经发现的63种元素列成元素周期表,并留下一些空格,预示着这些元素的存在。
在元素周期表的指导下,人们“按因索骥”找出了这些元素。
元素的种类到底是否有限?周期表是否有终点?
20世纪30—40年代,人们发现了92号元素,就有人提出92号是否是周期表的最后一种元素。
然而从1937年起,人们用人工合成法在近50年时间又合成近20种元素,元素周期表的尾巴增长了。
这时又有人预言,105号元素该是周期表的尽头了,其理由是核电荷越来越大,核内质子数也越来越大,质子间的排斥力将远远超过核子间作用力,导致它发生蜕
变,然而不久,又陆续合成了106—109号元素。
这些元素存在的时间很短,照此推算元素周期表是否到尽头了?
1969年起,理论物理学家从理论上探索“超重元素”存在的可能性,他们认为具有2,8,14,28,50,82,114,126,184等这些“幻数”的质子和中子,其原子核比较稳定,这大批元素,这样,第七周期32号元素将会憋填满,第八周期也将填满(按理论计算可,第八周期元素共50种,其中7种主族元素,1种惰性元素,10种过渡元素或副族元素,还有32种超锕系元素,列在元素周期表锕系元素的下方)。
更为有趣的是,有些科学家还提出元素周期表可以向负方向发展,这是由于科学上发现了正电子、负电子(反质子),在其他星球上是否存在由这些反质子和正电子以及中子组成的反原子呢?这种观点若有一朝被实践证实,元素周期表当然可以出现核电荷数为负数的反元素,向负向发展也就顺理成章了。
参考文献:
1 王祖浩:《化学2(必修)》,江苏教育出版社
2 王祖浩:《高中化学新教材教学情境设计》,江苏教育出版社
3 郑长龙:《关于科学探究教学若干问题的思考》,化学教育,2006年第8期
4 盛群力:《教学设计》,浙江教育出版社2004年版。