元素周期表元素周期率
- 格式:ppt
- 大小:970.00 KB
- 文档页数:34

一.元素周期表1.原子序数=核电荷数=核内质子数=核外电子数2.主族元素最外层电子数=主族序数3.电子层数=周期序数4.碱金属元素:密度逐渐增大,熔沸点逐渐变大,自上而下反应越来越剧烈银白色金属,密度小,熔沸点低,导电导热性强5.判断元素金属性强弱的方法:单质与水(酸)反应置换出氢的难易程度最高价氧化物的水化物(氢氧化物)的碱性强弱单质间的置换6.卤族元素:密度逐渐增大,熔沸点逐渐升高与氢气反应剧烈程度越来越弱,生成氢化物稳定性渐弱7.判断元素非金属性强弱的方法:与氢气生成气态氢化物的难易程度以及氢化物的稳定性最高价氧化物的水化物的酸性单质间的置换8.质量数:核内所有质子和中子的相对质量取近似整数相加9.核素:具有一定数目质子和一定数目的中子的一种原子10.同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素天然稳定存在的同位素,无论是游离态还是化合态各同位素所占的原子个数百分比一般是不变的在相同状况下,各同位素的化学性质基本相同(几乎完全一样),物理性质有所不同12.原子相对原子质量=1个原子的质量/(1/12 C12的原子质量)13.原子的近似相对原子质量=质量数14.元素的相对原子质量=各同位素的相对原子质量的平均值= A·a%+B·b%…15.元素的近似相对原子质量=各同位素质量数的平均值= A·a%+B·b%…二.元素周期律1.K、L、M、N、O、P、Q(1,2,3,4,5,6,7,)层数越大,电子离核越远,其能量越高2.能量最低原理3.各电子层最多容纳电子数:2n^24.最外层不超过8,次外层18,倒数第三层325.原子半径:同周期主族元素,原子半径从左到右逐渐减小同主族元素,元素原子半径从上到下逐渐增大6.元素性质的周期性变化是元素原子的核外电子排布的周期性变化的结果(实质)7.同一周期元素,电子层数相同,从左到右,核电荷数增多,原子半径减小,失电子的能力逐渐减弱,得电子的能力逐渐增强8.同一主族,自上而下,元素的金属性逐渐增强,非金属性逐渐减弱,最外层电子数相同,电子层数增多,原子半径增大9.最高正价=最外层电子数最低负价=8—最外层电子数10.各周期元素种类:2,8,8,18,32,3211.稀有气体原子序数;2,10,18,36,54,8612.同族上下相邻的原子序数差:2,8,18,3213.同周期IIA族与IIIA族原子序数相差:1,1,11,11,2514.电子层数不同,原子序数(核电荷数)均不同时,电子层数越多,半径越大15.电子层数相同,原子序数(核电荷数)不同时,原子序数(核电荷数)越大,半径越小16.电子层数,原子序数(核电荷数)均相同时,核外电子数越多,半径越大17.电子排布相同的离子,离子半径随核电荷数递增而减小选修三.原子结构与性质1.原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s、p、d、f表示不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7.2.电子云:用小黑点的疏密来描述电子在原子核外空间出现的机会大小所得的图形叫电子云图.离核越近,电子出现的机会大,电子云密度越大;离核越远,电子出现的机会小,电子云密度越小.3.原子核外电子排布原理.①.能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道.②.泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子.③.洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同.4.洪特规则的特例:对于一个能级,当电子排布为充满、半充满或全空时,是比较稳定的5.元素电离能:第一电离能:气态电中性基态原子失去1个电子,转化为气态基态正离子所需要的能量叫做第一电离能。



高中化学元素周期律知识点总结-CAL-FENGHAI.-(YICAI)-Company One1第一节课时1元素周期表的结构一、元素周期表的发展历程二、现行元素周期表的编排与结构1.原子序数(1)含义:按照元素在元素周期表中的顺序给元素编号,得到原子序数。
(2)原子序数与原子结构的关系原子序数=核电荷数=质子数=核外电子数。
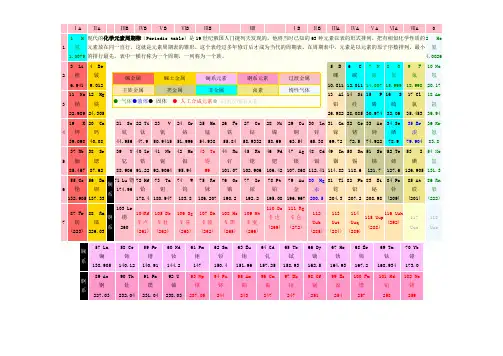
2.元素周期表的编排原则(1)原子核外电子层数目相同的元素,按原子序数递增的顺序从左到右排成横行,称为周期。
(2)原子核外最外层电子数相同的元素,按电子层数递增的顺序由上而下排成纵行,称为族。
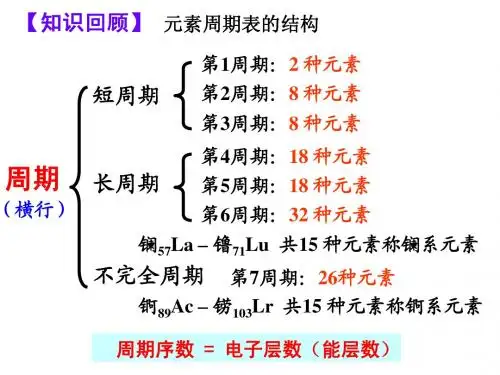
3.元素周期表的结构(1)周期(横行)①个数:元素周期表中有7个周期。
②特点:每一周期中元素的电子层数相同。
③分类(3短4长)短周期:包括第一、二、三周期(3短)。
长周期:包括第四、五、六、七周期(4长)。
(2)族(纵行)①个数:元素周期表中有18个纵行,但只有16个族。
②特点:元素周期表中主族元素的族序数等于其最外层电子数。
③分类④常见族的特别名称 第ⅠA 族(除H):碱金属元素;第ⅦA 族:卤族元素;0族:稀有气体元素;ⅣA 族:碳族元素;ⅥA 族:氧族元素。
课时2 元素的性质与原子结构一、碱金属元素——锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr) 1.原子结构(1)相似性:最外层电子数都是__1__。
(2)递变性:Li ―→Cs ,核电荷数增加,电子层数增多,原子半径增大。
2.碱金属单质的物理性质3.碱金属元素单质化学性质的相似性和递变性 (1)相似性(用R 表示碱金属元素)单质R —⎩⎪⎨⎪⎧与非金属单质反应:如Cl 2+2R===2RCl 与水反应:如2R +2H 2O===2ROH +H 2↑与酸溶液反应:如2R +2H +===2R ++H 2↑化合物:最高价氧化物对应水化物的化学式为ROH ,且均呈碱性。
(2)递变性具体表现如下(按从Li→Cs 的顺序)①与O 2的反应越来越剧烈,产物越来越复杂,如Li 与O 2反应只能生成Li 2O ,Na 与O 2反应还可以生成Na 2O 2,而K 与O 2反应能够生成KO 2等。



元素周期表与周期律知识总结知识结构图:一·周期表结构二·“位,构,性”的相互推导元素周期律三·原子结构四·碱金属五·卤素一.周期表结构1.元素周期表注意:A元素周期表的上界②金属与非金属的边界线B元素周期表中几个量的关系:(1)原子序数=核电荷数=质子数=核外电子数(2)周期序数=核外电子层数(3)主族序数=最外层电子数=元素的最高正价数(F无正价,O一般也无正价)(4)非金属元素:|最高正价数|+|负价数|=8C主族元素化合价(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);(2)同一主族的元素的最高正价、负价均相同(3)主族元素的最高正价和+最低负价的绝对值=82. 推断元素位置的规律判断元素在周期表中位置应牢记的规律:(1)元素周期数等于核外电子层数;(2)主族元素的序数等于最外层电子数;(3)确定族数应先确定是主族还是副族,其方法是采用原子序数逐步减去各周期的元素种数,即可由最后的差数来确定。
最后的差数就是族序数,差为8、9、10时为VIII族,差数大于10时,则再减去10,最后结果为族序数。
3推算元素的原子序数的简便方法同一主族相邻两元素原子序数差值(上周期的元素种类数)同一周期相邻两主族元素的原子序数差值4.每个周期元素的总数和每个周期过渡元素的总数二.“位、构、性”的相互推导失电子能力↓⇒金属性↑1.结构与性质 原子半径↑⇒F↓得电子能力↓⇒非金属性↓(1)原子核对最外层电子的引力核电核数↓ ⇒F↓半径↓ 半径↑ (主)同周期 F↓ 同主族 F↓ 质子数↑ 质子数↓(次)2.位置与结构(1) 周期数=电子数主族序数=3位置与性质①、核外电子排布②、原子半径性质递变 ③、主要化合价④、金属性与非金属性⑤、气态氢化物的稳定性⑥、最高价氧化物的水化物酸碱性电子层数 相同条件下,电子层越多,半径越大。

元素周期律(表)(总5页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--1、元素的金属性和非金属性与元素在周期表中位置的关系 1、元素的金属性和非金属性与元素在周期表中位置的关系 (1)性质比较:相同点:最外层电子数: 原子半径: 周 不同点: 失电子能力:期 (左—右) 金属性:得电子能力:非金属性:相同点:同 电子层数: 一原子半径:主 不同点:失电子能力:族 (上—下) 金属性:得电子能力:非金属性:应水化物的酸碱性单质的熔点变化金属单质的熔点递增非金属单质的熔点递减熔点最低的是各周期的惰性元素金属单质的熔点递减非金属单质的熔点递增元素周期表中主族元素性质的周期性递变规律结论:原子结构与元素在周期表中的位置的关系1、原子核外电子层数== 周期序数2、主族元素的最外层电子数==族序数==主族元素最高正价(O、F 除外)3、原子核外电子数==原子序数==质子数==核电荷数4、主族元素最高正价+ |最低负价|==8三、核素、同位素1、核素:具有一定数目的质子和一定数目的中子的一种原子叫核素如:11H、21H、31H各为一种核素2、同位素:具有相同质子数和不同中子数的原子互称为同位素如:氧元素有168O、178O、188O三种同位素3、同位素的特性:(1)同一元素的各种同位素虽然质量数不同,但它们的化学性质基本相同(2)在天然存在的某种元素里,不论是游离态还是化合态,各种同位素所占的原子百分比一般是不变的。
四、相对质量1、原子的相对原子质量:指一种原子的实际质量与126C的实际质量的1/12的比值,也称同位素的相对原子质量。
2、元素的相对原子质量:指某元素各同位素的相对原子质量与该同位素原子所占的原子个数百分比的乘积之和。
=M1·a% + M2·b% +……3、元素的近似相对原子质量:是用同位素的质量数及其所占的原子个数比计算出来的平均值。
元素周期律+元素周期表⼀、元素周期律数量关系:质⼦数 = 核电荷数 = 核外电⼦数 = 原⼦序数。
质量关系:质量数(A) = 质⼦数(Z) + 中⼦数(P)≈相对原⼦质量。
电量关系:核外电⼦数 = 质⼦数 ± 离⼦电荷数。
周期序数 = 核外电⼦层数 = 能级组序数。
主族序数 = 最外层电⼦数/价电⼦数/特征电⼦数 = 最⾼正价。
副族序数 = 最多可失去的电⼦数/价电⼦数/特征电⼦数。
元素周期律: 定义:元素性质随原⼦序数递增呈周期性变化的规律。
发现者:门捷列夫。
内容: ①原⼦半径:同周期从左到右,原⼦半径越来越⼩。
同主族从上到下,原⼦半径越来越⼤。
分类:共价半径、⾦属半径、范德华(Van Der Waals)半径。
共价半径: 定义:相邻两同种原⼦以共价单键相连时核间距的⼀半。
共价半径 < 真实半径。
⾦属半径: 定义:⾦属晶体中相邻两同种原⼦核间距的⼀半。
⾦属半径 = 真实半径。
范德华半径: 定义:相邻两同种原⼦以范德华⼒相连时核间距的⼀半。
范德华半径 > 真实半径。
适⽤范围:稀有⽓体。
②化合价:同周期从左到右,最⾼正价越来越⼤,最低负价越来越⼩。
同主族从上到下,最⾼正价和最低负价不变。
③第⼀电离能(势):同周期从左到右,第⼀电离能(势)越来越⼤,同主族从上到下,第⼀电离能(势)越来越⼩。
特例:铍 > 硼。
氮 >氧。
镁 > 铝。
磷 > 硫。
砷 > 硒。
定义:⽓态基态原⼦失去⼀个电⼦变为⽓态⼀价正离⼦时吸收的能量。
符号:I。
单位:国际单位(SI):焦(尔)每摩(尔)(J/mol)。
常⽤单位:千焦(尔)每摩(尔)(kJ/mol)。
第⼀电离能(势)越⼤,失电⼦能⼒越弱,得电⼦能⼒越强,⾦属性越弱,⾮⾦属性越强。
第⼀电离能(势)越⼩,失电⼦能⼒越强,得电⼦能⼒越弱,⾦属性越强,⾮⾦属性越弱。
④第⼀电⼦亲和能(势):同周期从左到右,第⼀电⼦亲合能(势)越来越⼤。
元素周期律和元素周期表知识点 1.元素周期表
横行:同一周期,电子层数相同,从左到右,原子序数递增 纵行:同一主族,最外层电子数相同,从上到下,原子序数递增
元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律 2.元素周期表的结构
粒子半径大小的比较
1.同周期元素的粒子
同周期元素的原子、最高价阳离子、最低价阴离子(稀有气体除外)的半径随核电荷数的增加而减小
2.同主族元素的粒子
同主族的原子和离子均随核电荷数的增大而逐渐增大
3.电子层结构相同的粒子
电子层结构相同,则核外电子排布相同,电子数相同,离子的半径随核电荷数的增加而减少
4.同种元素形成的粒子
电子数越多,半径越大
5.不同周期、不同主族的粒子,可通过选一种参照物进行比较。