化学反应工程第四章答案
- 格式:doc
- 大小:589.50 KB
- 文档页数:18

目 录第一章习题 ............................................................... 错误!未定义书签。
第二章习题 ............................................................... 错误!未定义书签。
第三章习题 ............................................................... 错误!未定义书签。
第四章习题 ............................................................... 错误!未定义书签。
第五章习题 ............................................................... 错误!未定义书签。
第六章习题 ............................................................... 错误!未定义书签。
第七章习题 ............................................................... 错误!未定义书签。
第八章习题 ............................................................... 错误!未定义书签。
第一章习题1 化学反应式与化学计量方程有何异同?化学反应式中计量系数与化学计量方程中的计量系数有何关系?答:化学反应式中计量系数恒为正值,化学计量方程中反应物的计量系数与化学反应式中数值相同,符号相反,对于产物二者相同。
2 何谓基元反应?基元反应的动力学方程中活化能与反应级数的含义是什么?何谓非基元反应?非基元反应的动力学方程中活化能与反应级数含义是什么?答:如果反应物严格按照化学反应式一步直接转化生成产物,该反应是基元反应。



4-1 在定态操作反应器的进口物料中脉冲注入示踪物料。
出口处示踪物浓度随时间变化的情况如下。
假设在该过程中物料的密度不发生变化,试求物料的平均停留时间与=100⎰∞=-=-=02222971.8187.625.47)(t dt t E t tσmin 24-2 无量纲方差表达式的推导 (1)推导无量纲方差222/ttσσθ=;(2)推导CSTR 的22tt=σ。
1. τθt=2. ττtet E -=1)(证明: 4-3 设()θF 及()θE 分别为闭式流动反应器的停留时间分布函数及停留时间分布密度函数,θ为对此停留时间。
(1)若该反应器为平推流反应器,试求①F(1); ②E(1);③F(0.8);④E(0.8);⑤F(1.2) (2)若该反应器为全混流反应器,试求①F(1); ②E(1);③F(0.8);④E(0.8);⑤F(1.2) (3)若该反应器为非理想流动反应器,试求 ①F(∞); ②F(0);③E(∞);④E(0);⑤⎰∞0)(θθd E ;⑥⎰∞)(θθθd E解1平推流模型 2 全混流θθ-=e E )( , θθ--=e F 1)(3非理想流动模型a 多釜串联 θθθN N N e N N E ---=1)!1()(, 0)(C C F N =θ4-4 C(t)t/min4-18图用阶跃法测定某一闭式流动反应器的停留时间分布,得到离开反应器的示踪剂浓度与时间的关系,如图4-18所示。
试求 (1)该反应器的停留时间分布函数)(θF 及分布密度函数)(θE ;(2)数学期望θ 及方差2θσ;(3)若用多釜串联模型来模拟该反应器,则模型参数是多少? (4)若用轴向扩散模型来模拟该反应器,则模型参数是多少?(5)若在此反应器内进行1级不可逆反应,反应速率常数1min 1-=k ,且无副反应,试求反应器出口转化率。
解(1).()()θF c t c t F ==0)(⎪⎩⎪⎨⎧-=12)(t t c 3322〉≤≤≤t t t()⎪⎩⎪⎨⎧-==∴120)(0t c t c t F 3322〉≤≤≤t t t ,()θF t F =)(⎪⎩⎪⎨⎧=∆∆=010)(0t c c t E3322〉≤≤≤t t t ,()t t E E =)(θ(2).1==-ttθ(3). 多釜串联模型 (4). 轴向扩散模型 试差 Pe=0.001 (5).4-5. 为了测定某一闭式流动反应器的停留时间分布,采用脉冲输入法,反应(1)反应物料在该反应器中的平均停留时间t 及方差2θσ(2)停留时间小于4.0min 的物料所占的分率。

《化学反应工程》第三版(陈甘堂著)课后习题答案第二章均相反应动力学基础2-4三级气相反应2NO+O22NO2,在30℃及1kgf/cm2下反应,已知反应速率常数2kC=2.65×104L2/(mol2 s),若以rA=kppApB表示,反应速率常数kp应为何值?解:原速率方程rA=dcA2cB=2.65×104cAdt由气体状态方程有cA=代入式(1)2-5考虑反应A课所以kp=2.65×104×(0.08477×303) 3=1.564后当压力单位为kgf/cm2时,R=0.08477,T=303K。
答p p 2rA=2.65×10 A B =2.65×104(RT) 3pApBRT RTp表示的动力学方程。
解:.因,wwnAp=A,微分得RTVdaw案24网pAp,cB=BRTRT3P,其动力学方程为( rA)=dnAn=kA。
试推导:在恒容下以总压VdtVδA=3 1=21dnA1dpA=VdtRTdt代入原动力学方程整理得wdpA=kpAdt设初始原料为纯A,yA0=1,总量为n0=nA0。
反应过程中总摩尔数根据膨胀因子定义δA=n n0nA0 nA若侵犯了您的版权利益,敬请来信通知我们!Y http://.cn.co(1)mol/[L s (kgf/cm2) 3]m(1)则nA=nA01(n n0)δA1(P P0)δA(2)恒容下上式可转换为pA=P0所以将式(2)和式(3)代入式(1)整理得2-6在700℃及3kgf/cm2恒压下发生下列反应:C4H10发生变化,试求下列各项的变化速率。
(1)乙烯分压;(2)H2的物质的量,mol;(3)丁烷的摩尔分数。
解:P=3kgf/cm2,(1)课MC4H10=58,(2)w.krC2H4=2( rC4H10)=2×2.4=4.8kgf/(cm2 s)PC4H10=PyC4H101 dpC4H10= P dt2.4-1==0.8 s 3w(3)nC4H10=nyC4H10=n0(1+δC4H10yC4H10,0xC4H10)yC4H10dnH2dtdnH2dt=hdaw后n0=nC4H10,0=δC4H10rC4H10=反应开始时,系统中含C4H*****kg,当反应完成50%时,丁烷分压以2.4kgf/(cm2 s)的速率dyC4H10dt答1rCH=2.4224wdnC4H10dt案116×1000=2000mol582+1 1==21网dyC4H10=n0(1+δC4H10yC4H10,0xC4H10) dt=2000×(1+2×1×0.5)×0.8=3200 mol/s若侵犯了您的版权利益,敬请来信通知我们!Y http://.cno2C2H4+H2,dP=k[(δA+1)P0 P]=k(3P0 P)dtm(3)dpA1dP= dtδAdt2-9反应APS,( r1)=k1cA , ( r2)=k2cp,已知t=0时,cA=cA0 ,cp0=cS0=0, k1/k2=0.2。

第二章 均向反应动力学1.在473K 等温及常压下进行气相反应:(1)3→A R 1.5R A r C = (2)2→A S0.5S Ar C =(3)→A T 2.1TA r C= 式中C A 为反应物A 的浓度(kmol/l ),原料中A 和惰性气体各为一半(体积比),试求当A 的转化率达85%时,其转化速率是多少?解:先求出总摩尔变化数δA ,首先将产物的生成速率变为对应的反应物的转化速率:10.53AR R A r r C ==10.252AS S A r r C == 2.1AT T A r r C== 总反应速率为: 2.85A AR AS AT AR r r r C =++= 以一摩尔反应物A 为基准,总摩尔变化数为:0.50.25 2.13210.4392.85 2.85 2.85A δ=⨯+⨯+-=初始浓度为:200030.10130.5 1.28810/8.31410473A A P y C kmol l RT --⨯===⨯⨯⨯则有:2300(1) 1.288100.151.62810/110.50.4390.85A A A A A A C X C kmol ly X δ---⨯⨯===⨯++⨯⨯332.85 2.85 1.62810 4.64010/(.min)A A R C kmol l --==⨯⨯=⨯2.可逆一级液相反应PA −−←−→−,已知0,m kmol 5.0P030=⋅=-c c A ;当此反应在间歇反应器中进行,经过8min 后,A 的转化率为33.3%,而平衡转化率是66.7%,求此反应的动力学方程式。
解:()()x c k x c k txc t c x c c x c c c c k c k c k c k tc r A02A01A0A A0P A0A A A02A 1P 2A 1AA 1d d d d )1(d d --==-=-=--=-=-=-⎩⎨⎧=====+-+-=xx t t x t txk k k xx k k k tx,0,0d )(d )(d d 2112118333.022667.01667.01)1()(ln 121e e e 0A e 0A Ae Pe 21121121=====-=-=-====+-+-t x k k K x x x c x c c c k k K t k xk k k k k ()PA A A 1211212121212102888.005776.0d d min02888.0min 05776.02/08664.086931.05.0ln 18333.02111ln 1c c tcr k k k k k k k k k k k k -=-=-⎩⎨⎧==⎩⎨⎧==+=+=+-=⎪⎪⎭⎫ ⎝⎛⨯⎪⎭⎫ ⎝⎛+-+--- 3.液相自催化反应的动力学方程A+P-P+P 速率表达式00()/(.) c 0.95/ c 0.05/AA A P A P dc r kc c mol l h mol L mol L dt -=-===,1h 后测得速率最大值,求反应速率常数。

化学反应工程知到章节测试答案智慧树2023年最新天津大学第一章测试1.碳球在空气中燃烧生成二氧化碳,初始的碳和氧气的摩尔比为1:2,初始的碳球直径为5mm,随着反应的进行,碳球直径变为1mm。
请问此时气相的总摩尔数是:参考答案:不变的2.碳球在空气中燃烧生成一氧化碳,初始的碳和氧气的摩尔比为1:1,初始的碳球直径为5mm,随着反应的进行,碳球直径变为1mm。
请问此时气相的总摩尔数是:参考答案:增加的3.碳球在空气中燃烧生成二氧化碳,初始的碳和氧气的摩尔比为1:1,初始的碳球直径为5mm,随着反应的进行,碳球直径变为1mm。
请问此时碳的转化率与氧气的转化率:参考答案:相等4.碳球在空气中燃烧生成一氧化碳,初始的碳和氧气的摩尔比为1:0.5,初始的碳球直径为5mm,随着反应的进行,碳球直径变为1mm。
请问此时碳的转化率与氧气的转化率:参考答案:相等5.碳球在空气中燃烧首先生成一氧化碳,随后深度氧化成二氧化碳,初始的碳和氧气的摩尔比为1:1,初始的碳球直径为5mm,随着反应的进行,碳球直径变为1mm。
两步反应的反应进度:参考答案:只有当两种碳氧化物的生成量相同时才相等;两步反应有各自的反应进度第二章测试1.反应速率定量描述了反应器中某一点的反应快慢。
参考答案:对2.当多个反应同时发生时,只有一个相对反应速率,即。
参考答案:错误;各步反应有各自的相对反应速率3.非基元反应的化学计量系数可以同时乘或除以非零的数,基元反应也同样。
参考答案:仅对非基元反应的描述正确;错误;仅对基元反应的描述错误4.对气相反应因其总摩尔数发生变化,所以CO2的浓度由下式计算:参考答案:错误5.反应速率方程中的摩尔浓度可以替换成摩尔数或反应体积。
参考答案:错第三章测试1.参考答案:2.参考答案:越小3.判断正误:在间歇釜式反应器中进行的反应,达到一定转化率所需反应时间与反应原料的初始浓度无关。
()参考答案:错4.在绝热的理想连续釜式反应器中进行某放热反应,关于反应器中温度分布描述正确的是()参考答案:反应温度高于进料温度;反应釜内的温度均一5.C点;A点第四章测试1.参考答案:1台PFR2.判断正误:相同的原料及温度条件下,在由两台反应体积均为1m3的串联活塞反应器(工况1)和一台反应体积为2 m3的活塞流反应器(工况2)中,分别进行反应A→P。


化学工程基础第四章作业答案第四章化学反应工程的基本原理4-2 在一定条件下,SO2催化制取SO3的反应式为已知反应器入口处SO2的浓度是7.15(摩尔分数,下同),出口物料中含SO2 0.48, 求SO2的转化率。
解∵∴4-3 已知700℃、3´105Pa(绝压)下的反应C4H10 → 2C2H4 H2 (A)(B)反应开始时C4H10为116kg。
求当反应完成50时,cA、pA、yA、cB各为多少解依题意yA,0 1,xA 50 cA,0 37.09kmol·m-3 cA 9.27 kmol·m-3 pA 7.5 ´ 104Pa yA 0.25 kmol·m-3 4-4 乙醇在装有氧化铝催化剂的固定床反应器中脱水,生成乙烯C2H5OH → C2H4 H2O 测得每次投料0.50kg乙醇,可得0.26kg乙烯,剩余0.03kg乙醇未反应。
求乙醇转化率、乙烯的产率和选择性。
解乙醇总消耗量0.50 - 0.03 0.47kg 其转化率xA ´100 94 设生成0.26kg乙烯需乙醇a kg a 0.427kg 乙烯的选择性Sp 0.909 乙烯的收率Yp Sp·xA 0.909 ´0.94 0.854 4-5 在间歇操作搅拌釜中用醋酸和丁醇反应生产醋酸丁酯,反应式为CH3COOH C4H9OH CH3COOC4H9 H2O (A)B (R)(S)已知反应在100℃下进行,动力学方程为-rA 2.9 ´10-7cA2mol·m-3·s-1。
反应物配比为丁醇醋酸=4.972 1(摩尔比),每天生产醋酸丁酯2400kg(忽略分离损失),辅助生产时间为30min,混合物的密度视为常数。
等于750kg·m-3,试求当醋酸的转化率为50%时所需反应器的体积大小(装料系数取0.7)。
解MA 60 MB 74 MR 116 cA,0 ´750 1.753kmol·m-3 1753 mol·m-3 qn,A,0 1.724 kmol·h-1 1.724 ´103 mol·m-3 qV,0 0.9835m3·h-1 V qV,0tr t/ 0.9835 ´32.78 30 ´ 1.03m3 VR 1.47m3 4-6 某气相一级反应A →3R,反应速度常数k 8.3310-3s-1,在间歇反应器中进行,初始条件为纯A,总压为101325Pa。

化学反应工程课后习题答案化学反应工程课后习题答案化学反应工程是化学工程学科中的重要分支之一,它研究的是化学反应在工业生产中的应用。
通过对反应过程的分析和优化,可以提高反应的产率、选择性和经济性。
在学习化学反应工程的过程中,我们经常会遇到一些习题,下面我将为大家提供一些常见习题的解答。
1. 习题一:对于一个一级反应A→B,初始浓度为C0的A,经过一段时间t后,浓度为Ct。
求该反应的速率常数k。
解答:根据一级反应的速率方程,可以得到d[A]/dt = -k[A],其中d[A]/dt表示A的浓度随时间的变化率。
根据题意,我们可以得到d[A]/dt = (Ct - C0)/t。
将这两个式子相等,可以得到(Ct - C0)/t = -k[A]。
由于初始浓度为C0的A,所以[A] = C0。
将这个值代入上式,可以得到(Ct - C0)/t = -kC0。
整理一下,就可以得到k = (C0 - Ct)/C0t。
2. 习题二:对于一个二级反应A + B→C,初始浓度分别为C0的A和C1的B,经过一段时间t后,浓度分别为Ct的A和Ct+1的B。
求该反应的速率常数k。
解答:根据二级反应的速率方程,可以得到d[A]/dt = -k[A][B],d[B]/dt = -k[A][B]。
根据题意,我们可以得到d[A]/dt = (Ct - C0)/t,d[B]/dt = (Ct+1 - C1)/t。
将这两个式子相等,可以得到(Ct - C0)/t = (Ct+1 - C1)/t = -k[A][B]。
由于初始浓度分别为C0的A和C1的B,所以[A] = C0,[B] = C1。
将这两个值代入上式,可以得到(Ct - C0)/t = (Ct+1 - C1)/t = -kC0C1。
整理一下,就可以得到k = (C0- Ct)/(C0C1t) = (Ct+1 - C1)/(C0C1t)。
3. 习题三:对于一个零级反应,初始浓度为C0的A,经过一段时间t后,浓度为Ct。
4 管式反应器4.1在常压及800℃等温下在活塞流反应器中进行下列气相均相反应:6532664+→+C H CH H C H CH在反应条件下该反应的速率方程为:0.51.5,/.=T H r C C mol l s式中C T 及C H 分别为甲苯及氢的浓度,mol/l ,原料处理量为2kmol/h ,其中甲苯与氢的摩尔比等于1。
若反应器的直径为50mm ,试计算甲苯最终转化率为95%时的反应器长度。
解:根据题意可知甲苯加氢反应为恒容过程,原料甲苯与氢的摩尔比等于1,即:00=T H C C ,则有:0(1)==-T H T T C C C X示中下标T 和H 分别代表甲苯与氢,其中:53300330000.5 1.01310 5.6810/8.3141010732/21/0.27810/--⨯⨯===⨯⨯⨯====⨯T T T T p C kmol mRT F Q C kmol h kmol s所以,所需反应器体积为:00000.5 1.500 2.50.95333 1.5 1.501.5 1.5(10.95)10.278100.4329 3.0061.5(5.6810)(1) 1.51---==--=⨯=⨯=⨯--⎰⎰⎰TT X X T Tr T T T H T T T dX dX V Q C Q C C C C dX mX 所以,反应器的长度为:23.0061531.10.05 3.14/4=⨯m4.2根据习题3.2所规定的条件和给定数据,改用活塞流反应器生产乙二醇,试计算所需的反应体积,并与间歇釜式反应器进行比较。
解:题给条件说明该反应为液相反应,可视为恒容过程,在习题 3.2中已算出:0275.8/=Q l h 0 1.231/=A C mol l所以,所需反应器体积:00000000(1)()275.80.95818.61 5.2 1.23110.95=--===-⨯-⎰AX Ar A A A B A A A A A dX V Q C kC X C C X Q X lkC X由计算结果可知,活塞流反应器的反应体积小,间歇釜式反应器的反应体积大,这是由于间歇式反应器有辅助时间造成的。
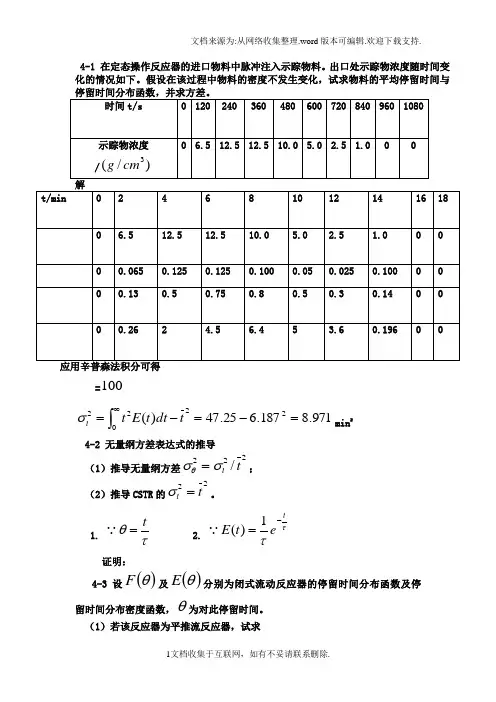
4-1 在定态操作反应器的进口物料中脉冲注入示踪物料。
出口处示踪物浓度随时间变化的情况如下。
假设在该过程中物料的密度不发生变化,试求物料的平均停留时间与时间t/s 0 120 240 360 480 600 720 840 960 1080示踪物浓度/)/(3cm g 0 0 0t/min246810121416 183/cm g c i0 0 0min/1)(it E0 0 0i i t E t )( 00 0min)(2i it E t0 2 5 0 0])(2)(4[3109753864210c c c c c c c c c c tdt c i +++++++++∆=⎰∞]0)5.20.1025.1(2)0.10.55.125.6(40[32++++++++= =100min)/1(100)()(0tii c dt c t c t E ==⎰∞})(])()()()([2])()()()([4)({31010997755338866442211_t E t t E t t E t t E t t E t t E t t E t t E t t E t t E t tt +++++++++∆=]0)03.08.05.0(2)14.05.075.013.0(40[32+++++++++=min 187.6=⎰∞=-=-=02222971.8187.625.47)(t dt t E t tσmin 24-2 无量纲方差表达式的推导 (1)推导无量纲方差222/ttσσθ=;(2)推导CSTR 的22tt=σ。
1. τθt=2. ττtet E -=1)(证明:2022)(ii i ittt t E t -∆=∑∞σ ⎰∞--=221tdt e t t ττ22)()()()(ττθθττθ--=⎰∞-d t E()]1)1([022--=⎰∞θθθτd E22θστ= 222/τσσθt=∴ 220222)(1)(--∞-=-=⎰⎰t dt e tt dt t E t ttττσ222ττ-=2τ=22τσ=t4-3 设()θF 及()θE 分别为闭式流动反应器的停留时间分布函数及停留时间分布密度函数,θ为对此停留时间。
(1)若该反应器为平推流反应器,试求 ①F(1); ②E(1);③F;④E;⑤F(2)若该反应器为全混流反应器,试求 ①F(1); ②E(1);③F;④E;⑤F(3)若该反应器为非理想流动反应器,试求 ①F(∞); ②F(0);③E(∞);④E(0);⑤⎰∞0)(θθd E ;⑥⎰∞)(θθθd E解1平推流模型0)(=θF )(t t 〈 0)(=θE )(t t ≠ 1)(=θF )(t t ≥ ∞=)(θE )(t t =)()(τθtF F =⎪⎩⎪⎨⎧===2.1,18.0,01,1θθθ⎩⎨⎧=====8.0,01,1)()(θθτθt E E2 全混流θθ-=e E )( , θθ--=e F 1)(==)()(τθt f F ⎪⎭⎪⎬⎫=-=-=----699.01551.01632.012.18.01e e e ⎪⎩⎪⎨⎧===2.18.01θθθ==)()(τθtE E ⎪⎭⎪⎬⎫==--449.0368.08.01e e ⎩⎨⎧==8.01θθ3非理想流动模型a 多釜串联 θθθN N N e N N E ---=1)!1()(, 0)(C C F N =θ()()1]!11)(!21)(!111[1)(12=-++++-=∞--N N N N N N e F θθθθ()()0]!11)(!21)(!111[1)0(12=-++++-=--N N N N N N eF θθθθ()()()0!11=-=∞--θθN N Ne N N E()()1,00!1001≠=-=-N e N N E N N()()1!1!1)(01010=-=-=⎰⎰⎰∞--∞--∞θθθθθθθθd e N N d e N N d E N N NN N N ()1!1)(0=-=⎰⎰∞-∞θθθθθθd e N N d E N N N4-4 C(t)00.20.40.60.811.2012345系列1t/min4-18图用阶跃法测定某一闭式流动反应器的停留时间分布,得到离开反应器的示踪剂浓度与时间的关系,如图4-18所示。
⎪⎩⎪⎨⎧-=120)(t t c 3322〉≤≤≤t t t试求 (1)该反应器的停留时间分布函数)(θF 及分布密度函数)(θE ;(2)数学期望θ 及方差2θσ;(3)若用多釜串联模型来模拟该反应器,则模型参数是多少? (4)若用轴向扩散模型来模拟该反应器,则模型参数是多少?(5)若在此反应器内进行1级不可逆反应,反应速率常数1min 1-=k ,且无副反应,试求反应器出口转化率。
解(1).()()θF c t c t F ==0)(⎪⎩⎪⎨⎧-=12)(t t c 3322〉≤≤≤t t t()⎪⎩⎪⎨⎧-==∴120)(0t c t c t F 3322〉≤≤≤t t t ,()θF t F =)(⎪⎩⎪⎨⎧=∆∆=010)(0t c c t E3322〉≤≤≤t t t ,()t t E E =)(θ()⎰⎰⎰⎰==⋅++⋅==∞∞2233225232100t dt t tdt dt t dt t tE t()⎪⎪⎩⎪⎪⎨⎧=0250θE 3322〉≤≤≤t t t(2). 1==-ttθ()751]425[254425]010[25432232322202222222=-=-+⨯+=-==⎰⎰⎰⎰⎰∞-∞-dt t dt t dt t dt t tt dt t E t tt σσθ(3). 多釜串联模型75122222====θσσστt t t N ()()()θθθθθ75175751!17575!1-----=-=e e N N E N N N()()]!11)(!21)(!111[1)(12---++++-=N N N N N N e F θθθθθ ()()]75!1751)75(!21)75(!111[1)(175275---++++-=θθθθθ e F(4). 轴向扩散模型()0133.075112222==--=-Pee Pe Pe θσ 试差 Pe=(5).()⎰⎰⎰⎰∞---∞-++==-33220101dte dt e dt edt t E e x kt ktktkt A0855.023=-=-te%45.91=A x4-5. 为了测定某一闭式流动反应器的停留时间分布,采用脉冲输入法,反应t/min 0 1 2 3 4 5 6 7 8 9 10()()3//cm g t c0 3 5 6 6 3 2 1 0(1)反应物料在该反应器中的平均停留时间t 及方差2θσ(2)停留时间小于的物料所占的分率。
解t(min) 0 1 2 3 4 5 6 7 8 9 10(3/cm g c i)0 0 3 5 6 6 3 2 1 0()it E0 0()i i t E t0 0 0.528 0.297 0()ii t E t 20 0 0.392 3.168 4.95 5.328 4.802 4.224 2,673 0(1).])(2)(4[3109753864210c c c c c c c c c c tdt c i +++++++++∆=⎰∞()()025.46321365040[31++++++++++=33.30=33.30)()(0tiic dt c t c t E ==⎰∞ min 1 })(])()()()([2])()()()([4)({31111997755338866442211_t E t t E t t E t t E t t E t t E t t E t t E t t E t t E t tt +++++++++∆=()088.4]0528.089.0792.0196.02297.0686.099.0492.0040[31=+⎪⎪⎭⎫⎝⎛+++++++++=⎰∞=-=-=0222253.10088.4244.27)(t dt t E t tσ63.0222==tt σσθ(2). ()()()()()()24]321[2014E E E E E dt t E ++++⨯=⎰361.0=4-6将一定量的示踪剂从一管式流动反应器的进口处注入,并在该反应器的出口处连续检测示踪剂的浓度()t c ,得到如下数据:t/min48121620242832())/(/3cm kg t c(1)试根据上述实验数据计算平均停留时间;(2)如果在该管式反应器中进行一级不可逆反应RA k −→−1,11m in 045.0-=k 试计算反应物A 的平均转化率;(3)试根据理想平推流模型计算平均转化率并与(2)结果进行比较;(4)若按照多级CSTR 模型处理,求模型参数N 和停留时间分布函数F(t)。
t min0 481216202428 323/m kg c i0 3 5 5 4 2 1 0 0()it E 0 0 0()ii t E t0 0 0()iit E t 24 9 10 0 0()itt E e045.0-0 0 0(1). 应用辛普森法则()800=⎰∞dt t c , ()()80t c t E i =1/min})(])()()([2])()()()([4)({3997755338866442211_t E t t E t t E t t E t t E t t E t t E t t E t t E t tt ++++++++∆= min 73.11=()8.360222=-=⎰∞t dt t E t ii tσ (2).R A k −→−111m in 045.0-=k()6.0415.010=⨯==-⎰∞-dt t E e x ktA , %40=A x(3).平推流%7.99997.01173.11045.0==-=-=⨯--e e x kt A,返混造成了实际转化率下降了50多。
(4)多级CSTR 串联模型47.38.3673.11222≈===-t t N σ ()324332841[1θθθθθ+++-=-eF , -=tt θθ()θF 01()()θF t F =4-7. 用阶跃法测定某一闭式流动反应器的停留时间分布,得到离开反应器的示t/s0 1525354555657590100()()3//cm g t c(1)试求该反应器的停留时间分布函数及平均停留时间;(2)若在该反应器内的物料为微观流体,且进行1级不可逆反应,反应速率常数105.0-=s k,预计反应器出口出的转化率;(3)若在该反应器内的物料为宏观流体,其他条件不变,试问反应器出口处的转化率是多少?解. (1) ()()0c t c t F = , ()()tt F t E ∆∆=∴ts0 152535455565759010()3/cm g t c 0()t F0 1 1()310⨯t E0 4 7 13 52 19 13 7 6 0()305.010⨯-itt E e0 0()()∑⎰∞∞∆==iiitt E t dt t tE t()S 2.620151069010107751010136510101955101052451010133510107251510415033333333=+⨯⨯⨯+⨯⨯⨯+⨯⨯⨯+⨯⨯⨯+⨯⨯⨯+⨯⨯⨯+⨯⨯⨯+⨯⨯⨯+=--------(2). 微观()()∑⎰∆≈=--∞-nii kt kt A t t E e dt t E e x i 01%4.86,136.0100136.0=-=⨯=A x(3). 宏观,对于一级反应宏观流体与微观流体转化率一样%4.86=Ax4-8.已知一等温闭式流动反应器的停留时间分布密度函数()t te t E 416-=min-1试求:(1)平均停留时间;(2)空时;(3)空速;(4)停留时间小于1min 的物料所占得分率;(5)停留时间大于1min 的物料所占的分率;(6)若用CSTR 串联模型来模拟反应器,则模型参数(N )为多少? 解. (1) ()t te t E416-=()21281604040420=====⎰⎰⎰⎰∞-∞-∞-∞dt e tdedt e t dt t tE t tttmin(2). 空时21==-t τmin (3). 空速 21==τSmin-1(4). ()4441141101416-----=-===⎰⎰⎰e edt e dt te dt t E ttt9817.0=(5). ()0183.0110=-⎰dt t E(6). CSTR 串联模型参数为:()8323612160404042430222=====-=⎰⎰⎰⎰⎰∞-∞-∞-∞-∞-dt e dtt e det dt e t t dt t E t t t tttσ328321,1222222=⎪⎭⎫ ⎝⎛====--t t t N N tσσσθ4-9 在一个全混釜中,等温下进行零级反应A →B ,反应速率为()L mol r A •=m in /9,进料浓度L mol c A /100=,流体在反应器内的平均停留时间min 1=t,请按下列情况分别计算反应器出口转化率:(1)若反应物料为微观流体; (2)若反应物料为宏观流体; 解. A →B L mol r A•=m in /9, L mol c A /100= min 1=t(1).微观流体91010AfAfAfA c r c c t -=⇒-=, L mol c Af/1=%90=Afx(2)宏观流体,零级反应,反应速率与浓度无关,kt c c A A =-0()Lmol t k C dt t E kt C dt t E c c A A A A /1910)()(000--=-=-==-∞∞⎰⎰ 90.0=Ax ,与微观流体转化效果相同4-10 在具有如下停留时间分布的反应器,等温进行一级不可逆反应A →P ,反应速率常数为1min2-。