铁的知识
- 格式:doc
- 大小:25.00 KB
- 文档页数:2


关于铁知识点总结一、铁的性质1. 物理性质铁是一种银白色的金属,具有良好的导电性和导热性。
它的密度为7.87g/cm3,熔点为1535°C,沸点为2750°C。
在高温下,铁可以燃烧生成铁氧化物。
2. 化学性质铁可以与氧、硫、氯等元素发生化学反应,形成氧化铁、硫化铁、氯化铁等化合物。
铁还可以与酸和碱发生反应,在空气中易被氧化生成铁锈。
3. 结构性质铁的原子序数为26,其晶体结构为面心立方结构。
在室温下,铁为α铁,於910℃以上的下铁点以上,随温度的升高体心立方晶格向面心立方晶格转变,这时的铁称为γ铁。
二、铁的产地铁在自然界中广泛存在于铁矿石和其他矿物中。
目前全球最主要的铁矿资源分布在澳大利亚、巴西、中国、印度和俄罗斯等国家,其中澳大利亚和巴西的铁矿储量最为丰富,占据了全球铁矿的大部分储量。
三、铁的提取1. 铁的提炼工艺目前主要采用高炉法和直接还原法来提取铁。
高炉法是将炼铁矿、焦炭和石灰石放入高炉中进行还原反应,产生生铁和炼钢渣。
直接还原法则是采用天然气或甲烷等还原剂,将铁矿石在还原炉中进行还原反应,得到直接还原铁。
这两种方法都是通过还原铁矿石中的铁氧化物,得到纯净的铁。
2. 铁的精炼工艺生铁经过熔炼和冶炼,可以得到各种不同性质的铁合金。
比如,经过熔炼和冶炼处理,在高炉炉料中不锈钢、合金钢,而紧凑是品位高的铁矿石采审,在炼炉炼制过程中,从而生产出高品位的炼炉炼制铁合金。
四、铁的加工铁在加工过程中可以进行热加工和冷加工。
热加工包括锻造、轧制、铸造等工艺,主要用来生产金属制品。
冷加工包括拉伸、弯曲、剪切等工艺,主要用来生产板材、管材等产品。
铁制品在加工后可以进行表面处理,如镀金、喷涂、抛光等,以增加其装饰性和耐腐蚀性。
五、铁的应用铁广泛应用于工业、建筑、交通运输、家电、化工、医疗、食品等领域。
其中,工业领域的应用最为广泛,铁制品包括铁棒、钢管、轮轴、齿轮、机床、压力容器等。
在建筑领域,铁主要用于建筑结构、桥梁、楼梯、栏杆等。
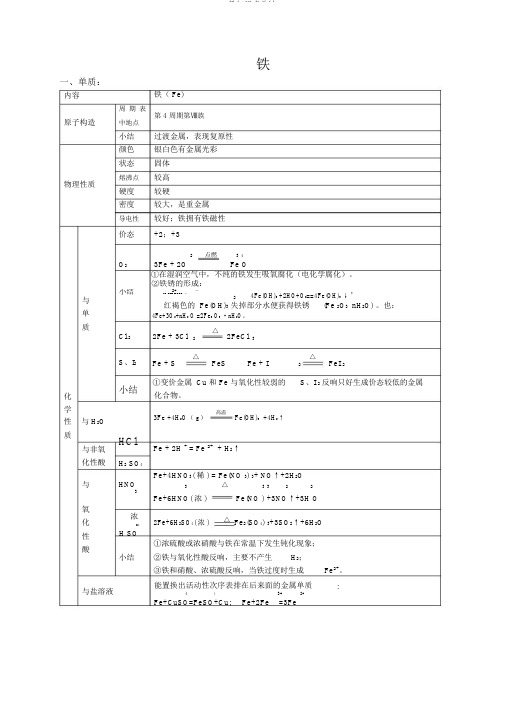
一、单质:内容原子构造物理性质与单质化学性与 H2O 质与非氧化性酸铁铁( Fe)周期表第 4 周期第Ⅷ族中地点小结过渡金属,表现复原性颜色银白色有金属光彩状态固体熔沸点较高硬度较硬密度较大,是重金属导电性较好;铁拥有铁磁性价态+2;+3O23Fe + 2O2点燃 3 4Fe O①在湿润空气中,不纯的铁发生吸氧腐化(电化学腐化)。
②铁锈的形成:小结2+-,Fe +2OH =Fe(OH) ↓,4Fe(OH)2 +2HO+O2==4Fe(OH)3↓2红褐色的 Fe(OH)3失掉部分水便获得铁锈(Fe 2O3· nH2O) 。
也:4Fe+3O2+nH2 O =2Fe2 O3·nH2O。
Cl 22Fe + 3Cl2△2FeCl3S、I2Fe + S△FeS Fe + I△FeI 22小结①变价金属 Cu 和 Fe 与氧化性较弱的S、I 2反响只好生成价态较低的金属化合物。
3Fe +4H2O( g)高温Fe(OH)3 +4H2↑HClFe + 2H + = Fe 2+ + H2↑H2 SO4Fe+4HNO3( 稀 ) = Fe(NO 3) 3+ NO↑+2H2O与HNO3△ 3 3223Fe+6HNO( 浓 )Fe(NO ) +3NO↑+3H O 氧浓化2Fe+6H2SO4( 浓 )△Fe2(SO4) 3+3SO2↑+6H2O 24性H SO①浓硫酸或浓硝酸与铁在常温下发生钝化现象;酸小结②铁与氧化性酸反响,主要不产生H2;③铁和硝酸、浓硫酸反响,当铁过度时生成Fe2+。
与盐溶液能置换出活动性次序表排在后来面的金属单质: 44Fe+2Fe3+2+Fe+CuSO=FeSO+Cu;=3Fe二、氧化物:化 学FeO式名 称(俗 氧化亚铁 名 ) 色、态黑色粉末溶 解都难溶于水性金 属+2价态磁性 无与 HCl +FeO+2H反响 =Fe 2++H 2O与 +-HNO 3反 3FeO+10H+NO 3=3Fe 3++NO ↑+5H 2O应与 HI +2+反响FeO+2H= Fe +H 2OH+FeO=Fe+HO与 H 2 2 2 还原 CO CO+FeO=Fe+CO 2 剂( 高Al2Al+3FeO=3Fe+AlO 3温 )稳 定 不稳固,可被氧化,在空性 气中加热被氧化成 Fe 3O 4 用途Fe 2O 3 Fe 3O 4三氧化二铁四氧化三铁(氧化铁,铁红)(磁性氧化铁)红棕色粉末黑色晶体+3 +2; +3 无有Fe 3O 4+8H ++=Fe 2++2Fe 3++4H 2 OFe 2O 3+6H=2Fe 3++3H 2 O2+ 被氧化为 3+Fe Fe+-Fe O+6H+2I3+2+232++3H 2OFe被复原为 Fe=2Fe +I 2 4H+FeO =3Fe+4HO3H+Fe O=2Fe+3HO22323 423CO+Fe 2O 3=2Fe+3CO4CO+Fe 3O 4=3Fe+4CO 22Al+Fe 2O 3=2Fe+Al 2O 38Al+3Fe 3O 4=9Fe+4Al 2 O 3较稳固颜料磁性资料三、氢氧化物:物质氢氧化亚铁 氢氧化铁化学式Fe(OH)2Fe(OH)3物理 色、态白色絮状固体红褐色固体性质水溶性都难溶于水酸碱性都是弱碱与酸盐酸 2+2+23+3+2Fe(OH)+2H =Fe +2H O反响硝酸3Fe(OH) 2+10HNO 3=3Fe(NO) 3+NO ↑ +8H 2OFe(OH) +3H=Fe +3H O不稳固易被空气中氧气氧化,白色快速变为灰 不稳固,受热易分解绿色,最后变为红褐色稳固性4Fe(OH) +O+2HO=4Fe(OH)2Fe(OH)3△ Fe 2 O 3 +3H 2O2232+-↓ 3+-实验原理Fe +2OH=Fe(OH)Fe +3OH=Fe(OH)3↓2室制怎样防止被氧化变质?3+怎样制备氢氧化铁胶体?取4① FeSO 晶体中不可以含有 Fe ; 向开水中滴加几滴 FeCl 3②配制 FeSO 4溶液加入少许铁粉;注意溶液而得, FeCl 3 不宜过多, ③配制溶液的蒸馏水及 NaOH 溶液均须用“煮沸”浓度不宜过大,加热时间不等方法以除掉此中溶解的氧气;宜过长,不然简单产生积淀。

化学高一铁知识点铁是一种常见的金属元素,它在我们的日常生活中起着重要的作用。
本文将介绍高一化学中与铁相关的知识点,以帮助学生更好地理解和掌握这一主题。
一、铁的性质铁是一种具有磁性的金属元素,其化学符号为Fe(来自于拉丁语“ferrum”)。
它的原子序数为26,相对原子质量为55.845。
铁的外观呈现出银白色,并具有良好的导电和导热性。
此外,铁还具有较高的密度和延展性。
二、铁的同位素铁有多种同位素,其中最常见的是两种稳定同位素:铁-56和铁-54。
铁-56是最稳定的同位素,约占自然界铁的91.754%,而铁-54只占约5.845%。
三、铁的化合物1. 氧化物:铁可以形成多种氧化物,例如铁(II)氧化物(FeO)、铁(III)氧化物(Fe2O3)等。
其中,铁(II)氧化物是黑色固体,而铁(III)氧化物则呈红棕色。
2. 酸化物:铁也可以形成酸化物,如二氧化铁(FeO2)、三氧化二铁(Fe2O3)等。
3. 盐类:铁可以与不同的酸反应形成盐类。
例如,与硫酸反应可以得到硫酸亚铁(FeSO4)和硫酸铁(Fe2(SO4)3)。
四、铁的用途铁是一种重要的工业金属,广泛应用于建筑、交通运输、机械制造等领域。
以下是铁的几个主要用途:1. 制造钢铁:铁在制造钢铁过程中起着关键作用。
钢铁是一种含有较低碳量的铁合金,具有高强度和耐用性。
2. 建筑领域:铁及其合金被广泛用于建筑结构、桥梁和其他基础设施的建造。
3. 交通运输:铁和钢铁的轻便性和强度使其成为汽车、火车、飞机等交通工具的重要组成部分。
4. 电子产品:铁和钢铁在电子产品的制造中起着重要作用,如电脑、手机等设备。
5. 家居用品:铁和钢是制造家居用品的常见材料,如锅碗瓢盆、家具等。
五、铁的赋存形式在地球上,铁主要以氧化物、硫化物和碳酸盐的形式存在。
其中,铁矿石是最常见的铁资源,主要是铁的氧化物矿石,如铁磁铁矿、赤铁矿等。
六、铁与人类生活的关系铁在人类的历史和生活中扮演了重要的角色。

铁1、铁的物理性质:银白色金属光泽,质软,有良好的延性和展性,是电和热的导体。
2、铁生绣实际上是铁、氧气和水等物质相互作用,铁锈的主要成分是氧化铁Fe2O3(红棕色)。
全世界每年因生绣损失的钢铁约占世界年产量的。
3、防止铁制品生绣的方法:①保持铁制品表面的洁净和干燥,②在铁制品的表面涂上一层保护膜。
具体操作是:①在其表面刷油漆,②在其表面涂油,③金属制品表面镀上其它金属,④通过化学反应使铁制品的表面生成致密的氧化膜。
4、黑色金属:Fe、Mn、Cr(铬)有色金属:除前三种以外都是,如Cu、Zn、Al5、合金(混合物):是由一种金属与其它一种或几种金属(或非金属)一起熔合而成的具有金属特性的物质。
铁的合金有:生铁和钢(混合物)生铁的含碳量在2%—4。
3%之间,钢的含碳量在0.03%—2%之间。
生铁分为白口铁、灰口铁和球墨铸铁,球墨铸铁具有很高的机械强度,某些场合可以代替钢。
钢分为碳素钢和合金钢.6、炼铁的主要设备是高炉,主要原料是铁矿石、焦炭和石灰石。
原理:在高温条件下,用还原剂一氧化碳从铁的氧化物中将铁还原出来。
(不能:置换)炼钢设备:转炉、电炉、平炉。
原理:在高温条件下,用氧气或铁的氧化物把生铁中所含的过量的碳和其它杂质转变为气体和炉渣而除去。
7、白口铁的用途:用于炼钢、灰口铁的用途制造化工机械和铸件。
低碳钢和中碳钢用来制造机械零件,钢管.高碳钢用来制刀具、量具和模具。
8、锰钢中合金元素为锰,韧性好,硬度大;不锈钢中合金元素为铬、镍,抗腐蚀性好;硅钢中合金元素为硅,导磁性好;钨钢中合金元素为钨,耐高温,硬度大.9、导电性:银>铜>铝,铝和锌在空气中能形成一层致密的氧化物薄膜,可阻止进一步氧化.铜生锈是铜和水、氧气、二氧化碳发生的反应。
钛耐腐蚀性好。

高中化学铁知识点总结一、铁的基本信息1. 化学符号:Fe2. 原子序数:263. 相对原子质量:55.8454. 周期表位置:第四周期,第VIII族5. 物理性质:铁为银白色金属,具有良好的延展性和导电性,常温下对水和氧气相对稳定,但易在潮湿空气中生锈。
二、铁的化学性质1. 氧化反应:铁在空气中易与氧气结合生成氧化铁,即生锈。
\[ 4Fe + 3O_2 \rightarrow 2Fe_2O_3 \]2. 还原反应:铁可作还原剂,还原其他物质。
\[ Fe + CuSO_4 \rightarrow FeSO_4 + Cu \]3. 与酸反应:铁可与非氧化性酸如盐酸、硫酸反应生成相应的铁盐和氢气。
\[ Fe + 2HCl \rightarrow FeCl_2 + H_2 \]4. 与碱反应:铁与强碱不反应,但可与某些弱碱如氢氧化钠在高温下反应。
5. 电化学性质:铁是活泼的金属,可作原电池的阳极材料。
三、铁的同素异形体1. 阿尔法铁(α-Fe):体心立方结构,稳定于室温至910℃。
2. 伽玛铁(γ-Fe):面心立方结构,稳定于910℃以上。
四、铁的化合物1. 氧化铁- 氧化亚铁(FeO):黑色固体,还原性较强。
- 氧化铁(Fe_2O_3):红棕色固体,常见于生锈。
- 四氧化三铁(Fe_3O_4):黑色固体,磁性材料。
2. 铁盐- 硫酸亚铁(FeSO_4):绿色溶液,常用于电镀。
- 硫酸铁(Fe_2(SO_4)_3):黄色固体,用于制造墨水。
- 氯化铁(FeCl_3):黄色固体,用于水处理。
五、铁的提取与应用1. 提取:铁矿石主要为赤铁矿(Fe_2O_3)和磁铁矿(Fe_3O_4),通过高炉还原法提取铁。
2. 应用:铁广泛应用于建筑、交通工具、机械制造等领域,是工业生产的基础材料。
六、铁的生物作用1. 铁是血红蛋白和肌红蛋白的组成部分,对输送氧气至关重要。
2. 铁参与细胞内许多酶的活性,影响能量代谢和DNA合成。
钢铁基础必学知识点1. 钢铁的定义:钢铁是一种由含碳量在0.02%至2.11%之间的铁碳合金制成的金属材料。
当碳含量小于0.02%时,它被称为铁,而当碳含量超过2.11%时,它被称为铸铁。
2. 钢铁的制造:钢铁通常是通过冶炼铁矿石来制造的。
这个过程包括将铁矿石加热到高温,使其与石灰石和焦炭反应,生成炼铁矿石。
然后,炼铁矿石被冷却并与再生铁和其他添加剂一起加入炼铁炉中进行冶炼,产生钢铁。
3. 钢铁的特性:钢铁具有高强度、硬度、韧性和可塑性。
它也具有良好的导电性和导热性。
4. 钢铁的分类:钢铁可以根据其化学成分和物理性质进行分类。
常见的分类方法包括碳含量、合金元素、热处理方式等。
5. 钢铁的用途:钢铁广泛应用于各个领域,包括建筑、汽车制造、船舶制造、机械制造、电力工业等。
钢铁也是制造其他金属制品的重要材料。
6. 钢铁的保护:由于钢铁容易受到氧化、腐蚀和磨损的影响,保护钢铁非常重要。
一些常见的保护方法包括涂覆防锈涂料、电镀、镀锌和使用不锈钢等。
7. 钢铁的可持续发展:在钢铁生产中,重要的问题是减少对环境的影响。
钢铁行业采取了一系列的措施来提高能源效率、降低碳排放和减少废物产生。
8. 钢铁的国际贸易:钢铁是全球贸易中最重要的商品之一。
各国之间进行钢铁的进口和出口,以满足国内需求和获得经济利益。
9. 钢铁的市场价格:钢铁的价格受到供需关系、全球经济形势、原材料成本等因素的影响。
钢铁市场价格常常波动,对行业和经济有重要影响。
10. 钢铁的未来发展趋势:随着科技的不断进步,钢铁行业也在不断发展。
未来的趋势包括可持续发展、数字化生产、高强度钢等。
高三化学铁的知识点总结一、铁的基本性质铁是一种化学元素,符号为Fe(Ferrum),原子序数为26,在元素周期表中属于过渡金属。
铁是地壳上最丰富的金属元素之一,具有良好的导电性和热导性。
其熔点为1538°C,沸点为2861°C。
铁在自然界中以多种氧化物和矿石的形式存在。
二、铁的同位素铁存在着多种同位素,其中最稳定的是Fe-56,其相对丰度约为91.754%。
其他常见同位素有Fe-54、Fe-57和Fe-58等。
三、铁的氧化态和化合物1. 铁的氧化态:铁常见的氧化态有+2价和+3价。
+2价的铁离子(Fe2+)在溶液中呈绿色,易被氧化。
+3价的铁离子(Fe3+)在溶液中呈黄色,较稳定。
2. 铁的氧化物和氢氧化物:铁可以形成多种氧化物和氢氧化物。
其中,FeO、Fe2O3和Fe3O4是常见的氧化物,Fe(OH)2和Fe(OH)3是常见的氢氧化物。
四、铁的物理与化学性质1. 铁的物理性质:- 密度高:铁的密度约为7.87 g/cm³。
- 磁性:纯净的铁是铁磁性材料,在一定温度范围内具有磁性。
- 可锻性强:铁具有较好的可塑性和可锻性,可以通过锻造、压延等工艺加工成各种形状。
2. 铁的化学性质:- 与酸反应:铁可以与酸反应产生相应的盐和氢气。
- 与氧反应:铁能与氧气反应生成氧化铁,也可通过还原反应还原氧化铁。
- 与水和湿气反应:铁可以与水和湿气中的氧气反应生成铁(Ⅱ)氢氧化物和氢氧化铁(Ⅲ)。
五、铁的重要化合物1. 氧化铁:氧化铁由Fe2O3和Fe3O4两种形式存在,常见的有赤铁矿(Fe2O3)和磁铁矿(Fe3O4)。
2. 硫酸亚铁:化学式为FeSO4,是一种重要的亚铁盐。
常用于制备其他铁盐、农药和维生素。
3. 重铁酸钾:化学式为K3Fe(CN)6,是一种重要的化学试剂,常用于分析化学和配位化学领域。
六、铁的应用1. 铁和钢的制造:铁是制造钢的主要原材料,被广泛应用于建筑、制造业和航天航空等领域。
铁元素知识点总结1.化学性质铁的化学符号为Fe,是一种化合价为+2和+3的过渡金属。
在常温下,铁是一种灰色的金属,通常呈现银白色的光泽。
铁是一种相对活泼的金属,易于与氧气发生化学反应,形成氧化铁。
在空气中,铁会逐渐产生铁锈,这是由于铁与氧气反应形成了氧化铁的结果。
铁的化学性质还表现在其与其他元素的化合物中。
铁与氧的化合物主要有氧化铁、过氧化铁等;与硫的化合物主要有硫化铁、四硫化三铁等;与卤素的化合物主要有氟化铁、氯化铁等。
2.物理性质铁是一种相对密度较大的金属,其密度约为7.87克/立方厘米。
铁的熔点为1535摄氏度,沸点为2750摄氏度。
在常温下,铁为银白色的金属,具有很好的延展性和导电性。
由于其物理性质的稳定性,铁成为了一种被广泛应用的金属材料。
3.用途铁是一种重要的金属材料,在工业生产和日常生活中有着广泛的应用。
首先,铁被用于制造钢铁,钢铁是一种非常重要的结构材料,在建筑、交通、机械制造等领域有着广泛的应用。
其次,铁也被用于制造其他金属材料,如铸铁、不锈钢等。
此外,铁还被用于制造电磁铁、电池、磁性材料等。
在生活领域,铁也有着广泛的应用。
例如,铁制品可以用于制作家具、炊具、器皿等;铁制建筑材料可以用于制作门窗、栏杆等;此外,铁还可以用于制作工艺品、装饰品等。
4.生产铁的生产主要分为两种方式,即矿石冶炼和废钢回收。
矿石冶炼是指将铁矿石经过炼铁过程,提炼出铁的方法。
矿石冶炼的方法主要包括高炉法、直接还原法等。
废钢回收是指将废弃钢铁制品经过再生产的方法,提取出铁材料。
废钢回收可以节约资源,并且有利于环境保护。
5.对人体健康的影响铁是人体所必需的微量元素之一,它参与了人体的血红蛋白和肌红蛋白的合成。
如果人体长期缺乏铁元素,就会导致贫血和免疫力下降等问题。
因此,人们应该通过合理饮食,摄入足够的铁元素,以保持身体健康。
总结起来,铁是一种重要的金属元素,它在工业生产和日常生活中都有着广泛的应用。
通过了解铁的化学性质、物理性质、用途、生产和对人体健康的影响等方面,我们可以更深入地理解这种重要的元素。
第三章第一节铁及其化合物知识点铁简介:广泛应用的金属元素铁是一种过渡金属,在元素周期表中位于第8组。
其原子序数为26,原子质量约为55.85。
铁在地壳中含量丰富,是仅次于铝的第二大常见金属元素。
铁的物理性质铁是一种具有银白色光泽的金属,质地坚硬且具有延展性。
它的熔点为1538摄氏度,沸点为2862摄氏度。
铁在常温下与空气中的氧气反应,形成一层保护性的氧化物层,称为铁锈。
铁的化学性质铁是一种相对活泼的金属,能与多种非金属反应。
它具有以下重要的化学性质:与酸反应:铁与酸(如盐酸和硫酸)反应,生成铁盐和氢气。
与氧气反应:铁在空气中容易氧化,形成铁锈(三氧化二铁)。
与水反应:铁在潮湿环境中与水缓慢反应,生成氢氧化铁。
与卤素反应:铁能与卤素(如氯气和氟气)反应,生成相应的卤化铁。
铁的化合物:氧化物、氢氧化物和盐铁形成一系列化合物,包括氧化物、氢氧化物和盐。
其中最常见的化合物包括:氧化铁:三氧化二铁(Fe2O3)是一种红褐色粉末,常见于铁锈中;四氧化三铁(Fe3O4)是一种黑色晶体,用于制造磁铁。
氢氧化铁:氢氧化铁(Fe(OH)3)是一种棕色胶状物,在水中不溶。
铁盐:氯化铁(FeCl3)是一种棕色固体,可用于制造染料和净水剂;硫酸铁(FeSO4)是一种绿色晶体,用作还原剂。
铁在工业和生物中的重要性铁是一种用途广泛的金属,在工业和生物系统中至关重要:工业应用:铁用于制造钢铁、汽车、建筑材料、机械和电气设备。
生物作用:铁是血红蛋白和肌红蛋白等血红素蛋白的组成部分,这些蛋白负责血液中氧气和肌肉中的氧气的运输。
铁缺乏症和过量铁缺乏会导致贫血,其症状包括疲劳、苍白和呼吸短促。
铁过量也可能是有害的,称为血色病,其症状包括肝损伤和皮肤变色。
保持健康的铁水平对于整体健康至关重要。
铁的回收利用铁是一种可回收利用的金属,回收利用铁制品可以减少环境污染和保护自然资源。
铁制品可以通过磁性分离和熔炼等方法进行回收利用。
影响膳食铁吸收的常见因素有哪些?
1)机体铁营养状况:在体内缺铁的情况下,铁的吸收量会明显增加
2)膳食铁的含量及存在形式:有机铁、二价铁较易吸收,血红素铁较非血红素铁吸收率高。
3)膳食中影响铁吸收的因素:
抑制铁吸收的因素:草酸、植酸、鞣酸、植物纤维、茶、咖啡、钙(包括牛奶中的钙)、例如植酸是谷物、种子、坚果、蔬菜、水果中以磷酸盐和矿物质贮存形式的六磷酸盐,在小肠的碱性环境中容易形成磷酸盐而防碍铁吸收,茶与咖啡也影响铁的吸收,茶叶中的鞣酸与铁形成鞣酸铁复合物,可使铁吸收减少。
促进铁吸收的因素有:肉、禽、鱼类食物中的“内因子”,维生素C。
患者性别:女
患者年龄:26
全部症状:无明显症状
发病时间及原因:
治疗情况:请问怀孕4个月了去医院验血查了个微量元素
别的都没事铁比参考值低
铁结果7.47MOL/L
参考值7.52-11.82 请问需要怎样补铁是药补还是食补比较好?
你好,这种情况建议最好在医生的指导下补充
意见建议:
平时注意饮食,黑木耳,红枣,红豆.黑木耳,红枣,红豆含有较丰富的铁质,孕妇常食用,不仅起到防治缺铁性贫血,还有滋补强力的功效.动物内脏.动物内脏中的铁含量往往高于动物的肉,如猪肝,牛肝,羊肝,鸡肝等,不仅含铁量高,而且维生素的含量也很丰富.
动物血液.动物血液中含有丰富的血红素铁,易被人体消化吸收,动物血和内脂豆腐做汤,经常食用,具有良好的防治缺铁性贫血作用.
水果.孕妇每天要有一定量的瓜果摄入量,瓜果本身含铁量并不高,但是,瓜果中含有丰富的维生素C,能促进食物中铁的吸收.
您好,根据您的描述提以下建议.
意见建议:
一般而言,首先应保证平衡膳食,忌挑食偏食;其次要注意适当多吃含铁比较高的食品,例如动物的血液制品,肝脏,鸡胗,牛肾,大豆及豆制品,黑木耳,芝麻酱等,其它如瘦肉,红糖,蛋黄,猪肾,羊肾,干果……
过去,普遍认为菠菜含铁量较高,因此宜多吃菠菜,其实菠菜中的铁主要是无机铁,较难吸收,而牛奶是贫铁食物,也不易补铁.因此,要补充铁,就要多吃含铁量高的食品.
另外,在缺铁性贫血补充铁时,也应该同时补充维生素A,因为维生素A的缺乏也会导致铁缺乏,而且维生素A 也能促进铁的吸收利用.
在医生营养师的建议下,适当服用铁剂也是一个较好的补充铁的途径.
目前,国家为了改善国人的铁营养状况,开发了一些铁强化剂,如铁强化酱油,就是在酱油中加入了EDTA铁,这种铁不仅容易吸收,而且不会对酱油的外观和口感造成影响,也是WHO推荐的膳食补充铁的形式,一般情况下长期食用强化铁的酱油也不会出现铁过量的问题.
2、Fe:母体在妊娠过程中平均向胎儿提供Fe约270mg,胎盘和脐带Fe 90mg,分娩时出血丢失Fe150mg,正常机体代谢排出Fe170mg,血红蛋白增加,需Fe 450mg,以上共计Fe 1130mg。
孕妇胃液分泌不足,影响Fe吸收,Fe摄入不足或Fe质量差,易患缺Fe性贫血。
七、铁过量表现
通过各种途径进入体内的铁量的增加,可使铁在人体内贮存过多,因而可引致铁在体内潜在的有害作用,体内铁的贮存过多与多种疾病如心脏和肝脏疾病、糖尿病、某些肿瘤有关。
肝脏是铁储存的主要部位,铁过量也常累及肝脏,成为铁过多诱导的损伤的主要靶器官。
肝铁过载导致:1、肝纤维化甚至肝硬化;2、肝细胞瘤。
铁过量与心脏疾病关系的探讨,已见诸多报道。
许多作者认为,铁通过催化自由基的生成、促进脂蛋白的脂质和蛋白质部分的过氧化反应、形成氧化LDL等作用,参与动脉粥样硬化的形成。
铁过多诱导的脂质过氧化反应的增强,导致机体氧化和抗氧化系统失衡,直接损伤DNA,诱发突变,与肝、结肠、直肠、肺、食管、膀胱等多种器官的肿瘤有关。