山东省枣庄二中学2017届高三上学期化学期末复习过关题
- 格式:doc
- 大小:427.72 KB
- 文档页数:10

山东省枣庄一中学2016-2017学年度高三化学期末复习自测题(六)学校:___________姓名:___________班级:___________考号:___________ 1.化学在生产和日常生活中有着重要的作用,下列有关说法不正确的是A.硅酸钠的水溶液俗称水玻璃,可用作木材防火剂B.采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量C.含磷污水是很好的肥料,可灌溉庄稼,可直接排放到自然界水体中D.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水2.用N A表示阿伏加德罗常数,下列说法中正确的是A.常温常压下22.4L的CO2在一定条件下与足量的镁反应,转移4N A个电子B.60g SiO2中含硅氧键数目为4N AC.1.00mol NaCl中含有6.02×1023个NaCl分子D.3.9gNa2O2中所含的阴离子数目为0.1NA3.下列化学用语正确的是()A.Na2O2的电子式:B.Cl原子的结构示意图:C.HClO分子的结构式:H-Cl-OD.乙烯的结构简式:CH2CH24.下列说法中不正确的是( )①由同一种元素组成的物质一定是单质②阴离子一定不含金属元素,阳离子一定含金属元素③碱性氧化物一定是金属氧化物④酸性氧化物一定是非金属氧化物⑤按酸分子中电离出的氢离子数目不同,可将酸分为一元酸、二元酸和多元酸⑥无氧酸一定是非金属的氢化物A.①③④⑤ B.①②④⑥ C.①②③⑥ D.②③⑤⑥5.下列离子方程式不正确的是A.在NaClO的溶液中通入少量的CO2:2ClO-+CO2+H2O=2HClO+CO32-B.向碳酸氢镁溶液中加入过量的澄清石水:Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2OC.向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓D.Cu溶于稀硝酸中:3Cu+8H++2NO3-=3Cu 2++2NO↑+4H2O6.一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2+9H2O,在反应中氧化产物与还原产物的物质的量之比为A.5∶3 B.5∶4 C.1∶1 D.3∶57.设阿伏加德罗常数为N A,下列说法正确的是A.22.4 LCl2分别与铁和铜反应时,失电子数目均为N AB.1mol Na2O2与CO2足量反应时,转移N A个电子C.1mol·L-1的NaOH溶液中含Na+数目为N AD.1mol Na2O2晶体中含有的阴离子数目为2N A8.Cl2、HCl的混合气体通入足量的氢氧化钠溶液,充分反应后分析产物溶液中除大量OH−外,还有Cl−、ClO−、ClO3−,并知这三种离子的物质的量比为9:2:1。

2017-2018学年度枣庄二中第一学期高三化学期中复习模拟题(四)学校:___________姓名:___________班级:___________考号:___________1.据报导,我国某些城市的酸雨严重,为改变这一状况,某市正准备推广使用的清洁能源,下列所列能源不是清洁能源的是()A.太阳能 B.石油C.天然气D.酒精2.N A表示阿伏伽德罗常数,下列叙述正确的是()A.0.1 mol丙烯酸中含有双键的数目为0.1N AB.标准状况下,11.2 L苯中含有分子的数目为0.5N AC.1 mol甲苯含有6n A个C—H键D.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6N A3.下列推断正确的是A.氯化氢是强电解质,醋酸是弱电解质,盐酸溶液的导电性一定强于醋酸溶液B.不论是浓硝酸还是稀硝酸,与铜反应均体现出硝酸的酸性和强氧化性C.SO2、NO、NO2都是形成酸雨的因素,都能和水反应生成酸D.氯元素的非金属性强于碳元素,氯元素含氧酸的酸性都大于碳元素的含氧酸的酸性4.已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液形成无色溶液,其化学方程式是PbSO4+2NH4Ac=Pb(Ac)2+(NH4)2SO4。
当在Pb(Ac)2(醋酸铅)溶液中通入H2S时,有黑色沉淀PbS生成。
表示这个反应的有关离子方程式正确的是A.Pb(Ac)2+H2S=PbS↓+2HAcB.Pb2++H2S=PbS↓+2H+C.Pb2++2Ac-+H2S=PbS↓+2HAcD.Pb2++2Ac-+2H++S2-=PbS↓+2HAc5.工业上,可用硫酸铈[Ce(SO4)2]溶液吸收尾气中NO,其化学方程式如下:2NO+3H2O +4Ce(SO4)2=2Ce2(SO4)3+HNO3+HNO2+2H2SO4下列说法正确的是()A.在该反应中氧化剂与还原剂的物质的量之比为1∶2B.在该反应中,氧化产物有两种,还原产物有一种C.若不考虑溶液体积变化,吸收尾气后,溶液的pH将增大D.在该反应中,每消耗22.4LNO必转移2 mol电子6.在四种化合物①NaHCO3、②Al(OH)3、③Al2O3、④NaAlO2中,与盐酸和氢氧化钠溶液都能反应的是( )A.只有②④ B.只有①② C.只有①②③ D.①②③④7.铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:下列说法中错误的是( )A.①②中除加试剂外,还需要进行过滤操作B.a、b中铝元素的化合价相同C.③中需要通入过量的氨气D.④进行的操作是加热,而且d一定是氧化铝8.某硫酸厂废气中SO2的回收利用方案如下图所示,下列说法不正确的是A.X可能含有2种盐 B.a是SO3C.Y可能含有(NH4)2SO4 D.(NH4)2S2O8中S的化合价不可能为+7 9.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。

2016-2017学年度枣庄二中第一学期高三化学期中复习模拟题(五)学校:___________姓名:___________班级:___________考号:___________ 1.食品卫生与身体健康密切相关.下列做法会导致食品对人体有害的是( )①在沥青公路上翻晒粮食;②香肠中加过量亚硝酸钠以保持肉类新鲜,③用生活用煤直接烧烤鸡、鸭;④用“瘦肉精”(一种含激素的饲料)喂饲生猪;⑤用乙烯催熟水果.A.①②③⑤ B.①②③④ C.②③④⑤ D.①③④2.用N A表示阿伏加德罗常数的值,下列说法正确的是A.78gNa2O2固体中阴离子的个数为2N AB.标准状况1.12L氯气与H2O反应,反应中转移的电子数为0.1N AC.CO2通过Na2O2使其增重ag时,反应中转移的电子数为aN A/56D.60gSiO2含有的化学键数目为4N A3.下列表述正确的是①某物质经科学测定只含有一种元素,不可以断定该物质一定是一种纯净物;②过量铁粉在氯气中燃烧生成FeCl2③浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸;④医疗上用的“钡餐”其成分是碳酸钡,漂白粉的成分为次氯酸钙;⑤高压钠灯发出的黄光射程远,透雾能力强,故可做航标灯⑥能与酸反应的氧化物,一定是碱性氧化物A.①②③ B.①③⑤ C.②④⑥ D.②③⑤4.能正确表示下列反应的离子方程式的是A.用惰性电极电解MgCl2溶液:2Cl-+2H2O电解Cl2↑+H2↑+2OH-B.向石灰水中滴加少量Ca(HCO3)2溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2OC.过氧化钠与水反应:2O22-+2H2O=4OH-+O2↑D.一定量明矾溶液中滴加Ba(OH)2溶液至沉淀的质量最大时:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O5.工业上以CuFeS2为原料冶炼铜的主要反应为①2CuFeS2+4O2==Cu2S+3SO2+2FeO (炉渣);②2Cu2S+3O2==2Cu2O+2SO2;③2Cu2O+Cu2S=6Cu+SO2↑。

2016—2017学年山东省枣庄市滕州实验高中高三(上)期末化学复习试卷(二)一、选择题1.化学与生产、生活、社会密切相关,下列说法错误的是()A.绚丽缤纷的烟花中添加了含钾、钠、钙、铜等金属元素的化合物B.加工后具有吸水性的植物纤维可用作食品干燥剂C.臭氧、高锰酸钾溶液、次氯酸钠溶液、乙醇溶液均可用于消毒杀菌,且原理相同D.PM2。
5是指大气中直径小于或等于2。
5微米的颗粒物,与肺癌等疾病的发生相关2.用N A表示阿伏加德罗常数的值,下列叙述正确的是()A.标准状况下,22.4 L 酒精含有的分子数为N AB.500mL 1moL/L的盐酸中含有的HCl分子数为0。
5 N AC.通常状况下,N A个CO2分子占有的体积约为22.4 LD.通常状况下,71 g Cl2所含原子数为2 N A3.某合作学习小组讨论辨析以下说法,其中说法正确的是()①纯碱和熟石灰都是碱.②沼气和水蒸气都是可再生能源;③冰和干冰既是纯净物又是化合物;④硫酸和食醋既是化合物又是酸;⑤不锈钢和目前流通的硬币都是合金;⑥粗盐和酸雨都是混合物.A.③⑤⑥B.②④⑥C.①③⑤D.①②③⑥4.下列各组离子在指定条件下可以大量共存的是()A.在AlCl3溶液中:Na+、NH4+、S2O32﹣、SO42﹣B.使pH试纸变蓝色的溶液中:Cu2+、NO3﹣、Fe3+、SO42﹣C.与铝粉反应放出氢气的无色溶液中:Na+、Al3+、SO42﹣、NO3﹣D.常温下=1×10﹣12的溶液中:K+、AlO2﹣、Na+、CO32﹣5.在传统的硝化法制硫酸中,其关键反应为NO2+SO2=NO+SO3,2NO+O2=2NO2,SO3+H2O=H2SO4.据此,对有关物质氧化性的相对强弱顺序判断正确的是()A.H2SO4>NO2>O2B.O2>SO3>H2SO4 C.NO2>O2>SO3D.O2>NO2>SO3 6.下列说法正确的是()A.电解法精炼铜是,以粗铜作阴极,精铜作阳极B.加热0.1mol/L的Na2CO3溶液,CO32﹣的水解程度和溶液的pH均增大C.1L 1mol/L的NaClO溶液中含有ClO﹣的数目为6。

山东省枣庄二中学2016-2017学年度高三化学期末复习自测题(三)学校:___________姓名:___________班级:___________考号:___________ 1.下列物质与其用途完全符合的有()①Na2CO3—制玻璃;②SiO2—太阳能电池;③Na2SiO3—木材防火剂;④NH3—制冷剂;⑤Al2O3—焊接钢轨;⑥NaClO—消毒剂、漂白织物⑦Fe2O3—红色油漆或涂料A.4个 B.5个 C.6个 D.7个2.设N A为阿伏伽德罗常数,下列叙述正确的是A.24g镁的原子最外层电子数为N AB.1L0.1mol·L-1乙酸溶液中H+数为0.1N AC.1mol甲烷分子所含质子数为10N AD.标准状况下,22.4L乙醇的分子数为N A3.下列化学用语正确的是A.丙烯的实验式C3H6 B.镁离子的结构示意图C.CO2的电子式 D.中子数为18的氯原子符号4.下列有关物质分类或归类正确的是()①混合物:盐酸、漂白粉、水玻璃、水银②化合物:CaCl2、NaOH、HCl、HD③电解质:明矾、蓝矾、冰醋酸、氯化银④同素异形体:C60、C70、金刚石、石墨⑤放热反应:盐酸与氢氧化钠、碳酸钙高温分解、甲烷燃烧A.④⑤ B.②③④ C.①③④ D.③④5.下列离子方程式书写正确的是()A.用FeCl3溶液腐蚀铜线路板:Cu + Fe3+= Cu2+ + Fe2+B.Na2O2与H2O反应产生O2:2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑C.将铁溶于稀盐酸: 2Fe + 6H+ = 2Fe3+ + 3H2↑D.向氯化铝溶液中加入过量的氨水:Al3+ + 4NH3·H2O = AlO2- + 4NH4+ + 2H2O6.油条是我国北方的传统食品,其做法是将明矾,碱,食盐按比例加入温水中,再加入面粉搅拌成面团,放置,使面团产生气体,形成孔洞,达到柔顺,放置过程发生反应:3Na2CO3+2KAl(SO4)2·12H2O=3Na2SO4+K2SO4+3CO2↑+2A1(OH)3↓+21 H2O,下列有关判断正确的是( )A.从物质的分类角度来看,油条配方中的“明矾、碱”均属于盐B.放置过程发生的反应为氧化还原反应C.放置过程发生的反应中反应物和生成物均为电解质D.反应的离子方程式为:3CO32-+2KAl(SO4)2·12H2O=3Na2SO4+2K++4SO42-+3CO2↑+2Al(OH)3↓+21 H2O7.在8NH3 + 3Cl2 = N2+ 6NH4Cl反应中,被氧化的原子与被还原的原子的物质的量之比为A.8:3 B.1:3 C.3:8 D.3:122C.第③组反应中生成1 mol Cl2,转移电子2 mol>Cl2>Fe3+>Br2D.氧化性由强到弱顺序为MnO-49.在反应3Cl2 + 8NH3→ 6NH4Cl + N2中,设阿伏加德罗常数为N A。
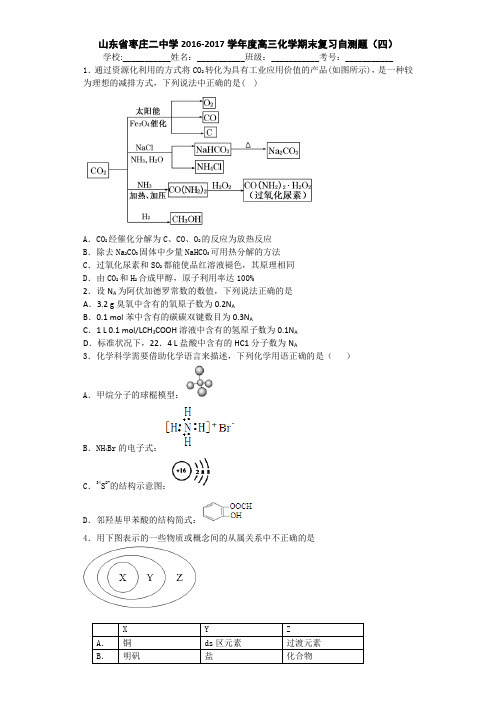
山东省枣庄二中学2016-2017学年度高三化学期末复习自测题(四)学校:___________姓名:___________班级:___________考号:___________ 1.通过资源化利用的方式将CO2转化为具有工业应用价值的产品(如图所示),是一种较为理想的减排方式,下列说法中正确的是( )A.CO2经催化分解为C、CO、O2的反应为放热反应B.除去Na2CO3固体中少量NaHCO3可用热分解的方法C.过氧化尿素和SO2都能使品红溶液褪色,其原理相同D.由CO2和H2合成甲醇,原子利用率达100%2.设N A为阿伏加德罗常数的数值,下列说法正确的是A.3.2 g臭氧中含有的氧原子数为0.2N AB.0.1 mol苯中含有的碳碳双键数目为0.3N AC.1 L 0.1 mol/LCH3COOH溶液中含有的氢原子数为0.1N AD.标准状况下,22.4 L盐酸中含有的HC1分子数为N A3.化学科学需要借助化学语言来描述,下列化学用语正确的是()A.甲烷分子的球棍模型:B.NH4Br的电子式:C.34S2-的结构示意图:D.邻羟基甲苯酸的结构简式:4.用下图表示的一些物质或概念间的从属关系中不正确的是5.下列关于离子共存或离子反应的说法正确的是( )A.某无色溶液中可能大量存在H+、Cl-、MnO4-B.大量氢离子的溶液中可能大量存在Na+、NH4+、SiO32-C.Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2 O2+2H+═2Fe3++2H2OD.稀硫酸与Ba(OH)2溶液的反应:H++SO42-+Ba2++OH-═BaSO4↓+2H2O6.近年来发现用铈(Ce)的氧化物可高效制取H2,制备原理如图所示,已知0<δ<2,下列说法不正确的是A.太阳能最终转变为化学能 B.CeO2是水分解的催化剂C.T<1050℃时,CeO2-δ比CeO2稳定 D.两步反应均属于氧化还原反应7.现将金属镁和铝的混合物7.5g完全溶解于一定浓度足量的硝酸溶液中,收集反应产生的A 气体。
山东省枣庄二中学2016-2017学年度高三化学期末复习过关题(五)学校:___________姓名:___________班级:___________考号:___________ 1.我国卫生部门制定的《关于宣传吸烟有毒与控制吸烟》的通知中规定:“中学生不准吸烟”。
香烟燃烧产生的烟气中,有多种有害物质,其中尼古丁(C10H14N2)对人体危害最大,下列说法正确的是A.尼古丁是由26个原子构成的物质B.尼古丁中C、H、O 三种元素的质量比为10:14:2C.尼古丁的相对分子质量是162gD.尼古丁中氮元素的质量分数为17.3 %2.用N A代表阿伏加德罗常数,下列说法正确的是()A.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为N AB.标准状况下,11.2LH2O所含的分子数为N AC.常温常压下,1.06gNa2CO3含有的Na+数为0.02N AD.18gH2O和H2O2的混合物含有的分子数为N A3.下列化学用语正确的是A.硫的原子结构示意图:B.顺-2-丁烯的结构简式:C.乙酸的实验式:C2H4O2D.原子核内有8个中子的氧原子:188O4.分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是A.冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物B.HClO、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸C.漂白粉、福尔马林、冰水、王水、氯水均为混合物D.Na2O,NaOH,Na2CO3,NaCl,Na2SO4,Na2O2都属于钠的含氧化合物5.常温下,下列各组离子在指定溶液中能大量共存的是()A.c(H+)/c(OH﹣)=1012的水溶液中:NH4+、Al3+、NO3﹣、Cl﹣B.水电离出的c(H+)=10﹣12mol/L的溶液中:Ca2+、K+、Cl﹣、HCO3﹣C.pH=1的溶液中:Fe2+、NO3﹣、SO42﹣、Na+D.c(Fe3+)=0.1mol/L的溶液中:K+、ClO﹣、SO42﹣、SCN﹣6.从元素化合价变化的角度分析,下列反应中,画线的物质发生氧化反应的是:A、SO2 + 2NaOH = Na2SO3 + H2OB、2CuO + C2Cu + CO2↑C、2FeCl3 + Fe = 3FeCl2D、MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑7.3.04 g铜镁合金完全溶解于100mL密度为1.40g•mL-1、质量分数为63%的浓硝酸中,得到NO2 和N2O4的混合气体2240 mL(标准状况),向反应后的溶液中加入2.00 mol·L-1 NaOH溶液,当金属离子全部沉淀时,得到5.08g沉淀。
山东省枣庄二中学2016-2017学年度高三化学期末复习过关题(六)学校:___________姓名:___________班级:___________考号:___________1.著名化学家、诺贝尔奖获得者西博格博士1979年在美国化学会成立100周年大会上的讲话中指出“化学是人类进步的关键”。
下列对化学的认识不.正确的是 A .英国科学家道尔顿1661年提出化学元素的概念,标志着近代化学的诞生B .化学是在原子、分子水平上认识物质的组成、结构、性质、变化、制备和应用的自然科学C .化学既是一门具有创造性的科学,还是一门具有实用性的科学D .现代化学还将在能源与资源、材料科学、环境科学、医药与健康等领域产生广泛的影响2.用N A 表示阿伏伽德罗常数的值。
下列叙述正确的是( )A .常温常压下,92g 的NO 2和N 2O 4混合气体中含有原子数为6N AB .惰性电极电解食盐水,若电路中通过N A 个电子,则阳极产生气体11.2LC .0.25mol Na 2O 2中含有的阴离子数为0.5N AD .由“C(石墨)=C(金刚石) ΔH=+1.9kJ ·mol -1”可知,金刚石比石墨稳定3.下列化学表达方式不正确...的是 A .中子数为20的氯原子:37Cl B .S 2-的结构示意图:C .CCl 4的电子式:D .24.下列物质按纯净物、混合物、电解质、非电解质的顺序组合的一组为A .生石灰、漂白粉、氯化铜、碳酸钠B .胆矾、盐酸、铁、碳酸钙C .蒸馏水、氨水、碳酸氢钠、二氧化硫D .纯盐酸、空气、硫酸、干冰5.今有一混合物的水溶液,只可能含有以下离子中的若干种:K +、NH 4+、Cl -、Mg 2+、Ba 2+、CO 32-、SO 42-,现取三份100 mL 溶液进行如下实验:(1)第一份加入AgNO 3溶液有沉淀产生;(2)第二份加足量NaOH 溶液加热后,收集到气体0.04 mol ;(3)第三份加足量BaCl 2溶液后,得干燥沉淀6.27 g ,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g 。
山东省枣庄二中学2016-2017学年度高三化学期末复习自测题(一)学校:___________姓名:___________班级:___________考号:___________ 1.海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
下列有关说法不正确的是A.工业上通过电解熔融状态MgCl2制取金属镁B.用澄清的石灰水可鉴别NaHCO3和Na2CO3C.在第②、④步骤中,溴元素均被氧化D.制取NaHCO3的反应是利用其溶解度小于NaCl2.36.5 g HCl溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρg·mL -1,质量分数为w,物质的量浓度为c,NA表示阿伏加德罗常数的数值,则下列叙述中正确的是( )A.所得溶液的物质的量浓度:c=1 mol·L-1B.所得溶液中含有N A个HCl分子C.36.5 g HCl气体占有的体积为22.4 LD.所得溶液的质量分数:w=36.5c/(1000ρ)3.下列化学用语正确的是A.亚硫酸氢钠溶液显酸性的原因是:HSO3-+H2O H3O++SO32-B.氯化铵的电子式为:C.钠离子的离子结构示意图为:NaD.水分子比例模型为:4.下列说法正确的是A.H、D、T属于同位素,H2、D2、T2属于同素异形体B.氯水、氨水、王水是混合物,水银、水玻璃是纯净物C.HCl、NH3、BaSO4是电解质,CO2、Cl2、CH3CH2OH是非电解质D.水能、风能是可再生能源,煤、石油、天然气是不可再生能源5.下列离子方程式正确的是A.在氯化铝溶液中加入过量烧碱溶液:Al3++4OH-=AlO2-+2H2OB.在硫酸铜溶液中加入过量氢氧化钡溶液:Ba2++SO42-=BaSO4↓C.在澄清石灰水中通入少量二氧化碳:CO2+OH-=HCO3-D.在碳酸氢钙溶液中加入过量苛性钾溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O6.从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4.下列说法正确的是A.产物中的SO42-离子有一部分是氧化产物B.5molFeS2发生反应,有10mol电子转移C.Cu2S既是氧化产物又是还原产物D.FeS2只作还原剂7.0.44 g铜镁合金完全溶解于100 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,溶液,当金属离子全部沉淀时,得到0.78 g沉淀。
山东省枣庄二中学2016-2017学年度高三化学期末复习自测题(二)学校:___________姓名:___________班级:___________考号:___________ 1.化学与生活、社会发展息息相关,下列有关说法不正确的是A.食盐可作调味剂,也可作食品防腐剂B.Na2O2和Na2O均可常用作呼吸面具中的供氧剂C.“熬胆矾铁釜,久之亦化为铜”,是因为熬制过程发生了置换反应D.古剑“沈卢”“以剂钢为刃”柔铁为蒸干,不尔则多断折”,剂钢是指铁合金2.设N A为阿伏加德罗常数值。
下列说法中正确的是()A.122.5 g KClO3中含Cl-数目为N AB.1 mol·L-l的NaOH溶液中含Na+数目为N AC.标准状况下,22.4L水中含氢原子数目为2N AD。
常温常压下,32 g SO3中含氧原子数目为1.2N A3.化学学科需要借助化学专用语言描述,下列有关化学用语正确的是A.CO2分子比例模型:B.NH 4I的电子式: N[H + -C.乙醇的结构简式:C2H5OHD.K+最外层电子排布式:4S24P64.化学概念在逻辑上存在如右下图所示关系。
对下列概念的说法正确的是A.氧化还原反应与放热反应属于包含关系 B.溶液与胶体属于并列关系C.化合物与碱性氧化物属于交叉关系 D.化合物与电解质属于重叠关系5.下列关于离子共存或离子反应的说法正确的是A.某无色溶液中可能大量存在H+、Cl-、MnO4-B.pH=2的溶液中可能大量存在Na+、NH4+、SiO32-C.Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2OD.稀硫酸和氢氧化钡溶液反应:H++SO42—+Ba2++OH—=BaSO4↓+H2O6.稀硫酸酸化后的软锰矿(主要成分为)悬浊液可用于吸收燃煤尾气中的,得到可与反应制备电池材料,同时生成。
下列用来解释事实的方程式不正确的是A.吸收的反应:B.作为碱性电池正极材料时的放电反应:C.与反应制备D.尾气中的还可用足量的氨水吸收:2A .第①组反应的其余产物为H 2O 和O 2B .第②组反应中Cl 2与FeBr 2的物质的量之比为1∶2C .第③组反应中生成1 mol Cl 2,转移电子2 molD .氧化性由强到弱顺序为MnO 4->Cl 2>Fe 3+>Br 28.将一定量的氯气通入30 mL 浓度为10.00 mol/L 的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl 、NaClO 、NaClO 3共存体系。
山东省枣庄二中学2016-2017学年度高三化学期末复习过关题(三)学校:___________姓名:___________班级:___________考号:___________ 1.化学与环境密切相关,下列有关说法正确的是A.酸雨是pH小于7的雨水B.合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺C.CO2、NO2或SO2都会导致酸雨的形成D.大气中CO含量的增加会导致温室效应加剧2.用N A表示阿伏加德罗常数的值,下列说法正确的是A.11.2 L H2中含有氢原子的个数为N AB.在标准状况下,22.4 L H2O中含有氢原子的个数为2N AC.32 g O3中含有氧原子的个数为2N AD.1 mol/L NaCl溶液中含有钠离子的个数为N A3.有关化学用语的表述正确的是A.轨道表示式表示N2中的共用电子对:B.只能是氢分子的比例模型C.只能是氮分子的球棍模型D.CH4分子的比例模型:4.下列说法正确的是A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物B.蔗糖、硫酸钡和水分别属于非电解质、弱电解质、弱电解质C.Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到D.天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源5.常温下,下列各组离子在指定溶液中能大量共存的是()A.c(H+)/c(OH﹣)=1012的水溶液中:NH4+、Al3+、NO3﹣、Cl﹣B.水电离出的c(H+)=10﹣12mol/L的溶液中:Ca2+、K+、Cl﹣、HCO3﹣C.pH=1的溶液中:Fe2+、NO3﹣、SO42﹣、Na+D.c(Fe3+)=0.1mol/L的溶液中:K+、ClO﹣、SO42﹣、SCN﹣6.过氧化氢(O为—1价)在二氧化锰催化作用下分解放出氧气的反应机理如下:①MnO2 + H2O2 + 2H+ = Mn2+ + O2↑ + 2H2O ②Mn2+ + H2O2 = MnO2 + 2H+下列说法正确的是A.H2O2在①中是氧化剂,在②中是还原剂B.在①中每生成1 mol O2,转移的电子数为1.204×1024C.Mn2+在①中是还原产物,在②中是氧化产物D.在二氧化锰催化作用下,1 mol H2O2分解生成22.4 L O27.氮氧化铝(AlON)是一种透明高硬度防弹材料,可以由反应Al2O3+C+N2=2AlON+CO(高温)合成,下列有关说法正确的是A.氮氧化铝中氮的化合价是-3B.反应中氮气作氧化剂C.反应中每生成5.7g AlON 同时生成1.12 L CO8.已知M2O n2- 离子可与R2- 离子作用,R2- 被氧化为R单质,M2O n2-的还原产物中,M 为+3价;又如c(M2O n2 )=0.3 mol•L 的溶液100 mL可与c(R2- )=0.6 mol•L 的溶液150 mL恰好完全反应,则n值为A.4 B.5 C.6 D.79.某温度下,将Cl2通入KOH溶液中得KCl、KClO3和KClO的混合溶液。
经测定ClO3-和ClO-物质的量之比为2:1,则反应中被还原的Cl2与被氧化Cl2的物质的量之比为( )A.2:3 B.3:4 C.11:3 D.10:310.还原2.4×10-3 mol [XO(OH)3]+ 到X元素的低价态时,消耗0.2mol·L—1的Na2SO3溶液30 mL,则X元素反应后的价态是()A.+1 B.-1 C.0 D.-211.金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。
工业上以金红石为原料制取Ti的反应为aTiO2 + bCl2+eC aTiCl4+eCO ⅠTiCl4+2Mg Ti+2MgCl2Ⅱ关于反应Ⅰ、Ⅱ的分析不正确的是①TiCl4在反应Ⅰ中是还原产物,在反应Ⅱ中是氧化剂;②C、Mg在两个反应中均被还原;③在反应Ⅰ、Ⅱ中Mg的还原性大于C,C的还原性大于TiCl4;④a=1,b=e =2 ⑤每生成19.2 g Ti,反应Ⅰ、Ⅱ中共转移4.8 mol e-。
A.①②④ B.②③④ C.③④ D.②③⑤12.已知下列反应:Co2O3 + 6HCl(浓) 2CoCl2 + Cl2↑+ 3H2O (I)5Cl2 + I2 + 6H2O 10HCl + 2HIO3(II)下列说法正确的是A.反应I中HCl是氧化剂B.反应II中Cl2发生氧化反应C.还原性:CoCl2>HCl > I2D.氧化性:Co2O3> Cl2>HIO313.氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下:(1)试写出吸收塔中吸收剂Q反应的离子方程式:。
(2)六水合氯化铁在水中的溶解度如下:从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是:加入少量盐酸、、、过滤、洗涤、干燥。
再由FeCl3·6H2O晶体得到无水FeCl3的操作是:。
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)=mol·L-1。
(常温下Ksp[Fe(OH)3]=4×10-38)。
方程式。
(5)向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式。
请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释。
14.硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用.(1)一种以铜作催化剂脱硫有如下两个过程:①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:2SO2+2nCu+(n+1)O2+(2﹣2n)H2O═2n CuSO4+(2﹣2n) H2SO4从环境保护的角度看,催化脱硫的意义为;每吸收2molSO2,被SO2还原的O2的质量为 g.②利用如图1所示电化学装置吸收另一部分SO2,并完成Cu的再生.写出装置内所发生反应的离子方程式.(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如图2:①用离子方程式表示反应器中发生的反应是:②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是.Ⅱ.汽车尾气是造成雾霾天气的重要原因之一.已知氮的氧化物是汽车尾气的污染物,用如图3装置可监测其含量,电池中每转移0.4mole﹣,Pt 电极消耗 L氧气(标况下)该装置的负极反应式为.15.(12分)有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。
三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:(1)写出下列物质的化学式:A______________;H ___________;G________;乙__________;(2)写出下列反应的化学方程式反应①____________________________________________。
反应②____________________________________________。
16.如图表示各物质之间的转化关系。
已知D、E、Z是中学化学常见的单质,其他都是化合物。
Z、Y是氯碱工业的产品。
D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂。
E为日常生活中应用最广泛的金属。
除反应①外,其他反应均在水(1)写出X的电子式:。
(2)常温时pH =12的G溶液中,溶质的阳离子与溶质的阴离子浓度之差为(写出计算式)。
(3)在电镀工业中,若将E作为待镀金属,铜为镀层金属,则铜是____极,请写出在E电极上发生的电极反应式:。
(4)写出反应③的离子方程式:。
(5)现有无标签的Y和M的两种无色水溶液,不用其他任何试剂,请你设计一个简单的实验对这两种溶液加以鉴别(回答实验操作、现象及结论)。
(6)A溶液与NaOH溶液混合可形成沉淀,某温度下此沉淀的Ksp =2.097×l0-39。
将0.01 mol/L的A溶液与0.001 mol·L-1的NaOH溶液等体积混合,你认为能否形成沉淀____(填“能”或“不能”),请通过计算说明。
17.现在和将来的社会,对能源和材料的需求是越来越大,我们学习化学就为了认识物质,创造物质,开发新能源,发展人类的新未来。
请解决以下有关能源的问题:(1)未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。
下列属于未来新能源标准的是:________①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧(2)运动会上使用的火炬的燃料一般是丙烷(C3H8),请根据完成下列题目。
①已知11g丙烷(C3H8)在298K和101Kpa条件下完全燃烧生成CO2和液态水时放出的热量为555kJ,请写出丙烷燃烧热的热化学方程式:_____________;②以丙烷(C3H8)和空气为原料,稀硫酸为电解质溶液_____________(填能或不能)设计成池!若能,则写出通入丙烷(C3H8)的那一极为:_____________极;氧气在_____________极发生反应。
若不能,则理由是:_____________。
③丙烷在一定条件下发生脱氢反应可以得到丙烯。
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ·mol-1CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=+32.4kJ·mol-1则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)的△H=_______(3)已知:H—H键的键能为436KJ/mol,H—N键的键能为391KJ/mol,根据化学方程式:N2+3H22NH3ΔH=-92.4KJ/mol,①请计算出N≡N键的键能为_______________。
②若向处于上述热化学方程式相同温度和体积一定的容器中,通入1molN2和3molH2,充分反应后,恢复原温度时放出的热量_______________92.4KJ(填大于或小于或等于)。
18.I.2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。
请回答下列问题。
(填“有”或“无”)影响。
(2)已知单质硫的燃烧热为296kJ·mol-1,S(s)32O+2(g SO3(g)△H=—395kJ·mol-1,则图中△H= kJ·mol-1。
II.某温度时,在2L密闭容器中用O2和SO2合成SO3,它们的物质的量随时间的变化如图甲所示。
(1)列式并计算该反应在0—3min内产物SO3的平均反应速率。